單細胞分選技術助力細胞系構建分析膠質母細胞瘤實現“免疫逃逸”
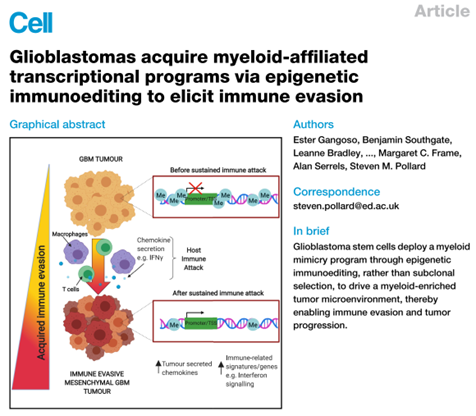
膠質母細胞瘤(GBM)在基因組、轉錄組和表觀遺傳層面上表現出高度的腫瘤內和腫瘤間異質性。GBM與腫瘤免疫微環境之間的相互作用在腫瘤的發生和發展中起著重要作用。然而,GBM如何促進腫瘤免疫微環境的機制仍然不清楚。英國愛丁堡大學再生醫學中心的Steven M. Pollard團隊[1]通過體外試驗和動物模型發現,膠質母細胞瘤干細胞(glioblastoma stem cell, GSC)通過表觀遺傳途徑進行免疫編輯,促進髓系細胞的招募,形成富含髓系細胞的腫瘤微環境,從而實現免疫逃逸并促進腫瘤進展。
本文中細胞分選及細胞系的構建均采用單細胞可視化分選培養系統isoCell。該系統可確保分選出的細胞100%為單細胞,可以實現高通量、自動化、高成活率的單克隆細胞系構建、微生物分選與培養、單細胞分選、單細胞組學等功能。

單細胞可視化分選培養系統isoCell
研究者在BL6小鼠的神經干細胞中分別引入了五種已確定的GBM驅動突變(包括EGFRvⅢ過表達、PDGFRA過表達、以及NF1、PTEN和TP53的基因敲除)(圖1A)。隨后,研究者將這些突變組合在一起以模擬GBM。他們通過同時敲除NF1和PTEN并過表達EGFRvIII,形成了帶有三重突變的NPE細胞系(圖1B-C)。在這種細胞系中,可以觀察到小鼠體內出現侵襲性的腫瘤生長和浸潤(圖1D),以及GBM的典型特征(圖1E-H),可以用其來模擬腫瘤細胞與腫瘤微環境(TME)的相互作用。為了對照,研究者在免疫缺陷的NSG小鼠中平行生成了相應的腫瘤(圖1I)。NPE腫瘤能夠誘發BL6小鼠的免疫反應,在BL6小鼠中的生長速度比在NSG小鼠中更慢(圖1J),而且大多數BL6宿主能夠在腫瘤檢測不到的情況下長期生存(圖1G)。這些數據表明,BL6小鼠的宿主免疫系統對NPE細胞產生了反應,并限制了腫瘤的生長。
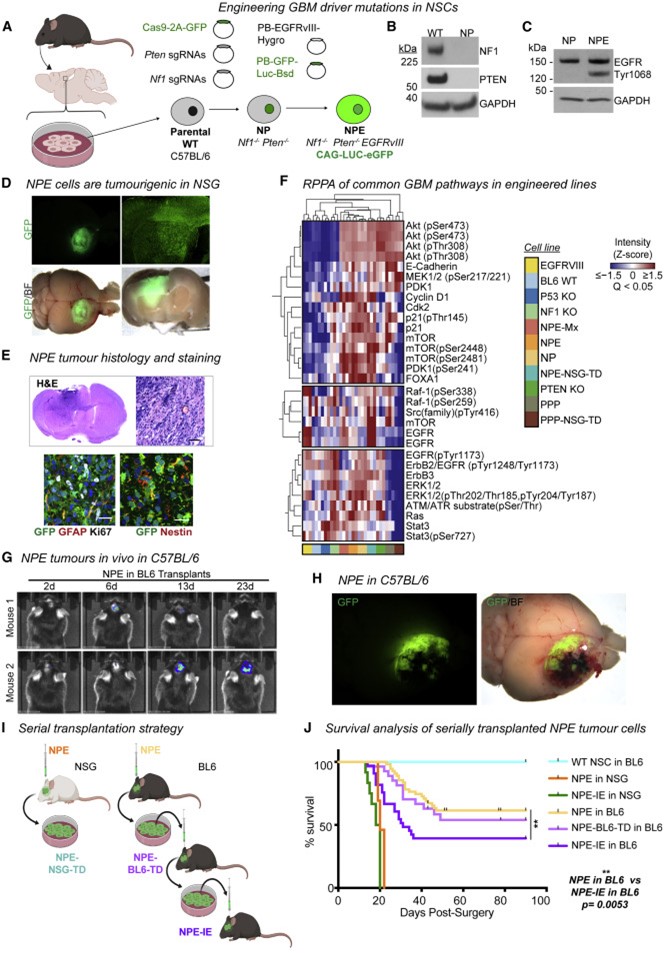
圖1 工程GSC在連續移植中獲得免疫逃逸能力
因此,通過對腫瘤細胞進行連續移植后的原代培養,可以富集獲得免疫逃逸能力的細胞。研究者在進行三輪BL6小鼠移植及其腫瘤原代培養后,發現NPE-IE細胞表現出更強的腫瘤形成能力(圖1I),并且小鼠的生存期顯著縮短(圖1J),這表明NPE-IE細胞獲得了免疫逃逸的能力。這與免疫編輯的概念相符,即宿主的持續免疫攻擊導致了具有更強免疫逃逸能力的細胞的出現。
為了揭示NPE-IE細胞獲得免疫逃逸能力的內在機制,研究者將NPE細胞和NPE-IE細胞分別與野生型NSCs進行了對比。然而,通過核型分析和全基因組測序,結果顯示無論是倍性、結構還是點突變都沒有顯著異常(圖2A),這表明NPE-IE腫瘤的獲得性免疫逃逸并非源于克隆進化或經典的遺傳免疫編輯過程。進一步的轉錄組分析發現,轉錄因子Ccl9和Irf8的高表達可能與“訓練”免疫逃逸有關(圖2B、2F)。既往研究已表明,Ccl9與致瘤性微環境的建立有關,這可以解釋NPE-IE腫瘤中髓系細胞的增加;而Irf8表達的上調則令人意外,因為它作為髓系特異性轉錄因子通常僅在造血細胞中表達,參與髓樣細胞和巨噬細胞的分化。綜上所述,研究者發現機體對NPE細胞的免疫攻擊可以引發腫瘤顯著的轉錄改變。
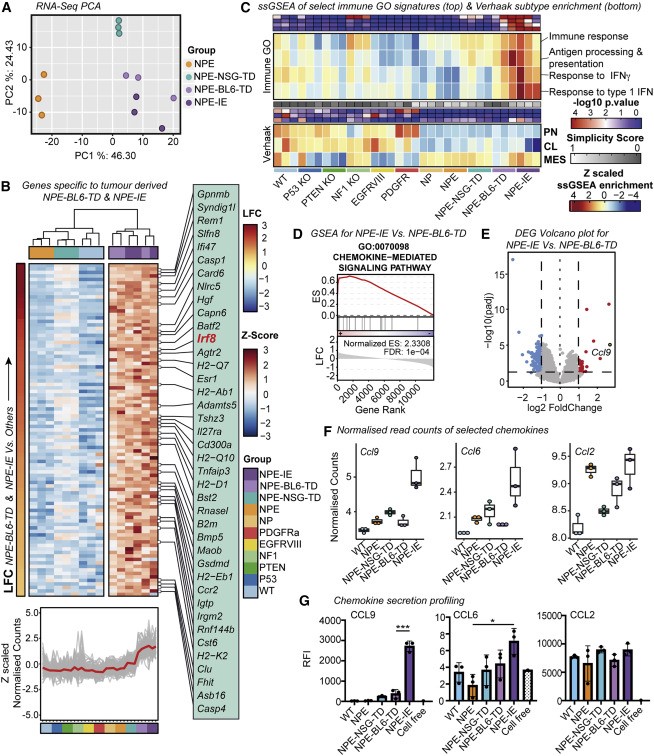
圖2 免疫逃避細胞在免疫攻擊后進行了顯著的轉錄重組
研究者還發現,腫瘤細胞中許多基因的去甲基化與免疫逃逸有關(圖3D)。最顯著的甲基化變化出現在Irf8的啟動子和編碼區,其低甲基化與轉錄活性的增加相一致(圖3D-E)。

圖3 NPE-IE細胞的免疫逃逸特性通過表觀遺傳免疫編輯而強化
巨噬細胞可以通過干擾素γ(IFNγ)誘導的STAT1信號通路來引發Irf8的表達。研究者通過體外實驗發現,來自免疫腫瘤微環境的慢性IFNγ信號可能會刺激NPE細胞中Irf8的表達激活(圖4B-C),且這種激活與Irf8位點的DNA去甲基化狀態相一致。JAK/STAT抑制劑托法替尼未能逆轉NPE-IE細胞中IRF8的表達,這表明在NPE-IE細胞中,維持Irf8高表達的機制是不依賴于JAK/STAT的(圖4D)。

圖4 Irf8對IFNγ及TAM信號的應答在免疫逃逸中有重要作用
經過IFNγ處理后,NPE細胞中關鍵基因(如Irf8、H2-Ab1)出現了廣泛的激活(圖4E)。研究表明,浸潤的巨噬細胞群(F4/80+,CD45hi)可能會刺激免疫原性NPE細胞發生上述轉錄變化(圖4F),這表明腫瘤浸潤巨噬細胞可能是TME中IFNγ的主要來源。
研究者使用iotaSciences的單細胞可視化分選培養系統isoCell分選并培養了NPE-IE Irf8敲除細胞,隨后構建了相應的細胞系。NPE-IE Irf8敲除細胞系的腫瘤發展動力學與移植了NPE-IE細胞的小鼠相似(圖4H-I),證明Irf8的激活是NPE-IE細胞免疫逃逸的重要因素,并且這種激活可能通過體內的IFNγ信號介導。
文中使用的單細胞可視化分選培養系統—isoCell采用GRID技術,在培養皿上雕刻出單獨的細胞腔室陣列,并將單個細胞以納升體積全自動地分配到各個GRID單細胞腔室中。isoCell自帶的成像系統,可確保分選出的細胞100%為單細胞。isoCell可以將單細胞在GRID中培養成單克隆細胞系,培養過程中可以根據客戶需求進行換液操作,全流程可視化監控以保證每個單克隆細胞系均來自所挑選的單個細胞。
這項研究揭示了GBM細胞在受到免疫攻擊后,通過表觀遺傳重組和髓系特異性轉錄因子的表達,增強TME的免疫抑制性,促進腫瘤細胞的免疫逃逸。這為監測免疫治療過程中GBM細胞的免疫逃逸及制定新的免疫治療策略提供了新的思路,對于在GBM中發現的表觀遺傳免疫編輯過程是否也適用于其他腦瘤或癌癥,將具有重要意義。
樣機體驗:
為更好地服務中國科研工作者,Quantum Design 中國也建立了樣機演示實驗室,將為大家提供為專業的售前、銷售、售后技術支持,歡迎各位老師通過撥打電話010-85120280、發送郵件info@qd-china.com、點擊此處或掃描下方二維碼參觀試用!

參考文獻:
[1]. Gangoso, E., Southgate, B., Bradley, L., Rus, S., Galvez-Cancino, F., McGivern, N., ... & Pollard, S. M. (2021). Glioblastomas acquire myeloid-affiliated transcriptional programs via epigenetic immunoediting to elicit immune evasion. Cell, 184(9), 2454-2470.