文獻解讀:單細胞多組學揭示人類癌細胞系的細胞異質性

期刊:nature communications
影響因子:14.7
主要技術:scRNA-seq;scATAC-seq;癌細胞異質性
背景
人類癌細胞系長期以來一直是癌癥進展研究和藥物發現的工具,但由于癌細胞系的建立涉及到對適應體外培養條件的腫瘤細胞的選擇,因此通常認為癌細胞系是同質的,無法保持原腫瘤的異質性。然而,已經證實細胞系可以進化并發展成不同的細胞系。最近研究表明,通過使用單細胞RNA測序(scRNA-seq)和熒光激活細胞分選(FACS)等技術可以在已建立的細胞系中檢測細胞多樣性。細胞系內轉錄組異質性促進了上皮-間質轉化和耐藥的關鍵調控因子的發現,使這些細胞系可能成為研究藥物敏感性的分子機制和測試不同治療方案的合適模型。因此,了解常用人類癌細胞系的異質性不僅將為基于細胞系的生物醫學研究提供重要信息,而且有助于確定合適的模型來研究特定癌癥表型的新機制。
腫瘤內異質性的起源通常上被認為是遺傳方面的,但已經擴展到表觀遺傳學和微環境的急劇變化。盡管scRNA-seq可以有效地解決轉錄程序的異質性,但它無法揭示潛在的驅動力,如表觀遺傳因素。為此,需要捕捉細胞間表觀遺傳景觀變化的技術。由于染色質可及性在很大程度上可以反映轉錄因子結合、組蛋白修飾和DNA甲基化,并為基因調控機制提供了更深入的了解,轉座酶可及性染色質單細胞測序分析(scATAC-seq)最近成為單細胞分辨率表觀基因組分析中使用最廣泛的分析方法。與scRNA-seq相比,scATAC-seq的一個主要優勢是它提供了轉錄因子調控基因的機制。scRNA-seq和scATAC-seq在癌癥標本中的聯合應用有助于識別精確的順式調控元件和靶基因,以及識別控制腫瘤發展的關鍵調控網絡。
主要技術
scRNA-seq;scATAC-seq;癌細胞異質性
研究結果
1. 單細胞轉錄組測序揭示癌癥細胞系內的潛在轉錄異質性
本研究選取了分布在9個譜系中以實體腫瘤為主的40個人癌細胞系和2個人正常細胞系進行scRNA-seq分析(圖1a)。為了提高scRNA-seq實驗的通量和降低成本,每次運行scRNA-seq時,收集來自不同譜系的三株細胞系,然后根據其表達特征計算分配給相應的細胞系(圖1b)。總共獲得了23,089個細胞,平均每個細胞系513個細胞,34,641個轉錄本,每個細胞捕獲5859個基因,顯示了該數據集的高質量。為了進一步檢驗我們的scRNA-seq實驗的可重復性,在兩個獨立的實驗中分析了三個細胞系,包括Caco2、SCC-4和MDA-MB-231。結果顯示,同一細胞系的細胞在兩個獨立的實驗運行中測量是混合的(圖1c)。為了進一步了解特定的癌癥譜系,分別在UMAP中繪制了乳腺癌和結直腸癌細胞系。對于乳腺癌細胞系,luminal A (LA)、luminal B (LB)、Her2+ (H)、三陰性A (TNA)、三陰性B (TNB)等相同分子亞型的細胞彼此相鄰(圖1d)。ESR1主要在LA和LB亞型中表達,而ERBB2在LB和H亞型中表達上調(圖1e)。此外,分析了其他已知的具有臨床相關性的基質和上皮標志物的表達(圖1f)。
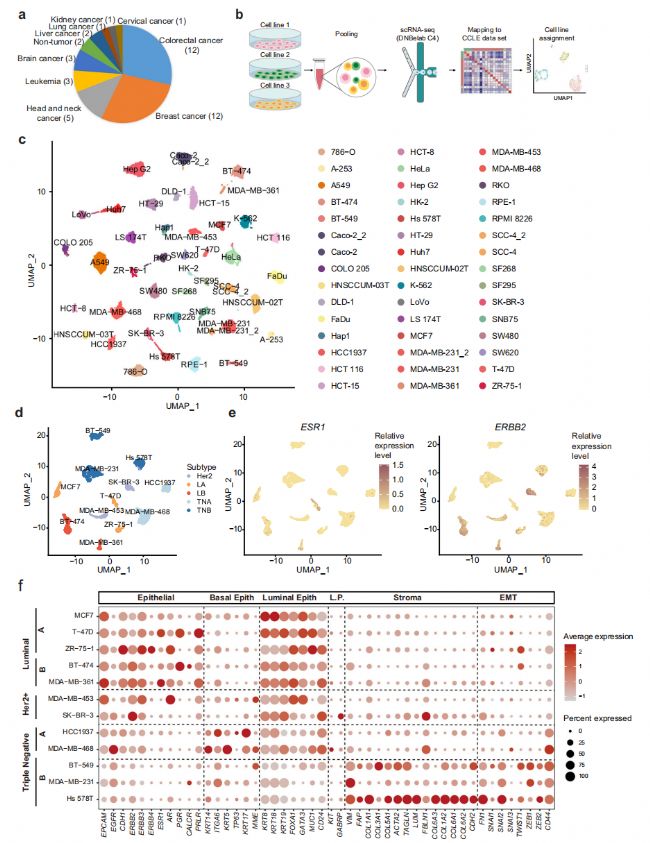
圖 1
2. 單個細胞系的轉錄組異質性
根據轉錄組異質性的模式。在UMAP中,42個細胞系大致可以分為離散型和連續型兩種類型(圖2a)。由于這些細胞系中存在亞克隆,不同的亞簇在空間上被觀察到是離散的,而連續的亞簇在亞簇之間沒有明確的邊界。總共有25個細胞系(57%)和17個細胞系(43%)分別屬于離散組和連續組(圖2b)。總體而言,離散/連續分類與多樣性得分相關性較好,其中多樣性得分最高的前25%的細胞系大多數是離散模式(圖2b),并且離散組的多樣性評分明顯高于連續組,這表明具有高度異質性的細胞系通常派生出不同的亞類。然而,也有一些離散細胞系的多樣性評分較低,如SW620,而連續模式細胞系的多樣性評分較高,如SK-BR-3(圖2b)。對于前者,簇內距離明顯小于簇間距離。因此,盡管在集體距離不是很大的情況下,該細胞系的多樣性得分較低,但根據分類,該細胞系呈現出離散的模式。對于后者,集體距離可以很大,而簇內距離與簇間距離沒有顯著差異。綜上所述,兩個指標顯示的細胞系內異質性表明,轉錄組多樣性可能受到不同亞克隆的存在以及細胞系內在可塑性的影響,這兩個因素對細胞系內異質性的貢獻在單個細胞系中有所不同。
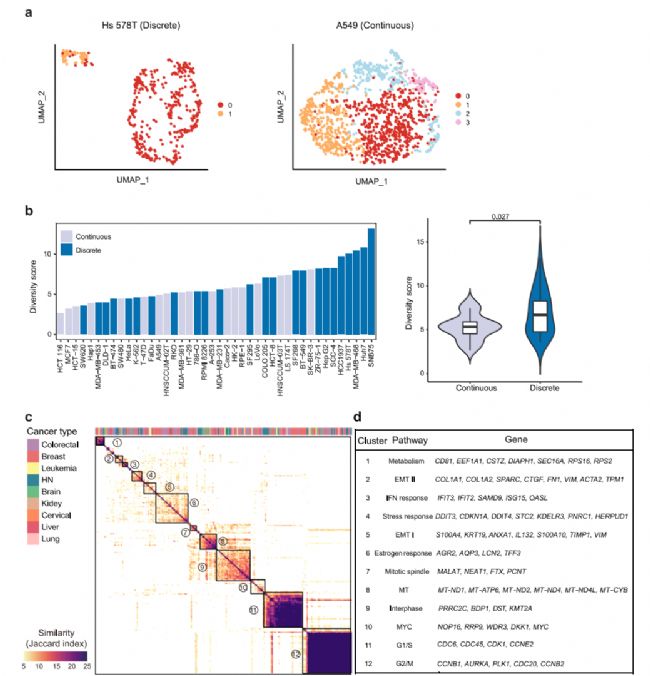
圖 2
3. 轉錄組異質性形成的分子特征
接下來,將相似的NMF合并到NMF集群中,以確定40個癌細胞系中的復發性NMF程序。在3個以上的細胞系中鑒定出了12個異質性激活的簇(圖2c)。隨后,基于同一簇內單個程序之間的共有基因,其中出現在超過25%的程序中的基因被用作標志基因。大多數細胞系共有的兩個最突出的簇與細胞周期有關,包括G1/S和G2/M程序(圖2c、d),這表明細胞周期變化是大多數細胞系中觀察到的轉錄組異質性的主要原因。除了細胞周期相關的程序外,另外10個簇代表了各種關鍵的生物過程(圖2d)。
4. 人細胞系的泛癌scATAC-seq
進一步使用scATAC-seq在單細胞分辨率下研究單個細胞系內的表觀基因組異質性。為了提高通量和降低scATACseq實驗的成本,每次運行scATACseq時,最多合并6個具有不同表達譜的細胞系,然后根據差異表達基因的可及性特征計算分配給相應的細胞系(圖3a)。經過質量過濾,獲得54,597個高質量的單核,每個細胞系的中位數為1170個核(范圍從203到4391個核),每個細胞核的中位數片段為11,702個。然后,我們匯總scATAC-seq譜來計算開放染色質區域的基因組分布,結果顯示35.5%的ATAC峰定位在啟動子-近端區域(<±1.5 kb TSS)。使用UMAP將39個細胞系一起繪制,以呈現染色質水平上的細胞系間距離,每個細胞系形成一個不同的簇(圖3b)。為了在表觀基因組水平上評估細胞系內的異質性,我們將細胞劃分為細胞系內的初步集群。結果,62%的細胞系表現為無差別模式,38%的細胞系表現為差異模式(圖3c)。總體而言,不加區分差異分類與多樣性評分相關性良好,屬于差異組的細胞系的多樣性評分明顯高于不加區分組的細胞系(圖3d、e),這表明具有高度異質性的細胞系通常派生出不同的亞簇。
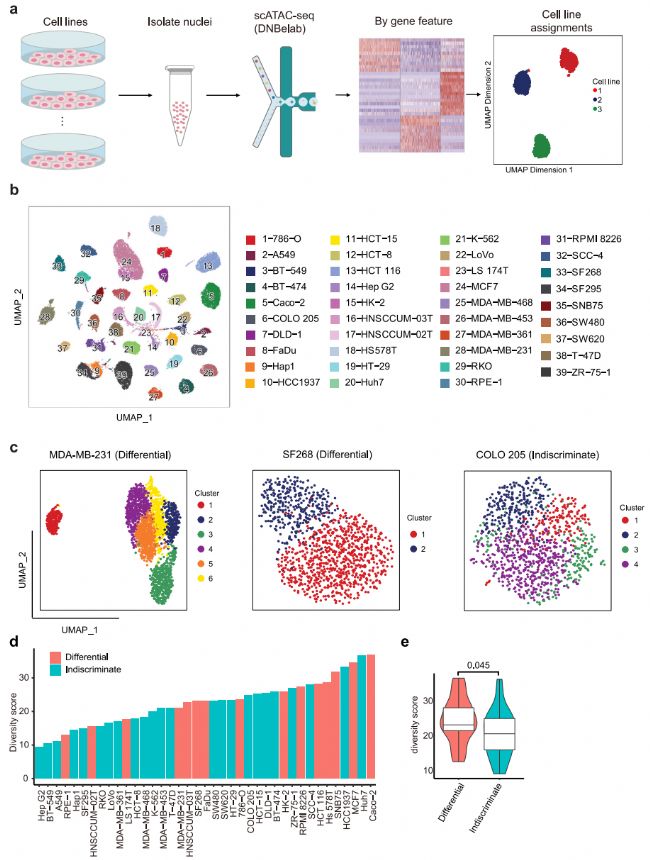
圖 3
5. 與CNVs相關的轉錄組異質性
為明確觀察到轉錄異質性的起源,我們首先轉向惡性腫瘤常見的遺傳變異。使用scRNA-seq數據分析大規模拷貝數變異(CNV),計算了與正常細胞相比,每個位點周圍400個基因平均表達水平。該分析在40個(62.5%)癌細胞系中鑒定出25個CNV亞克隆(圖4a、b),表明CNV誘導的拷貝數變異在很大程度上有助于轉錄變異;17個(42.5%)細胞系未顯示相關性(圖4b)。在這25個細胞系中,分別有18個和7個細胞系表現為離散型和連續型,其余15個細胞系中分別有6個和9個細胞系表現為離散型和連續型。這表明,當遺傳變異導致細胞系內部異質性時,細胞系傾向于以更離散的方式呈現異質性轉錄組活性。然后,研究了位于CNV區域的基因是否有助于這些匹配細胞系的轉錄組變異性。結果顯示,差異表達的基因確實在CNV區域顯著富集(圖4c),表明遺傳變異是決定離散型細胞系細胞系內異質性的重要因素。這一事實也表明,即使對于那些具有不同模式的細胞系,也存在其他因素影響轉錄組異質性。
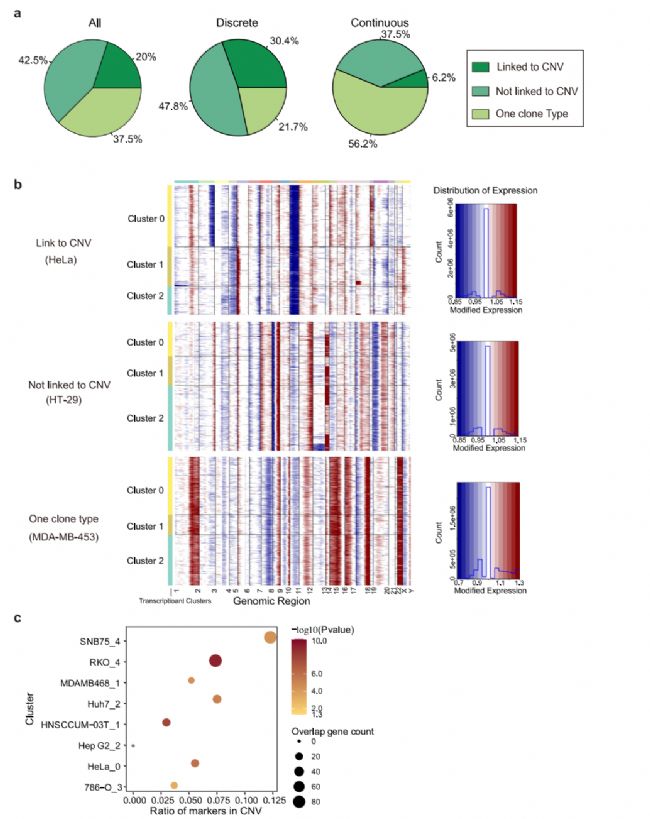
圖 4
6. 染色質可及性調控轉錄組異質性
為了探索表觀基因組異質性的機制,我們采用了包括ArchR28和ChromVAR30在內的兩種方法,試圖推斷驅動細胞亞簇之間差異染色質可及性的潛在轉錄因子,并重點研究了至少三種細胞系中出現的常見TF(圖5a)。參與調節IFN應答的IRF1、IRF2、IRF9和STAT2,在LS 174T和hnscum - 02t細胞系中被異質激活。然后,我們將重點放在分別在scRNA-seq和scATAC-seq數據中表現出離散和差異模式的7個細胞系上,試圖在兩個數據集之間匹配子簇。根據scATAC-seq數據計算基因評分矩陣,然后根據基因評分與基因表達的相似性進行比對。結果,在7個細胞系中的3個,包括MDA-MB-231、RPMI 8226和SNB75,細胞亞簇可以在兩個數據集之間自如匹配(圖5b、c、d)。根據scATAC-seq和scRNA-seq數據,MDA-MB-231細胞分別聚為4個和3個亞組,其中scATAC-seq數據集的亞組2與scRNA-seq數據集的亞組1和2的混合匹配。對于SNB75,,scATAC-seq數據的3亞組與scRNA-seq數據的0和1亞組的混合匹配,其余scATAC-seq數據的亞組與scRNA-seq亞組呈一對一的相關性(圖5b、c、d)。這表明染色質可及性和CNV的異質性可以獨立促成轉錄組異質性,對于這三種細胞系,染色質可及性對轉錄組異質性有很大貢獻。
為了進一步探索驅動異質染色質可及性和RNA表達的分子機制,我們試圖推斷結合差異可及性染色質區域的潛在TF。通過測量基因組特征集內染色質可及性的增益或損失來推斷TF活性,同時控制技術偏差,揭示潛在的TF在亞群之間表現出可變性(圖5e)。在MDA-MB-231中,發現FOXA2的活性在0亞組中特異性上調(圖5f),FOXA2的啟動子可及性在0亞組中也有所增加(圖5g)。我們隨后分析了FOXA2的下游靶標,發現它們與“Kras_signaling_up”相關的基因更多相關(圖5h),這些基因在0亞組中表達上調(圖5i)。FOXA2可以在腫瘤發育過程中協同KrasG12D的激活。我們的結果表明FOXA2可能在控制異質性中起重要作用。
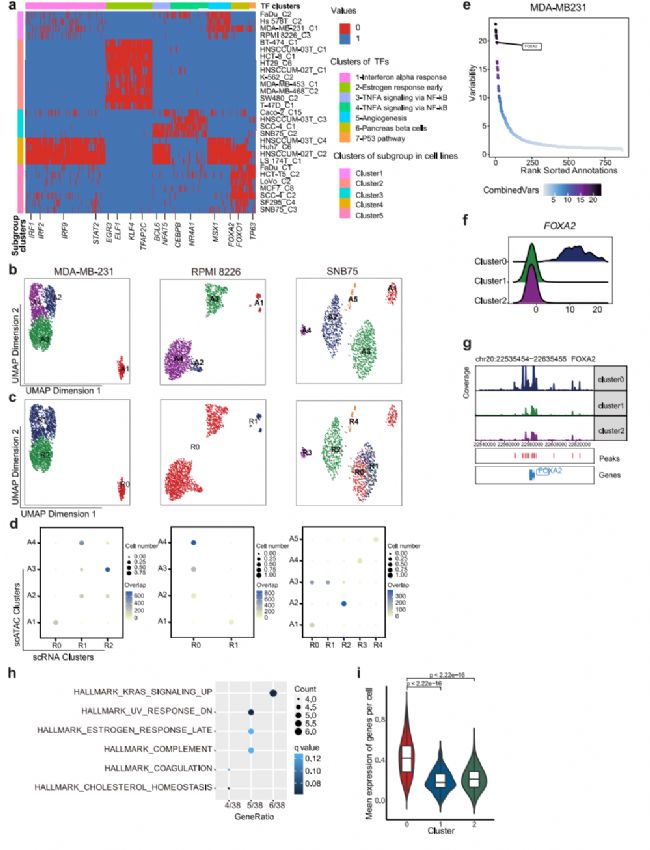
圖 5
7. ecDNA分布誘導的轉錄組異質性
最近的研究表明,癌基因擴增既存在于染色體上,也存在于染色體外環狀dna (ecDNAs)上。由于在ecDNA中沒有著絲粒,與染色體擴增子相比,它們不太穩定,并且隨機地分離到子細胞,這可能是細胞異質性的潛在驅動力。為了研究ecDNA對轉錄組異質性的貢獻,我們首先建立了一種分析方法,該方法能夠利用scATAC-seq數據檢測高潛力的ecDNA區域,基于以下假設:(1)ecDNA高度擴增;(2) ecDNA具有更高的可及性。根據scATAC-seq數據,在每個單細胞中讀取覆蓋率呈現多個峰,其中第一個峰被認為是兩個拷貝基因組區域的讀取覆蓋率,因此在這里定義為參考覆蓋率。為了尋找潛在的ecDNA片段,我們首先將整個基因組分成100,000 bp的bin,在歸一化測序深度后量化每個細胞中每個bin的讀取覆蓋率。然后,我們計算相對讀取覆蓋率,作為每個bin的覆蓋率與單元的參考覆蓋率的比率。由于ecDNA具有更高的可及性,相對覆蓋率至少為6的區域被定義為潛在的ecDNA片段,并通過TSS富集評分和細胞數量進一步過濾。此外,考慮到scATAC-seq數據的稀疏性,如果由于實驗和作圖偏差,該區域沒有被scATAC-seq讀取均勻和充分覆蓋,即使來自連續基因組區域的ecDNA也可以基于scATAC-seq數據檢測到多個ecDNA片段。因此,我們已經鑒定的ecDNA片段的數量應該高于在細胞中發現的不同ecDNA物種的數量。
為了解決這個問題,研究了它們在單個細胞系中不同潛在ecDNA片段之間的讀取覆蓋率的相關性,并將附近和高度相關的片段合并為潛在的ecDNA區域。然后,我們將合并的區域定義為潛在的ecDNA區域。如圖6a所示,在31個細胞系中,每個細胞系中檢測到229個潛在的ecDNA區域。我們的方法成功地發現了實驗證實的ecDNA,如K562中的chr9:130700000-131400000,其中ABL1和NUP214位于11中。致癌基因在潛在的ecDNA區域顯著富集(圖6a)。與沒有致癌基因的ecDNA相比,在單個細胞系中,含有致癌基因的ecDNA出現在更高比例的細胞中(圖6b),這表明含有致癌基因的ecDNA為細胞提供了生長優勢,因此具有異質性。考慮到ecDNA可以通過增加DNA拷貝數來增加轉錄RNA的數量,我們進一步計算了ecDNA上的基因表達與ecDNA在每個細胞中的相對覆蓋數之間的相關性,發現它們是部分相關的(圖6c)。例如,位于SCC-4細胞系不同ecDNA中的基因KRT14和KRT17、LGALS2、SERPINE1和PCOLCE在SCC-4細胞系中以不同的三個亞簇特異性表達(圖6d)。鑒定這些基因高表達的細胞比例與含有這些基因的ecDNA的細胞比例高度相關(圖6e)。這一結果表明,ecDNA的高拷貝數有助于ecDNA中基因的高表達。為了進一步評估ecDNA對轉錄異質性的影響,我們選擇了MDA-MB231,其scATAC-seq和scRNA-seq數據可以整合(圖5b-d),以反映scRNA-seq數據分析的UMAP中ecDNA的拷貝數。如圖6f所示,Chr12: 5900000_7200000 ecDNA在亞簇0中特別富集。同時,位于該ecDNA上的CD9、LTBR、PTMS、TPI1、ENO2、C12orf57等基因在亞簇0中也有高表達(圖6g), CD9是亞簇0的頂級標記基因之一。這些結果表明,ecDNAs可以影響基因表達,從而影響細胞聚集。
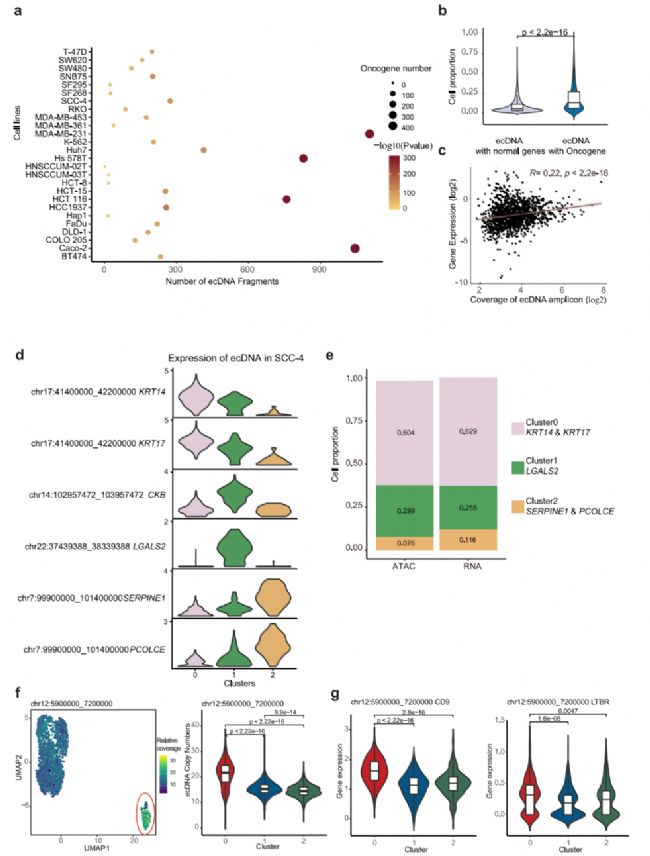
圖 6
8. 低氧處理重塑細胞系內異質性
腫瘤的發生和發展是一個動態的過程,伴隨著微環境的劇烈變化。微環境在腫瘤進展、治療抵抗和轉移形成中發揮重要作用,并增加了另一層調控,可驅動腫瘤內異質性。在這里,我們試圖評估這些轉錄組異質性在不同條件下是靜態的還是可塑性的。鑒于在實體瘤中,腫瘤細胞經常處于不同程度的缺氧狀態,我們選擇缺氧處理作為環境應激進行擾動,結果顯示,缺氧處理后,低氧相關基因發生了顯著變化。為了匹配缺氧治療前后的細胞亞群,我們觀察到兩種類型的相關模式:(1)細胞簇在缺氧處理前后是一對一匹配的,這表明缺氧處理沒有改變細胞簇之間的差異,如ZR-75-1(圖7a);(2)一些細胞簇從一個分裂到多個,這表明一個細胞簇內的細胞可能對缺氧有不同的反應,如DLD-1和SW620(圖7c、e)。為了確定在一個亞群中引起對缺氧應激差異反應的潛在機制,我們重點研究了在缺氧下分裂的亞群。例如,在缺氧條件下,DLD-1的子簇0分為2個簇(圖7c)。我們檢查了集群0和0-1/0-2之間的差異表達基因(DEGs):集群0和0-1之間變化最大的基因是缺氧相關基因,如BNIP3L、SLC2A1和ERO1A,而集群0和0-2之間的缺氧相關DEGs有限(圖7d)。這表明原簇0中存在兩組細胞對缺氧的反應不同,但在缺氧處理前的轉錄水平差異不明顯。同樣,在SW620細胞中,簇0被分為簇0-1和簇0-2(圖7e);盡管所有細胞都對缺氧有反應,但簇0-1中的細胞顯示了與EMT相關的其他基因的變化(圖7f)。

圖 7
先前的研究表明,組蛋白修飾和特異性TF結合的變化可能先于基因表達的變化,并預示著基因表達的變化,這表明引發的染色質狀態通過增強激活或抑制基因來影響細胞命運。在這里,通過交叉檢查scRNA-seq和scATAC-seq數據,我們旨在確定這些引物可接近的染色質,這可能是對缺氧治療的不同反應的基礎。為此,我們比較了常氧條件下的scATAC-seq數據和缺氧條件下的scRNA-seq數據,并鑒定出兩個數據集之間可以自由匹配的細胞亞簇(圖8a、c)。在DLD-1細胞中,亞簇0-1對缺氧敏感。scATAC-seq數據顯示,ETS (ELK4、FLI1)和E2F (E2F3、E2F6)家族在0-1亞簇細胞中被激活,這些細胞對缺氧敏感。這與先前的研究一致,表明ETS轉錄因子在缺氧誘導的基因表達中的作用(圖8b)。在SW620細胞中,除了缺氧相關基因外,亞簇0-1也出現了EMT相關基因的變化。基于scATAC-seq數據,我們發現HMG (TCF4、TCF3)家族成員是集群0-1中的差異TF(圖8d)。鑒于先前的研究表明HMG家族可以調節EMT,這意味著這些TF可能參與了缺氧誘導的EMT激活。這些結果表明,異質染色質可及性可能有助于表面上同質細胞群體的異質應激反應。
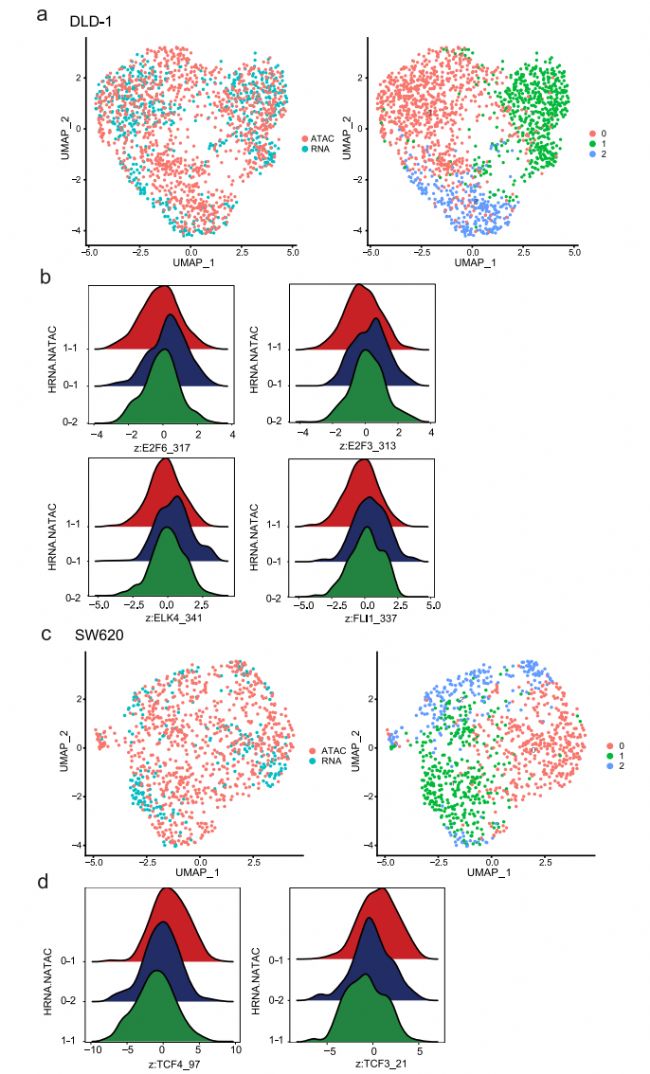
圖 8
結論
為了表征不同細胞系的轉錄組學和表觀遺傳異質性,我們對數十種人類細胞系進行了scRNA-seq和scATACseq,主要包括乳腺和結直腸細胞系。通過整合scRNA-seq和scATAC-seq數據,我們研究了驅動異質性的分子機制,并發現拷貝數變異CNV僅對觀察到的轉錄組異質性有部分貢獻。表觀遺傳多樣性和染色體外環狀DNA (ecDNA)分布對細胞系內異質性有重要影響。此外,通過譜系追蹤和缺氧處理,我們證明轉錄組異質性是可塑的,可以在環境脅迫下重塑。綜上所述,我們的研究對常用的人類癌細胞系進行了單細胞多組學研究,并提供了細胞系內異質性的機制見解。
參考文獻:
Zhu Q, Zhao X, Zhang Y, Li Y, Liu S, Han J, Sun Z, Wang C, Deng D, Wang S, Tang Y, Huang Y, Jiang S, Tian C, Chen X, Yuan Y, Li Z, Yang T, Lai T, Liu Y, Yang W, Zou X, Zhang M, Cui H, Liu C, Jin X, Hu Y, Chen A, Xu X, Li G, Hou Y, Liu L, Liu S, Fang L, Chen W, Wu L. Single cell multi-omics reveal intra-cell-line heterogeneity across human cancer cell lines. Nat Commun. 2023 Dec 9;14(1):8170. doi: 10.1038/s41467-023-43991-9. PMID: 38071219; PMCID: PMC10710513.





