在Opiti-Cell mini (3L)生物反應器中驗證MDCK無血清全懸浮培養工藝
引言
在細胞基質流感疫苗應用領域,MDCK細胞是最常用的哺乳動物細胞系之一[1]。由于貼壁細胞的培養工藝難以放大至商業化規模,并且使用載體會額外增加成本,因此對貼壁細胞進行懸浮馴化及懸浮后的工藝開發目前已經成為熱點[2]。本文主要通過迪必爾生物 Opti-Cell mini(3L)生物反應器建立MDCK細胞無血清全懸浮培養工藝,為流感疫苗的高效及低成本生產提供數據基礎。
研究路線
使用迪必爾生物 Opti-Cell mini(3L)生物反應器(圖1)進行MDCK細胞的培養。在初始1 L工作體積下,MDCK細胞接種密度為5.23×105 cells/mL,本次實驗工藝參數設置如表1所示。DO由氧氣的通氣速率級聯控制,空氣恒通0.008 vvm(8 mL/min)。當原體系的pH值自然降低到設定值時開啟pH自動控制,由二氧化碳的通氣速率和堿液(0.5M NaOH)的流加速率級聯控制。其中,進氣模式均為底部通氣。在整個培養周期中,各參數控制均可靠且穩定(圖2)。


 圖2 培養過程中溫度、DO、pH參數變化曲線
圖2 培養過程中溫度、DO、pH參數變化曲線
Day 0~Day 5細胞密度變化如圖3所示,最高活細胞密度(VCD)為4.86×106 cells/mL。葡萄糖和乳酸濃度變化如圖4所示,每24 h葡萄糖消耗量和乳酸積累量變化如圖5所示。隨著細胞的生長增殖,代謝產生大量乳酸,為維持pH值的恒定流加了大量堿液,導致體系滲透壓偏高,這也是后期細胞活率降低的原因之一。由于MDCK懸浮細胞株為貼壁細胞株經懸浮馴化而來,懸浮培養條件下仍會出現細胞黏附聚團現象。由每天取樣鏡檢圖像(圖6)可見,從Day 2開始出現明顯細胞結團現象,且后期細胞團塊直徑逐漸變大,這與細胞活率降低也有一定關系,提示需要加入抗結團劑保證單個細胞的均勻懸浮分散。本批次實驗主要目的為驗證3L反應器控制性能及穩定性,后期經工藝優化后細胞密度仍有提升空間。
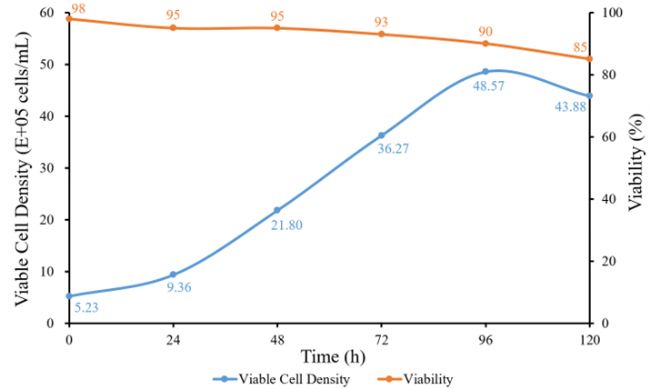 圖3 細胞密度變化曲線
圖3 細胞密度變化曲線
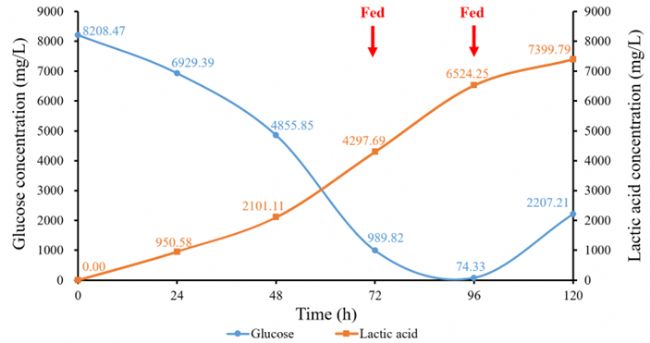 圖4 葡萄糖和乳酸濃度變化曲線
圖4 葡萄糖和乳酸濃度變化曲線
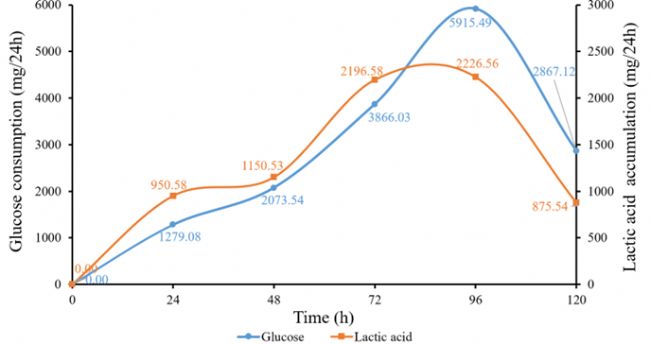 圖5 每24 h葡萄糖消耗量和乳酸積累量變化曲線
圖5 每24 h葡萄糖消耗量和乳酸積累量變化曲線
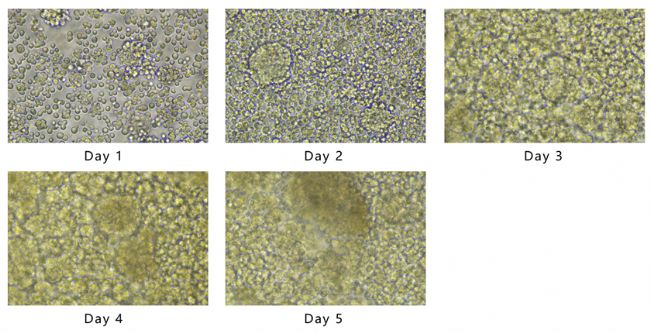 圖6 每24h取樣鏡檢圖
圖6 每24h取樣鏡檢圖
結論
針對細胞基質流感疫苗的研發與生產,無血清全懸浮培養工藝的開發已成為研究重點。迪必爾生物 Opti-Cell mini生物反應器(圖7)應用靈活,適用于各種貼壁及懸浮哺乳動物細胞培養工藝的開發與優化,支持批次、補料、灌流等多種培養工藝,搭載D²MS實現參數穩定控制及高擴展性應用,助力生物制品的工藝驗證與放大。
 圖7 迪必爾生物Opti-Cell mini生物反應器
圖7 迪必爾生物Opti-Cell mini生物反應器
參考文獻
[1] V. Lohr, Y. Genzel, I. Behrendt, K. Scharfenberg, U. Reichl, A new MDCK suspension line cultivated in a fully defined medium in stirred-tank and wave bioreactor. Vaccine. 2010, 28(38): 6256-6264.
[2] Wu, Y., Bissinger, T., Genzel, Y. et al. High cell density perfusion process for high yield of influenza A virus production using MDCK suspension cells. Applied Microbiology and Biotechnology. 2021, 105, 1421–1434.
應用技術與工程研究中心CARE 張君軒 供稿





