細胞銅死亡特性、分子機制的介紹及其與多種疾病相關性的研究進展
重金屬離子是人體必需的微量營養素,其不足和過量都可能引發細胞死亡,例如鐵和銅。關于細胞鐵死亡小陶之前已做了詳細解析(可見往期:基于十年研究,鐵死亡模全新模型橫空出世),今天咱們再來看看熱度逐漸攀升的細胞“銅死亡“~
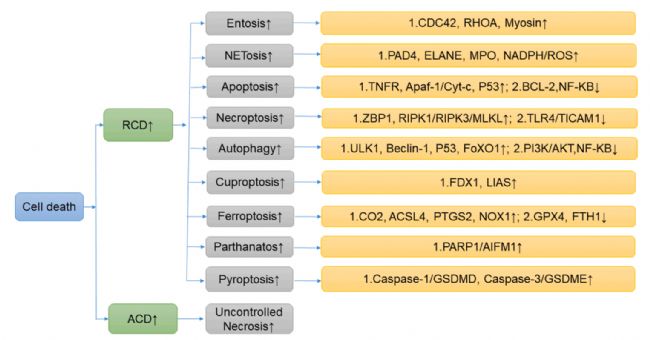
銅死亡(Cuproptosis)的概念最早由 Peter Tsvetkov 在 2022 年提出[1],它代表一種獨特的細胞死亡方式,與其他受控細胞死亡(RCDs)方式有所不同,其過程涉及 銅的依賴、脂酰化蛋白的積累以及 Fe-S 簇蛋白的減少。下面,讓我們一起深入了解一下銅死亡吧~
銅死亡有哪些特性?
生化特性
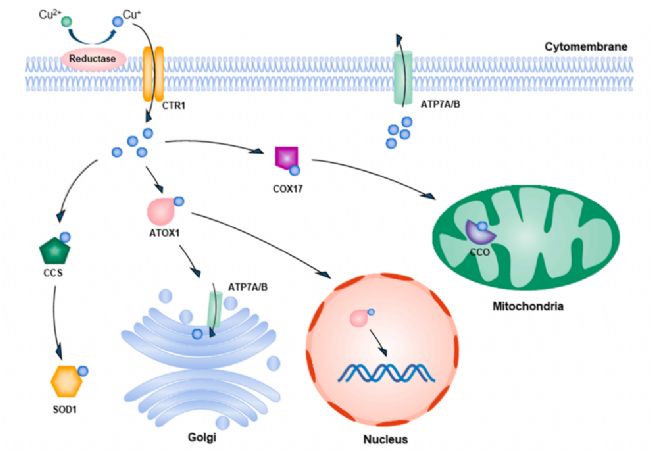
銅以兩種形式存在于體內,亞銅離子(Cu+)和銅離子(Cu2+),并參與多種生理反應。人們主要從食物中獲取銅,銅在食物中以 Cu2+ 形式存在,通過吸收和運輸進入肝細胞,并通過銅藍蛋白將銅輸送到身體各部位。
銅的穩態失衡會導致細胞內銅濃度升高,引發細胞損傷和銅死亡,其中 銅離子的作用 包括:
①銅離子通過芬頓反應產生大量活性氧(ROS),引發 DNA 損傷和脂質過氧化;
②銅離子通過抑制泛素-蛋白酶體系統來抑制細胞蛋白酶活性,并抑制細胞增殖;
③銅離子通過與脂酰化蛋白(丙酮酸、α-酮戊二酸、支鏈銅酸脫氫酶和甘氨酸裂解系統)結合,誘導脂酰化蛋白的聚集并抑制線粒體代謝功能,從而促進細胞發生銅死亡。
此外,銅積累與銅死亡密切相關,此過程受到 Ferredoxin1 (FDX1) 和 lipoic acid synthase (LIAS) 的調節。
形態表現
銅死亡會表現出一系列主要形態學特征,包括 線粒體的收縮、細胞膜的破裂、內質網的損傷 以及 染色質的破裂,這些特征與凋亡過程相似[3][4][5],但是其機制與已知的其他細胞死亡方式有所不同。
銅死亡的分子機制
氧化應激的激活
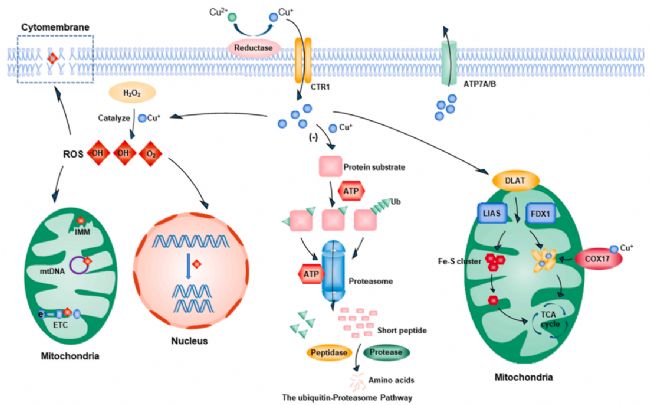
在正常的生理條件下,細胞維持著氧化與抗氧化防御之間的平衡,一旦這個平衡被破壞,氧化應激就會發生,導致細胞損傷并引發多種疾病。芬頓反應( Fenton reaction)是一種常見的金屬催化反應,能夠產生大量的活性氧物質(ROS)。銅離子在這一過程中起到關鍵作用,通過 催化 H2O2 產生大量 ROS,對細胞產生多方面的損害,包括 損傷 DNA、干擾線粒體功能、破壞細胞膜完整性等。
此外,一些研究發現,銅離子可以通過促進 ROS 產生并調控相關信號通路來誘導癌細胞死亡。例如,銅離子載體 NSC319726 可激活 Cu2+ 并促進 ROS 產生,導致脫氧核苷酸耗盡和 DNA 合成抑制,這使得細胞停留在 G1 期并誘導細胞死亡[6]。此外, Disulfiram 與 Cu2+ 結合會促進 ROS 產生,激活 P38 信號通路,并抑制 NF-kB 信號通路,從而誘導癌細胞死亡[7]。也就是說,銅離子可通過增加 ROS 產生和激活與氧化應激相關的信號通路來達到殺傷細胞的目的。
泛素-蛋白酶體系統的抑制
泛素-蛋白酶體系統(UPS)是一個關鍵的蛋白質降解通路,負責細胞中大約 80% 蛋白質的降解。在這個系統中,泛素分子被選擇性地連接到目標蛋白質上,標志其進行降解。泛素化過程在細胞凋亡、信號傳遞和損傷修復等多種細胞活動中發揮著重要作用。
研究表明,銅離子可以通過不同機制干擾泛素-蛋白酶體系統的正常功能。例如,Disulfiram-Cu2+ 復合物通過抑制蛋白酶體活性和增加泛素-蛋白相互作用來損傷癌細胞[8];Disulfiram-Cu2+ 復合物通過阻止蛋白酶體系統上游信號傳導和抑制依賴泛素化的 ATP 合酶(ATP synthase),抑制泛素蛋白質的降解[9]。
銅通過靶向脂酰化TCA循環蛋白誘導細胞死亡
銅死亡的關鍵特征之一是在線粒體呼吸鏈中三羧酸循環(TCA循環)的蛋白質硫辛酸酯化,這是一種重要的賴氨酸翻譯后修飾,它通過酰胺鍵將硫辛酸酯與蛋白質賴氨酸殘基連接起來,對調控 TCA 循環的關鍵酶非常重要。
銅離子通過與脂酰化組分結合,導致脂酰化蛋白和鐵硫簇蛋白的損失,誘導蛋白質毒性應激和細胞死亡。其中,FDX1 是銅死亡的上游調節因子,其敲除或與脂酰化相關的酶可以阻止銅死亡的發生。因此,這些生物標志物如 FDX1、LIPT1、LIAS、DLD和 DLAT 等在銅死亡的研究中具有重要作用,有望成為該細胞死亡過程的生物標志物。
銅死亡的誘導劑和抑制劑
銅死亡誘導劑是指能夠觸發細胞銅死亡過程的化合物,目前以銅離子載體為主。這些載體,如 elesclomol、NSC-319726 和 二硫化物,通過將銅離子引入細胞內并干擾鐵硫簇生物合成等途徑誘導銅死亡,具有潛在的癌細胞治療效果。與此相反,銅死亡抑制劑則是指能夠抑制細胞銅死亡的化合物或治療方法。這些抑制劑包括 銅螯合劑、氧化磷酸化抑制劑以及影響電子傳遞鏈和線粒體丙酮酸攝取的物質,它們可能通過不同機制緩解與銅死亡相關的各種疾病。
總結
銅死亡是一種新發現的細胞死亡方式,過量的銅通過促進依賴銅的脂酰化蛋白在三羧酸循環中異常寡聚化以及降低 Fe-S 簇蛋白水平來誘導銅死亡。在這個過程中,Ferredoxin1 (FDX1)是銅死亡的關鍵因素,通過將 Cu2+還原為 Cu+,促使脫氫脂酰轉乙酰酶(DLAT)脂酰化,并通過降低銅硫簇蛋白水平來引發細胞死亡。
銅死亡與多種疾病的發生和進展相關,包括乳腺癌、肺癌、神經退行性疾病、威爾遜氏病、肥胖等。最新研究還指出,銅死亡與多種心血管疾病的發生和進展有關。因此,深入探討銅死亡在不同疾病中的潛在作用及其相關機制,有助于尋找新的治療靶點并推動藥物研發。
當下,銅死亡相關研究如火如荼,陶術可提供 銅死亡化合物庫、 Disulfiram 、NSC-319726、 Elesclomol、Triplin、DL-Penicillamine 以及 Trientine-2HCl 等銅死亡相關抑制劑、螯合劑,助力您銅死亡相關的藥物研發和研究,歡迎私信咨詢~
參考資料:
[1] P. Tsvetkov, S. Coy, B. Petrova, M. Dreishpoon, A. Verma, M. Abdusamad, J. Rossen, L. Joesch-Cohen, R. Humeidi, R. Spangler, J. Eaton, E. Frenkel, M. Kocak, S. Corsello, S. Lutsenko, N. Kanarek, S. Santagata, T. Golub, Copper induces cell death by targeting lipoylated TCA cycle proteins, Science 375 (6586) (2022) 1254–1261.
[2] Di Wang, Zhenyu Tian, Peng Zhang, Lv Zhen, Qingju Meng, Benteng Sun, Xingli Xu, Tong Jia, Shengqiang Li,The molecular mechanisms of cuproptosis and its relevance to cardiovascular disease,Biomedicine & Pharmacotherapy,Volume 163,2023,114830,ISSN 0753-3322,https://doi.org/10.1016/j.biopha.2023.114830.
[3] G. Zhao, H. Sun, T. Zhang, J.X. Liu, Copper induce zebrafish retinal developmental defects via triggering stresses and apoptosis, Cell Commun. Signal. 18 (1) (2020) 45.
[4] Liao Jianzhao, Yang Fan, Tang Zhaoxin, Yu Wenlan, Han Qingyue, Inhibition of Caspase-1-dependent pyroptosis attenuates copper-induced apoptosis in chicken hepatocytes, Ecotoxicol. Environ. Saf. (2019).
[5] X. Tao, X. Wan, D. Wu, E. Song, Y. Song, A tandem activation of NLRP3 inflammasome induced by copper oxide nanoparticles and dissolved copper ion in J774A.1 macrophage, J. Hazard. Mater. 411 (2021), 125134.
[6] K. Shimada, E. Reznik, M.E. Stokes, L. Krishnamoorthy, P.H. Bos, Y. Song, C. E. Quartararo, N.C. Pagano, D.R. Carpizo, A.C. deCarvalho, D.C. Lo, B. R. Stockwell, Copper-binding small molecule induces oxidative stress and cellcycle arrest in glioblastomapatient-derived cells, Cell Chem. Biol. 25 (5) (2018) 585–594, e7.
[7] N.C. Yip, I.S. Fombon, P. Liu, S. Brown, V. Kannappan, A.L. Armesilla, B. Xu, J. Cassidy, J.L. Darling, W. Wang, Disulfiram modulated ROS-MAPK and NFκB pathways and targeted breast cancer cells with cancer stem cell-like properties, Br. J. Cancer 104 (10) (2011) 1564–1574.
[8] D. Chen, Q.C. Cui, H. Yang, Q.P. Dou, Disulfiram, a clinically used anti-alcoholism drug and copper-binding agent, induces apoptotic cell death in breast cancer cultures and xenografts via inhibition of the proteasome activity, Cancer Res. 66 (21) (2006) 10425–10433.
[9] Z. Skrott, M. Mistrik, K.K. Andersen, S. Friis, D. Majera, J. Gursky, T. Ozdian, J. Bartkova, Z. Turi, P. Moudry, M. Kraus, M. Michalova, J. Vaclavkova, P. Dzubak, I. Vrobel, P. Pouckova, J. Sedlacek, A. Miklovicova, A. Kutt, J. Li, J. Mattova, C. Driessen, Q.P. Dou, J. Olsen, M. Hajduch, B. Cvek, R.J. Deshaies, J. Bartek, Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4, Nature 552 (7684) (2017) 194–199.
銅死亡(Cuproptosis)的概念最早由 Peter Tsvetkov 在 2022 年提出[1],它代表一種獨特的細胞死亡方式,與其他受控細胞死亡(RCDs)方式有所不同,其過程涉及 銅的依賴、脂酰化蛋白的積累以及 Fe-S 簇蛋白的減少。下面,讓我們一起深入了解一下銅死亡吧~

▲細胞死亡的不同形式
銅死亡有哪些特性?
生化特性
銅以兩種形式存在于體內,亞銅離子(Cu+)和銅離子(Cu2+),并參與多種生理反應。人們主要從食物中獲取銅,銅在食物中以 Cu2+ 形式存在,通過吸收和運輸進入肝細胞,并通過銅藍蛋白將銅輸送到身體各部位。
銅的穩態失衡會導致細胞內銅濃度升高,引發細胞損傷和銅死亡,其中 銅離子的作用 包括:
①銅離子通過芬頓反應產生大量活性氧(ROS),引發 DNA 損傷和脂質過氧化;
②銅離子通過抑制泛素-蛋白酶體系統來抑制細胞蛋白酶活性,并抑制細胞增殖;
③銅離子通過與脂酰化蛋白(丙酮酸、α-酮戊二酸、支鏈銅酸脫氫酶和甘氨酸裂解系統)結合,誘導脂酰化蛋白的聚集并抑制線粒體代謝功能,從而促進細胞發生銅死亡。
此外,銅積累與銅死亡密切相關,此過程受到 Ferredoxin1 (FDX1) 和 lipoic acid synthase (LIAS) 的調節。
形態表現
銅死亡會表現出一系列主要形態學特征,包括 線粒體的收縮、細胞膜的破裂、內質網的損傷 以及 染色質的破裂,這些特征與凋亡過程相似[3][4][5],但是其機制與已知的其他細胞死亡方式有所不同。

▲細胞內銅代謝信號通路
銅死亡的分子機制
氧化應激的激活
在正常的生理條件下,細胞維持著氧化與抗氧化防御之間的平衡,一旦這個平衡被破壞,氧化應激就會發生,導致細胞損傷并引發多種疾病。芬頓反應( Fenton reaction)是一種常見的金屬催化反應,能夠產生大量的活性氧物質(ROS)。銅離子在這一過程中起到關鍵作用,通過 催化 H2O2 產生大量 ROS,對細胞產生多方面的損害,包括 損傷 DNA、干擾線粒體功能、破壞細胞膜完整性等。
此外,一些研究發現,銅離子可以通過促進 ROS 產生并調控相關信號通路來誘導癌細胞死亡。例如,銅離子載體 NSC319726 可激活 Cu2+ 并促進 ROS 產生,導致脫氧核苷酸耗盡和 DNA 合成抑制,這使得細胞停留在 G1 期并誘導細胞死亡[6]。此外, Disulfiram 與 Cu2+ 結合會促進 ROS 產生,激活 P38 信號通路,并抑制 NF-kB 信號通路,從而誘導癌細胞死亡[7]。也就是說,銅離子可通過增加 ROS 產生和激活與氧化應激相關的信號通路來達到殺傷細胞的目的。
泛素-蛋白酶體系統的抑制
泛素-蛋白酶體系統(UPS)是一個關鍵的蛋白質降解通路,負責細胞中大約 80% 蛋白質的降解。在這個系統中,泛素分子被選擇性地連接到目標蛋白質上,標志其進行降解。泛素化過程在細胞凋亡、信號傳遞和損傷修復等多種細胞活動中發揮著重要作用。
研究表明,銅離子可以通過不同機制干擾泛素-蛋白酶體系統的正常功能。例如,Disulfiram-Cu2+ 復合物通過抑制蛋白酶體活性和增加泛素-蛋白相互作用來損傷癌細胞[8];Disulfiram-Cu2+ 復合物通過阻止蛋白酶體系統上游信號傳導和抑制依賴泛素化的 ATP 合酶(ATP synthase),抑制泛素蛋白質的降解[9]。
銅通過靶向脂酰化TCA循環蛋白誘導細胞死亡
銅死亡的關鍵特征之一是在線粒體呼吸鏈中三羧酸循環(TCA循環)的蛋白質硫辛酸酯化,這是一種重要的賴氨酸翻譯后修飾,它通過酰胺鍵將硫辛酸酯與蛋白質賴氨酸殘基連接起來,對調控 TCA 循環的關鍵酶非常重要。
銅離子通過與脂酰化組分結合,導致脂酰化蛋白和鐵硫簇蛋白的損失,誘導蛋白質毒性應激和細胞死亡。其中,FDX1 是銅死亡的上游調節因子,其敲除或與脂酰化相關的酶可以阻止銅死亡的發生。因此,這些生物標志物如 FDX1、LIPT1、LIAS、DLD和 DLAT 等在銅死亡的研究中具有重要作用,有望成為該細胞死亡過程的生物標志物。

▲銅死亡的分子機制
銅死亡的誘導劑和抑制劑
銅死亡誘導劑是指能夠觸發細胞銅死亡過程的化合物,目前以銅離子載體為主。這些載體,如 elesclomol、NSC-319726 和 二硫化物,通過將銅離子引入細胞內并干擾鐵硫簇生物合成等途徑誘導銅死亡,具有潛在的癌細胞治療效果。與此相反,銅死亡抑制劑則是指能夠抑制細胞銅死亡的化合物或治療方法。這些抑制劑包括 銅螯合劑、氧化磷酸化抑制劑以及影響電子傳遞鏈和線粒體丙酮酸攝取的物質,它們可能通過不同機制緩解與銅死亡相關的各種疾病。
總結
銅死亡是一種新發現的細胞死亡方式,過量的銅通過促進依賴銅的脂酰化蛋白在三羧酸循環中異常寡聚化以及降低 Fe-S 簇蛋白水平來誘導銅死亡。在這個過程中,Ferredoxin1 (FDX1)是銅死亡的關鍵因素,通過將 Cu2+還原為 Cu+,促使脫氫脂酰轉乙酰酶(DLAT)脂酰化,并通過降低銅硫簇蛋白水平來引發細胞死亡。
銅死亡與多種疾病的發生和進展相關,包括乳腺癌、肺癌、神經退行性疾病、威爾遜氏病、肥胖等。最新研究還指出,銅死亡與多種心血管疾病的發生和進展有關。因此,深入探討銅死亡在不同疾病中的潛在作用及其相關機制,有助于尋找新的治療靶點并推動藥物研發。
當下,銅死亡相關研究如火如荼,陶術可提供 銅死亡化合物庫、 Disulfiram 、NSC-319726、 Elesclomol、Triplin、DL-Penicillamine 以及 Trientine-2HCl 等銅死亡相關抑制劑、螯合劑,助力您銅死亡相關的藥物研發和研究,歡迎私信咨詢~
參考資料:
[1] P. Tsvetkov, S. Coy, B. Petrova, M. Dreishpoon, A. Verma, M. Abdusamad, J. Rossen, L. Joesch-Cohen, R. Humeidi, R. Spangler, J. Eaton, E. Frenkel, M. Kocak, S. Corsello, S. Lutsenko, N. Kanarek, S. Santagata, T. Golub, Copper induces cell death by targeting lipoylated TCA cycle proteins, Science 375 (6586) (2022) 1254–1261.
[2] Di Wang, Zhenyu Tian, Peng Zhang, Lv Zhen, Qingju Meng, Benteng Sun, Xingli Xu, Tong Jia, Shengqiang Li,The molecular mechanisms of cuproptosis and its relevance to cardiovascular disease,Biomedicine & Pharmacotherapy,Volume 163,2023,114830,ISSN 0753-3322,https://doi.org/10.1016/j.biopha.2023.114830.
[3] G. Zhao, H. Sun, T. Zhang, J.X. Liu, Copper induce zebrafish retinal developmental defects via triggering stresses and apoptosis, Cell Commun. Signal. 18 (1) (2020) 45.
[4] Liao Jianzhao, Yang Fan, Tang Zhaoxin, Yu Wenlan, Han Qingyue, Inhibition of Caspase-1-dependent pyroptosis attenuates copper-induced apoptosis in chicken hepatocytes, Ecotoxicol. Environ. Saf. (2019).
[5] X. Tao, X. Wan, D. Wu, E. Song, Y. Song, A tandem activation of NLRP3 inflammasome induced by copper oxide nanoparticles and dissolved copper ion in J774A.1 macrophage, J. Hazard. Mater. 411 (2021), 125134.
[6] K. Shimada, E. Reznik, M.E. Stokes, L. Krishnamoorthy, P.H. Bos, Y. Song, C. E. Quartararo, N.C. Pagano, D.R. Carpizo, A.C. deCarvalho, D.C. Lo, B. R. Stockwell, Copper-binding small molecule induces oxidative stress and cellcycle arrest in glioblastomapatient-derived cells, Cell Chem. Biol. 25 (5) (2018) 585–594, e7.
[7] N.C. Yip, I.S. Fombon, P. Liu, S. Brown, V. Kannappan, A.L. Armesilla, B. Xu, J. Cassidy, J.L. Darling, W. Wang, Disulfiram modulated ROS-MAPK and NFκB pathways and targeted breast cancer cells with cancer stem cell-like properties, Br. J. Cancer 104 (10) (2011) 1564–1574.
[8] D. Chen, Q.C. Cui, H. Yang, Q.P. Dou, Disulfiram, a clinically used anti-alcoholism drug and copper-binding agent, induces apoptotic cell death in breast cancer cultures and xenografts via inhibition of the proteasome activity, Cancer Res. 66 (21) (2006) 10425–10433.
[9] Z. Skrott, M. Mistrik, K.K. Andersen, S. Friis, D. Majera, J. Gursky, T. Ozdian, J. Bartkova, Z. Turi, P. Moudry, M. Kraus, M. Michalova, J. Vaclavkova, P. Dzubak, I. Vrobel, P. Pouckova, J. Sedlacek, A. Miklovicova, A. Kutt, J. Li, J. Mattova, C. Driessen, Q.P. Dou, J. Olsen, M. Hajduch, B. Cvek, R.J. Deshaies, J. Bartek, Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4, Nature 552 (7684) (2017) 194–199.
標簽:
細胞銅死亡
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





