耐高鹽全能核酸酶在去除核酸污染上的優勢及應用案例
一,宿主DNA殘留控制的法規要求
隨著生物醫藥行業的快速發展,越來越多的生物制品開始服務于人類健康,治療性抗體藥物、細胞治療、病毒載體疫苗等需求日益龐大。不同于傳統口服類藥物,大量生物制品通過注射等給藥方式直接進入體內,因此更需要嚴格的質量監管來保證生物制品的安全性和有效性。宿主核酸的殘留因其可能帶來的傳染性或者致瘤的風,險而被作為生物制品安全監管中的重要一項。WHO及世界各國對宿主核酸的殘留都有嚴格的規定如疫苗及治療類生物制品的DNA殘留量通常控制在100pg/劑量以下,部分產品甚至要求DNA殘留量不高于10pg/劑量。因此,解決宿主核酸的殘留是生物制品生產過程中必須面對的問題。全能核酸酶是一種來源于SerratiaMarcescen的基因工程酶,它可以降解所有形式的DNA和RNA,包括單鏈、雙鏈、線狀、環狀、天然以及變性的核酸,將它們消化成3-5個堿基長度的5'-單磷酸寡核苷酸,且不具有堿基識別特異性。因此,在一些藥物的生產工藝中常使用全能核酸酶去除殘留核酸,如能有效去除疫苗樣品、細胞和基因治療病毒樣品及重組蛋白藥物中的核酸污染,降低核酸殘留毒性風險,提高產品安全性;另外,在蛋白分析樣品制備、改善重組蛋白純化工藝、提高蛋白產量、細胞凍存等方面也可通過使用全能核酸酶處理核酸來達到理想實驗效果。
二,常規全能核酸酶在工業生產中的限制
基于此,常使用全能核酸酶應用于藥物開發生產工藝流程中來去除核酸污染。如在AAV病毒生產中,經宿主細胞大量擴增,在細胞裂解后,往往需要加入全能核酸酶來去除核酸污染,同時可以降低粘樣品粘稠度,便干后續上柱純化,但在此過程中,鹽是各種純化方案的重要組成部分,鹽濃度的提高可有效地減少AAV病毒顆粒的聚集,提高AAV病毒顆粒產率。因此常使用含有較高鹽濃度的buffer(400-500mM)來提高病毒收率,而常規版本全能核酸酶的酶活會隨著鹽濃度升高而急劇下降,實際使用中,常需要通過增加酶的用量或延長孵育時間來提高純化效果,但這無疑增加了成本和工藝復雜度。
為更好滿足高鹽環境對全能核酸酶的活性要求,逐典生物依托酶改造技術平臺,通過A1設計極大拓寬全能核酸酶產品的最適催化鹽濃度范圍,終產品在150-900 mM鹽濃度范圍內有效,超出客戶預期,是生物藥工藝流程中去除核酸污染的理想選擇!
1.更高鹽耐受度
當鹽離子濃度在600~700mM時,初代全能核酸酶幾近失活,而SAN仍能保持較高活性。
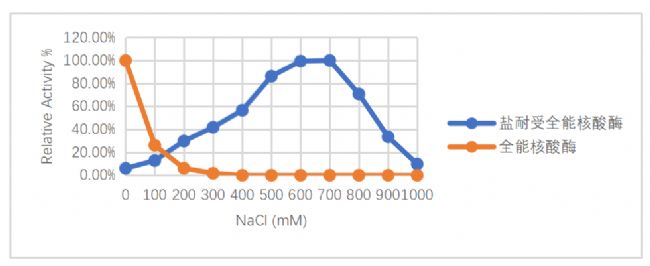
圖1.不同鹽濃度下耐高鹽全能核酸酶(SAN)與初代全能核酸酶活性對比
2. 高效核酸降解力
同對照組相比,添加SAN后能夠有效去除核酸殘留。
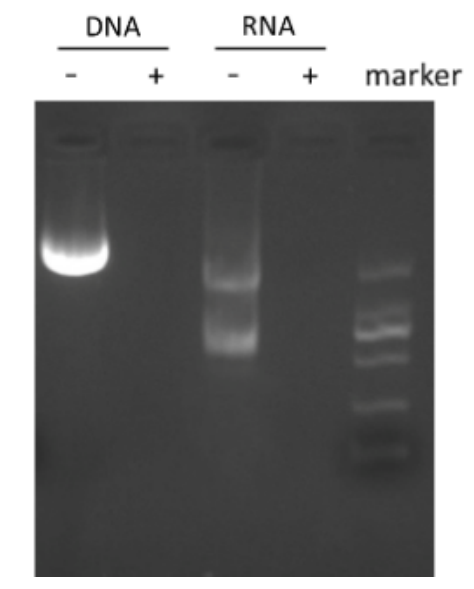
圖2 加入SAN 前后的消化效果圖
四,逐典耐高鹽全能核酸酶用途
1.疫苗和病毒樣品制備中高鹽環境下DNA污染的去除
2.與細胞或細菌裂解液配合使用,去除粗提物中的核酸,降低溶液粘性,提高蛋白質產量。
3.減少存放的外周血單細胞(PBMC)的結塊現象
4.降解核酸,利于不可溶性蛋白復性前高質量包涵體制備。
5.有效去除帶負電荷的核酸對雙向SDS-PAGE蛋白樣品的影響,改善蛋白質分離效果,增強2-DE分辨率
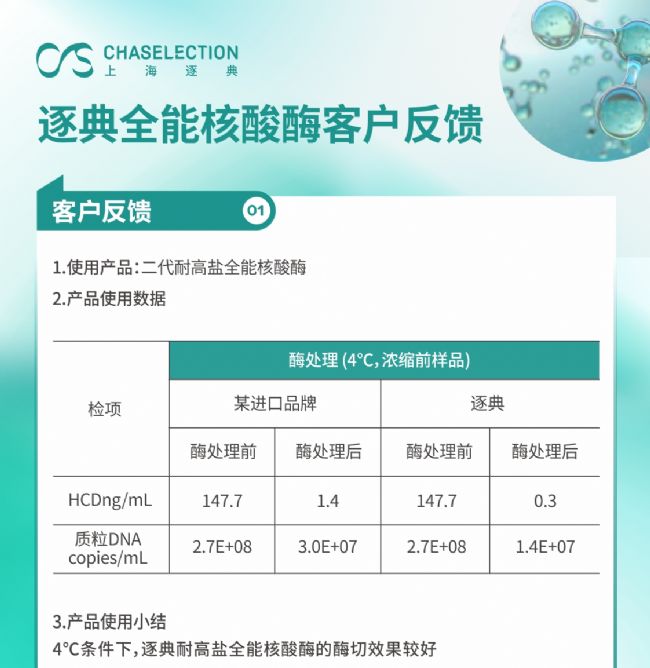
五,客戶應用案例