免疫細胞培養通關技巧之質量優化:支原體和內毒素的檢測
免疫細胞培養的六個基本流程:樣本制備、細胞分選、分型鑒定、擴增&培養、質量優化、后續研究。今天我們繼續一起學習質量優化的相關知識。
質量優化(Quality Optimization):針對一些不良因素,如樣本制備成單細胞懸液時產生的細胞團塊、碎片等;細胞擴增培養時支原體和內毒素的影響,并積極采取對應的措施。
1.單細胞懸液質量優化:這部分的內容大家可以參考《單細胞懸液制備方法及質量優化方案 》進行學習。
2.細胞培養質量優化:在細胞培養過程,我們需要不定期進行支原體和內毒素的檢測,如果不慎“中招”,可以做到及時止損。
支原體 (Mycoplasma) 是介于細菌和病毒之間,沒有細胞壁的原核細胞型微生物。
(1)形態特征
支原體的體積很小,0.1-0.3 μm,光學顯微鏡無法觀測,也無法通過0.22μm的過濾器過濾,并且傳統的抗生素對支原體一般沒有效果。支原體可寄生/共生/獨立存活于培養基中,98%吸附于細胞膜或者細胞間隙。
(2)污染源
①支原體陽性細胞的交叉污染,并且由于支原體可垂直傳染,一旦細胞發生污染,下一代細胞同樣也會存在支原體的污染;
②實驗操作人員的口腔、唾液等等,實驗人員的操作習慣,如交叉使用培養液、防護不到位也會成為支原體的污染來源;
③培養條件如操作環境、培養用的儀器耗材清潔或滅菌不到位也都會增加支原體污染的風險。
(3)對細胞研究的影響
①抑制細胞生長、代謝,引起死亡:一般情況下輕度的支原體污染對于細胞的生長沒有明顯的影響,但是由于消耗培養液中的營養,所以細胞的生長會變慢,支原體也可能通過感染細胞并利用其生物合成機制,抑制關鍵代謝途徑,最終導致細胞生長受阻和死亡[1];
②染色體畸變,破壞核酸合成,DNA片段化:支原體可能通過與細胞核酸相互作用,引發染色體結構的變異,影響DNA合成和維持染色體完整性,如支原體感染可以模擬shRNA介導的p53敲除,允許Ras轉化,從而使p53的功能失活[2];
③改變細胞膜抗原性:支原體影響參與炎癥和細胞轉化的細胞途徑,如支原體的蛋白質與TLR相互作用或進入細胞,從而改變負責炎癥和DNA修復的幾種途徑[3];
④改變轉染效率:支原體可能通過影響細胞內的基因轉運和表達機制,減緩或干擾DNA的轉染效率[4];
⑤對細胞凋亡誘導劑敏感性增加:支原體可以通過某些蛋白,調節細胞凋亡途徑中的關鍵分子,增加細胞對凋亡誘導劑的敏感性,如NAE和支原體酶MGA-0676的相互作用,誘導的DF-1細胞凋亡[5]。
(4)支原體的預防:
支原體的污染防治也是很重要的,比如:日常1-2周進行支原體的檢測,對于新到的細胞株、凍存保種前、重要實驗開始前都應當進行支原體的檢測。10個預防支原體的tips大家可以保存學習噢(圖1)。

圖1 預防支原體污染的10個技巧
(5)支原體的檢測方法:支原體的檢測方法也非常多,小優也給大家整理了每種方法的原理、優缺點(表2)。
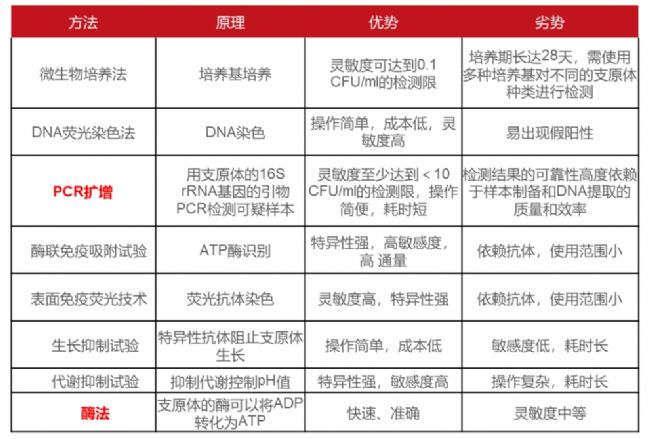
表2 支原體檢測方法的比較
(6)支原體的去除:目前最有效的支原體的清除方法是使用支原體清除劑,其他的方法比如清洗純化法(利用離心力、細胞、微生物質量和懸液的浮力差達到清除支原體的目的)或者使用支原體特異血清也可以嘗試。
內毒素(endotoxin)是革蘭氏陰性細菌細胞壁中的一種成分,其化學本質是一種脂多糖(LPS),其單位為Eu/mg或Eu/U。一個EU相當于約0.1至0.2 ng內毒素/mL溶液。內毒素只有當細菌死亡溶解或用人工方法破壞后才釋放出來。
(1)特征:
內毒素非常耐熱,只有在160℃,加熱2-4h,或者用強堿/強酸/強氧化劑加熱煮沸30min才能破壞其生物活性。
(2)污染源:
①配制各種試劑、緩沖液的水
②各種培養基、血清和添加劑中“混入”
③塑料器具、玻璃器具等表面
(3)對細胞的影響:
①細胞功能改變:內毒素可以刺激一些細胞分泌炎癥因子,導致局部炎癥反應,如低至 0.5 ng/mL 的內毒素處理6h就可以增加馬腹膜巨噬細胞中IL-6的分泌[6];
②導致細胞亞健康: 內毒素會加速細胞衰老、凋亡,甚至死亡;
③活化細胞:在單核細胞存在的條件下,100 ng/mL內毒素可以刺激人類T細胞的增殖及其淋巴因子的產生[7];
④降低真核細胞系的轉染效率:已純化質粒 DNA 中的內毒素可降低所有細胞系的轉染效率和活力,內毒素含量(> 10 EU/μg)會對標準細胞系中的轉染、蛋白質表達和活力產生負面影響[8]。
(4)內毒素的預防:
①選擇高質量/低內毒素的培養基、血清和試劑耗材,在免疫細胞的培養過程中,可以選擇免疫細胞專用的無血清培養基,如果選擇經典的培養體系,要選擇低內毒素的血清和基礎培養基;同時,免疫細胞培養的過程中添加的生長因子等也要選擇高質量低內毒素的;
②重復使用的實驗耗材可高溫高壓處理:250℃,30分鐘,或者180℃,3小時;
③細胞培養的水質也至關重要,賽多利斯的mini純水儀可以滿足實驗室每日15ml純水/超純水的用量,關愛每一個細胞寶寶;
④另外可以對培養過程中自行配置的一些緩沖液進行過濾除菌,這樣可以在加入到細胞之前消除潛在的內毒素。
(5)內毒素的檢測:
小優也給大家整理了內毒素每種檢測方法的原理、優缺點(表6)。常用的方法是鱟試劑法和重組 C因子法,由于鱟作為國家二級保護動物,目前不能再進行大規模使用。所以我們推薦大家使用重組 C因子(rFC) 法來檢測內毒素。
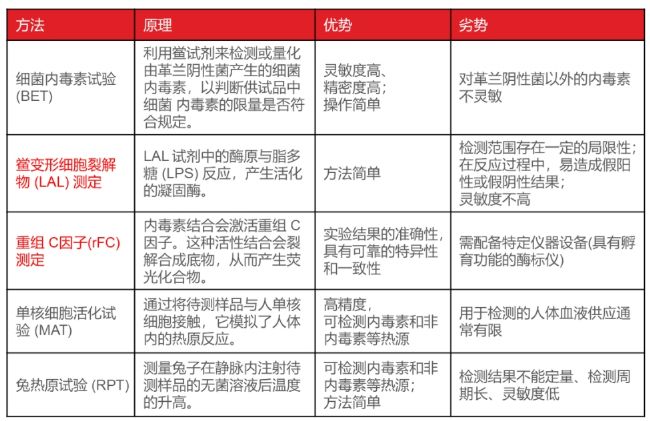
表6 內毒素的檢測方法
(6)內毒素的清除:
細胞培養中的內毒素暫時沒有方法可以有效去除,所以小優建議大家做好預防,畢竟防大于治!
參考文獻:
1.Netto, Cristiane et al. [publication of the Brazilian Society for Microbiology] vol. 45,4 1513-9. 4 Mar. 2015
2.Logunov, D Y et al Oncogene vol. 27,33 (2008): 4521-31.
3.Benedetti, Francesca et al. “Mycoplasmas-Host Interaction: Mechanisms of Inflammation and Association with Cellular Transformation.” Microorganisms vol. 8,9 1351. 4 Sep. 2020
4.Yin, Zi-Fei et al. “Mycoplasma contamination-mediated attenuation of plasmid DNA transfection efficiency is augmented via L-arginine deprivation in HEK-293 cells.” Journal of Zhejiang University. Science. B vol. 20,12 (2019): 1021-1026
5.Li, Peng et al. “Mechanism of Apoptosis Induction by Mycoplasmal Nuclease MGA-0676 in Chicken Embryo Fibroblasts.” Frontiers in cellular and infection microbiology vol. 8 105. 4 Apr. 2018
6.Morris,D.D., Crowe, N., Moore, J.N.and Moldawer, L.L. Endotoxin-Induced Production ofInterleukin 6 by Equine Peritoneal Macrophages In Vitro. Am. J. Vet. Res.53:1298-1301 (1992
7.Mattern, T.,Thanhauser, A., Reiling, N.,Toellner, K., Duchrow, M., Kusumoto, S.,Rietschel,E.T., Ernst, M., Brade, H.,Flad, H.D. and Ulmer, A.J. Endotoxin and Lipid A StimulateProliferation of Human T Cells In the Presence of Autologous Monocytes. J.Immunol. 153:2996-3004(1994)
8.Butash, KA et al.(2000) Reexamination of the Effect of Endotoxin on Cell Proliferation and Transfection Efficiency.Biotechniques 29(3): 610-614, 616, 618-619





