激光散斑血流成像系統(tǒng)在揭示神經(jīng)元和腦血管的直接對話機制中的應用

血液供應為大腦中的神經(jīng)計算提供能量,計算活動的波動會在數(shù)秒內(nèi)引起局部腦血流(cerebral blood flow, CBF) 的相應變化,這一現(xiàn)象稱為神經(jīng)血管耦合(Neurovascular coupling, NVC)。NVC功能受損,可導致腦微循環(huán)缺血缺氧,影響局部神經(jīng)信號傳導,引起并加重腦小血管疾病,甚至造成認知功能障礙、癡呆等。
有130年歷史的代謝假說解釋了NVC,但這一假說越來越有爭議,最近發(fā)現(xiàn)細胞類型特異性和神經(jīng)遞質(zhì)介導的機制是調(diào)節(jié)CBF的主要機制。然而,這種神經(jīng)信使傳遞特異性的分子和細胞機制在很大程度上仍然未知,活躍的神經(jīng)信息如何傳遞到腦內(nèi)的目標微動脈仍不清楚。
2024年1月2日,西湖大學賈潔敏團隊在Nature Neuroscience期刊上發(fā)表題為Synaptic-like transmission between neural axons and arteriolar smooth muscle cells drives cerebral neurovascular coupling的研究論文,該研究證實單個谷氨酸能神經(jīng)元軸突通過神經(jīng)-小動脈平滑肌細胞(arteriolar smooth muscle cells, aSMCs)連接之間的突觸樣傳遞來擴張其支配的小動脈。這一發(fā)現(xiàn)揭示了神經(jīng)元與腦血管直接對話的一座“新橋梁”,也為理解腦血流的快速和精準調(diào)控提供了一個全新的認知。

結(jié)果表明,星形膠質(zhì)細胞終足對穿支動脈的包裹率并不是100%,反而存在“漏洞”。血管周圍神經(jīng)元軸突的子突觸前會穿過這些漏洞,插入aSMCs外圍的基底膜,與aSMCs形成“類突觸”(neural–arteriolar smooth muscle cell junctions, NsMJs)。這一結(jié)構(gòu)為神經(jīng)元與血管之間的對話提供了一座前所未見的“新橋梁”。
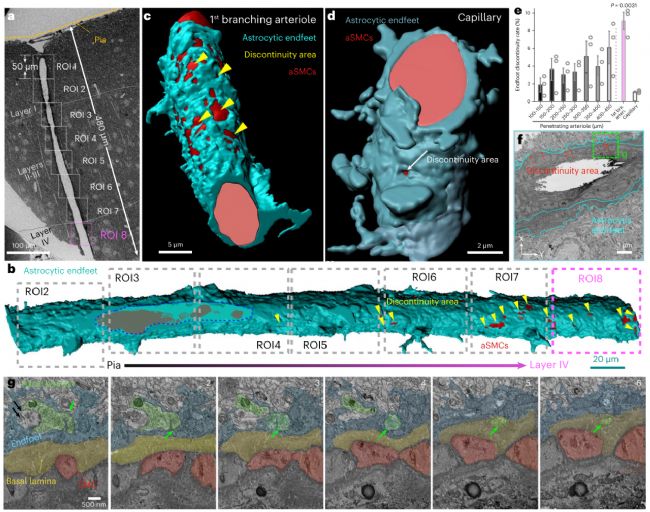
圖1. 軸突穿過星形膠質(zhì)細胞終足的漏洞與aSMCs接觸
為了證實NsMJs是否真正承擔了信息傳遞功能,研究團隊首先檢測了aSMCs是否具有接收神經(jīng)遞質(zhì)信號的接收器。結(jié)果顯示,腦內(nèi)aSMCs能表達多種神經(jīng)遞質(zhì)受體,其中就包括通透鈣離子的谷氨酸神經(jīng)遞質(zhì)的受體NMDAR。隨后作者通過激活NsMJs的突觸前膜來確認神經(jīng)元分泌的神經(jīng)遞質(zhì)是否可以與aSMCs上的神經(jīng)遞質(zhì)受體結(jié)合,從而調(diào)節(jié)血管的舒張或者收縮。研究團隊開創(chuàng)了顱內(nèi)單根軸突和樹突光遺傳學激活技術(shù),并且同時跟蹤靶向動脈的直徑變化。特異性激活類突觸前的單個谷氨酸能神經(jīng)元軸突,可以誘發(fā)動脈血管舒張,直徑增大近15%。進一步,通過經(jīng)典胡須刺激實驗,研究團隊觀察到破壞Glu-NsMJ的信息傳遞能夠顯著抑制NVC(研究人員使用了瑞沃德生產(chǎn)的激光散斑血流成像系統(tǒng))。這些結(jié)果證明NsMJs可調(diào)節(jié)大腦血管收縮舒張。
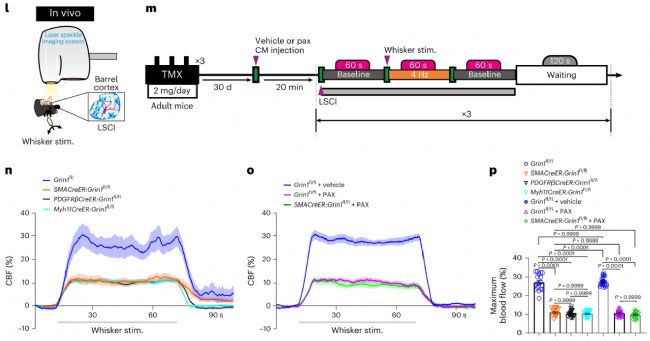
圖2. 破壞Glu-NsMJ的信息傳遞能顯著抑制NVC
(作者用到了瑞沃德激光散斑血流成像系統(tǒng)來監(jiān)測血流變化)
上述結(jié)果證實了神經(jīng)元直接調(diào)節(jié)大腦血流的全新路徑,那么這一路徑在腦血管性疾病中是如何發(fā)揮調(diào)節(jié)作用的呢?研究團隊基于小鼠大腦中動脈閉塞(middle cerebral arterial occlusion, MCAO)模型做了進一步的探討。在MCAO造模后的急性缺血期,在高濃度谷氨酸刺激下,aSMCs會大量去極化,導致血管急性收縮,造成二次缺血;而通過特異性敲除aSMCs上NMDAR受體的GluN1亞基,可以緩解動脈毒性以及后續(xù)的腦萎縮程度,增強小鼠的運動功能恢復并降低死亡率。
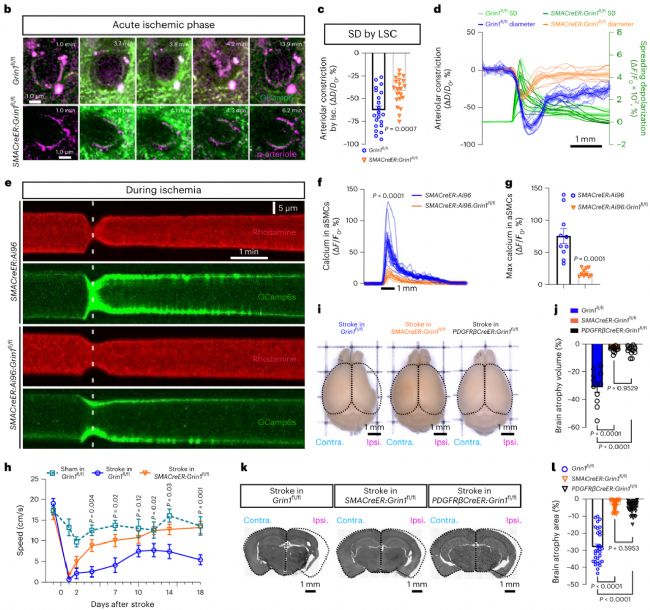
圖3. 敲除aSMCs GluN1可促進缺血性腦卒中后功能恢復
綜上,該研究證實了大腦中神經(jīng)元與腦血管之間存在一種“類突觸(NsMJs)”結(jié)構(gòu),該結(jié)構(gòu)能夠在生理和病理條件下調(diào)節(jié)大腦血管的舒張和收縮,為神經(jīng)元和腦血管的直接對話架起了一座“新橋梁”。這些發(fā)現(xiàn)為深入理解大腦的血供機制提供了新的視角,并為腦卒中的治療提供了新的思路。
研究方法亮點
這項工作揭示了神經(jīng)元調(diào)控大腦血流新路徑。研究用到了動物手術(shù)造模、大體積三維掃描電鏡、光電聯(lián)合,鈣成像、電生理記錄、雙光子光遺傳學、動物微循環(huán)血流成像分析、免疫組化以及動物行為學等實驗技術(shù)。
瑞沃德深耕生命科學研究領(lǐng)域21年,一直致力于為客戶提供可信賴的解決方案和服務。在該研究中,研究人員使用了瑞沃德生產(chǎn)的激光散斑血流成像系統(tǒng),為實驗的順利開展提供了支持。此外,瑞沃德還可提供該研究所涉及的動物手術(shù)造模、鈣成像、電生理記錄、免疫組化以及動物行為學等實驗技術(shù)的完整解決方案。
截止目前,瑞沃德產(chǎn)品及服務覆蓋海內(nèi)外 100 多個國家和地區(qū),客戶涵蓋全球2300+醫(yī)院,1000+科研院所,6000+高等院校,已助力全球科研人員發(fā)表SCI文章14500+,獲得行業(yè)廣泛認可。
文章原文鏈接:
https://doi.org/10.1038/s41593-023-01515-0






