電壓門控鈉通道NaV1.6與阿爾茨海默病神經元過度激活之間的關聯研究
文獻速遞:NaV1.6通道或成為阿爾茨海默病治療新靶點
關于阿爾茨海默病(AD)的眾多研究主要集中在淀粉樣蛋白β(Aβ)及其累積的問題上,關于Aβ與離子通道之間相互作用的研究是相對較少的。在《科學報告》(Scientific Reports)上公布的一項有趣的研究,揭示了一種特定類型的電壓門控鈉通道(NaV)與阿爾茨海默病神經元過度激活之間存在的密切關聯。此項研究不僅讓人們對 NaV 通道的作用有了新的認識,同時也為潛在的治療干預措施開辟了一條大有可為的途徑,從而有助于對抗阿爾茨海默病(AD)的初期階段。
Aβ與NaV1.6之間有怎樣的聯系?
在尋找答案的過程中,研究團隊將他們的研究焦點轉移到了電壓門控鈉通道上。這些通道與海馬神經元在阿爾茨海默病(AD)中的過度活躍以及癲癇發作頻率的上升有著密切的關聯。研究團隊采用了暴露于淀粉樣蛋白-β1-42(Aβ1-42)寡聚體(AD的標志)的原始海馬神經元,踏上了揭示神經元過度激活之謎的研究之旅。研究團隊采用了兩種獨特的體外實驗模型來模擬淀粉樣病理:一種是通過合成Aβ1-42寡聚體對小鼠海馬神經元原代培養物進行了24小時的處理,而另一種則是Tg2576小鼠海馬神經元原代培養物。這種原代培養物能夠內源性地產生Aβ1-42肽,并隨著時間的推移在培養物中不斷累積。他們還采用了鈉通道阻斷劑檸檬酸河豚毒素(TTX)(#T-550)來中斷來自內源性NaV電流。
在將海馬神經元暴露于Aβ1-42之后,用抗NaV1.6(SCN8A)抗體(#ASC-009)進行了Western印跡實驗。實驗結果表明,這些Aβ1-42寡聚體在24小時后開始積累,并有選擇性地增加了NaV1.6通道的表達和活性(參見圖1)。研究團隊還用了抗SCN1A(NaV1.1)抗體(#ASC-001)和抗SCA2A(NaV1.2)抗體(#ASC-002)來研究這些蛋白質在Aβ1-42作用下的表達情況。他們觀察到,NaV1.6的選擇性上調在膜的去極化和尖峰頻率的上升中扮演了關鍵角色,而這種尖峰頻率的上升正是導致神經元死亡的主要原因。
為了驗證他們的研究成果,研究團隊選擇了Tg2576小鼠胚胎作為研究阿爾茨海默病的小鼠模型。研究人員觀察到,從這些小鼠體內提取的海馬神經元表現出NaV1.6通道的選擇性上調,但對NaV1.1和NaV1.2通道并無明顯影響,與此同時,尖峰頻率、膜去極化和電流密度也呈現上升趨勢。
這些研究成果為Aβ1-42寡聚體與NaV1.6通道之間建立了關鍵的聯系,鞏固了該通道在海馬神經元過度激活時的功能。
當暴露于Aβ1-42時,原代培養海馬神經元中NaV1.6蛋白的活性和表達水平會選擇性上調
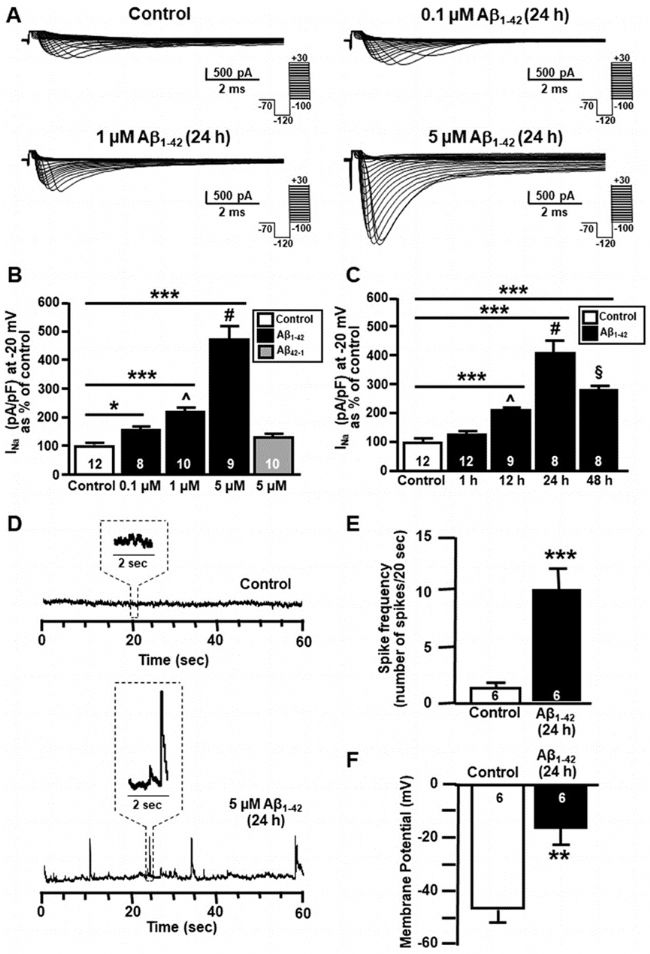
圖1.10-12DIV時Aβ1-42的暴露對原代海馬神經元中的Na+電流的影響。(A)在對照條件下,以及在0.1μM、1μM和5μM Aβ1-42暴露24小時之后,記錄原發性海馬神經元Na+電流的代表性軌跡。(B)在對照條件下,以及在0.1μM、1μM、5μM Aβ1-42和5μM Aβ42-1的作用24小時之后,原發性海馬神經元在-20 mV下記錄的Na+電流密度的歸一化。條形圖上標注了每種實驗條件下使用的細胞數,數值表示為 3 次獨立實驗的平均百分比 ± SEM。相較于對照組,*p<0.05;相較于對照組,***p<0.001;相較于0.1μM,^p<0.05;相較于0.1和1μM,#p<0.001。(C) 在對照條件下以及 5 μM Aβ1-42 作用 1 小時、12 小時、24 小時和 48 小時后,原發性海馬神經元記錄的 -20 mV 下 Na+ 電流密度的歸一化。條形圖上標注了每種實驗條件下使用的細胞數量,數值以 3 次獨立實驗的平均值 ± SEM 的百分比表示。與對照組相比,***p < 0.001;與 1 小時相比,^p < 0.001;與 1 小時和 12 小時相比,#p < 0.001;與 24 小時相比,§p < 0.001。 (D) 原發性海馬神經元在對照組條件下和 5 μM Aβ1-42(24 小時)后以無間隙模式記錄的代表性電流描記圖。(E) 在原代海馬神經元中,對照條件下和 5 μM Aβ1-42(24 小時)后 Aβ1-42 對尖峰頻率影響的定量分析。條形圖上標注了每種實驗條件下使用的細胞數,數值以 3 次獨立實驗的平均百分比 ± SEM 表示。與對照組相比,***P < 0.001。(F) 原代海馬神經元在對照條件下和 5 μM Aβ1-42 (24 小時)后 Aβ1-42 對膜電位影響的定量分析。條形圖上標注了每種實驗條件下使用的細胞數,數值以 3 次獨立實驗的平均百分比 ± SEM 表示。與對照組相比,***P < 0.001。摘自 Ciccone, R. et al. Sci Rep9, 13592 (2019)。
NaV1.6 的表達與沉默
鑒于Aβ1-42與NaV1.6之間的關聯已經被揭示,研究團隊對其作用機制進行了深入演技,并研究了NaV1.6在Aβ1-42誘導的神經元興奮性中所起的作用。為了實現這一目標,他們采用了NaV1.6 siRNA和茴香霉素進行處理,試圖逆轉電生理學上的變化。
這兩種技術都顯著地減少了Tg2576小鼠海馬區域的Na+電流,有效地抑制了電生理學的變動(如尖峰頻率和膜去極化的增加),甚至降低了自發動作電位的振幅和頻率。
為了深入了解小鼠模型中的表達情況,研究團隊采用了抗NaV1.6通道(#ASC-009)和抗微管相關蛋白(MAP2)來對組織神經元進行雙重標記。在此,他們觀察到,與WT神經元(圖2A a-c)相比,NaV1.6在WT海馬神經元的神經髓質和體節部分呈點狀染色(圖2A),而在Tg2576海馬神經元(圖2A d-f)部分則呈明顯的髓周染色特征。他們還觀察到,茴香霉素成功地逆轉了Tg2576海馬神經元中NaV1.6免疫活性的上升(參見圖2A g-i)。
這些結果證實NaV1.6通道在Aβ1-42-觸發的神經元過度激活過程中具有特定的作用。
茴香霉素處理可降低Tg2576海馬神經元中NaV1.6免疫反應的增長
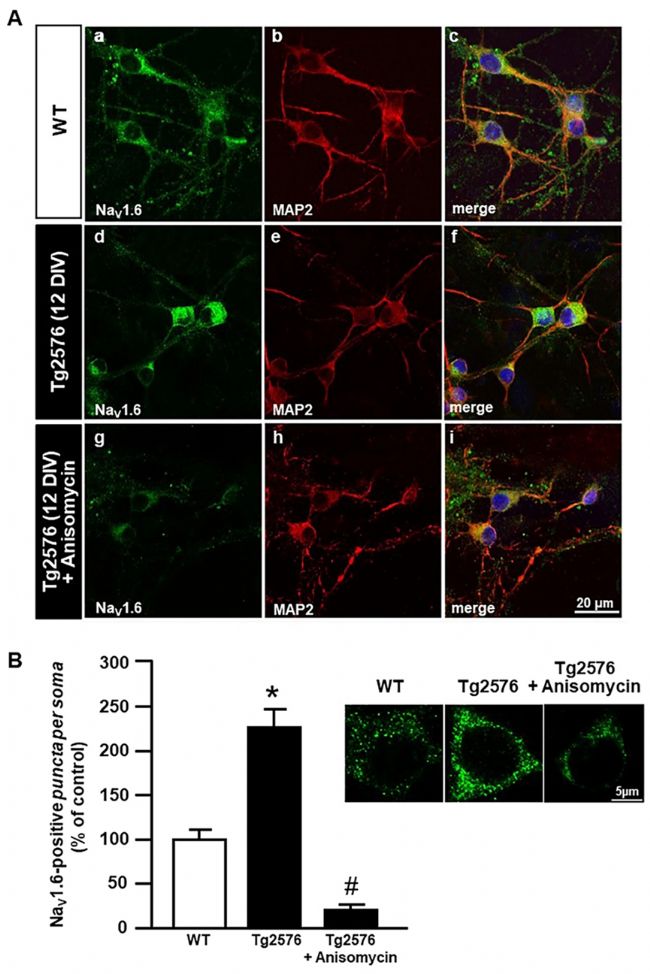
在圖2.12 DIV時,Tg2576原代海馬神經元在經過異霉素處理后,NaV1.6蛋白表達的免疫細胞化學的分析(Anti-Nav1.6(SCN8A)#ASC-009)。(A)免疫熒光共聚焦圖像,顯示WT(a-c)和Tg2576原發性海馬神經元在無(d-f)或有(g-i)茴香霉素時的NaV1.6(綠色)和MAP2(紅色)分布情況。a-i中的標尺:20μm。(B)定量分析:WT和Tg2576原發性海馬神經元在有無茴香霉素的情況下,其腦室內NaV1.6陽性點。標尺:5μm。數據以3次獨立實驗中每組20個細胞的平均值±SEM表示。相較于WT,**p<0.01;相較于Tg2576,#p的值<0.001。摘錄自Ciccone, R. et al. Sci Rep9, 13592 (2019)。
解開謎團
隨著拼圖的逐步完成,研究團隊開始探索Aβ1-42寡聚體是如何增強海馬神經元中NaV1.6的活性的。他們觀察到,由于Aβ1-42低聚物和細胞內的累積,NaV1.6蛋白表達和功能活性選擇性都有所提升。有趣的是,在Tg2576海馬神經元里也觀察到了這種上調,這進一步加強了Aβ1-42與NaV1.6通道的相互聯系。
盡管關于Aβ1-42低聚物如何增強NaV1.6活性的具體機制尚不明確,但研究人員猜測,這可能涉及到基因轉錄的改變、蛋白質降解的減少或Aβ1-42與淀粉樣前體蛋白(APP)等其他蛋白的相互作用,后者可能會影響NaV1.6通道向細胞膜的位置轉移。
關于NaV1.6和AD的未解之謎
盡管研究的前景令人充滿好奇,但仍存在未解之謎和需要解決的挑戰。研究團隊已經呈現了令人信服的證據,這些證據表明NaV1.6與阿爾茨海默病(AD)背景下神經元的過度興奮有關。盡管如此,Aβ1-42低聚物提高NaV1.6活性的作用機制依然未知。了解這些機制對于開發靶向治療藥物至關重要。
Aβ1-42寡聚體與負責蛋白質降解的泛素系統之間的交互作用是一個引人注目的議題。觀察結果顯示,Aβ1-42寡聚體能夠破壞泛素系統,從而導致阿爾茨海默病(AD)小鼠模型中蛋白質的降解減少。這種失調是否會導致NaV1.6的上調?深入探討Aβ1-42與泛素系統間的紛繁復雜的聯系,有可能揭示出更多的治療靶點。
盡管這項研究主要關注NaV1.6在神經元過度激活中的作用,但其潛在的影響范圍可能更為廣泛。隨著我們對阿爾茨海默病(AD)復雜性進一步了解,探究NaV1.6是否對突觸功能障礙、神經炎癥以及其他相關疾病的發生有所助益變得尤為關鍵。這些知識有可能為干預措施提供全新的路徑。
NaV1.6:一個重要的新角色
這項研究不僅揭示了NaV1.6通道在阿爾茨海默病(AD)疾病中的功能,同時也為我們提供了可能的治療方法。研究人員理論上能夠通過靶向NaV1.6通道的上調和激活,來對抗阿爾茨海默病(AD)早期階段海馬的過度興奮和隨后出現的認知障礙。
值得強調的是,把這些研究成果應用到臨床實踐中是一項充滿挑戰的工作。研發特異性靶向 NaV1.6 的藥物,同時避免脫靶效應,一直是全球藥物藥物研發科學家努力解決的問題在,其所能帶來的潛在收益是非常龐大的。
這項研究的意義遠不止于阿爾茨海默病(AD)。過度興奮和神經元網絡紊亂也是癲癇等其他神經系統疾病的特征。深入了解NaV1.6在這類疾病中的角色,可能會為神經科學帶來更為深遠的影響。
綜合來看,這項研究讓我們離了解阿爾茨海默病(AD)大腦的復雜運作更近了一步。科學家們通過揭示NaV1.6在Aβ1-42寡聚體引發的神經元過度激活中的核心角色,為未來的治療提供了一個很有希望的靶點。盡管仍有大量的研究工作待完成,但這些新的發現為治療阿爾茨海默病(AD)和其他神經系統相關疾病提供了新的方向,并確保了離子通道在研究中的核心地位。
相關文獻
Ciccone R, Franco C, Piccialli I, Boscia F, Casamassa A, de Rosa V, Cepparulo P, Cataldi M, Annunziato L, Pannaccione A. Amyloid β-Induced Upregulation of Nav1.6 Underlies Neuronal Hyperactivity in Tg2576 Alzheimer's Disease Mouse Model. Sci Rep. 2019 Sep 19;9(1):13592. doi: 10.1038/s41598-019-50018-1. PMID: 31537873; PMCID: PMC6753212.





