高內涵成像分析技術助力對腫瘤分子機制進行多模型驗證
目前國內抗腫瘤藥物研發處于快速發展的階段,對于藥物的安全性、治療體驗和生存質量都有了更高的期望。回顧2016-2021年國內腫瘤領域涉及的靶點數量和新藥受理數量都位居榜首,但是很多團隊都集中在熱門靶點上,客觀上造成了一定資源的浪費。對腫瘤分子機制的研究成為了新型藥物靶點的必需階段。因此,越來越多的團隊在對分子機制進行詳細的探究后,都開發相關的靶點藥物。該藥物不僅僅能夠作為工具進一步推進機制研究的深度,而且還能夠作為臨床藥物開發的基礎。
在今年發表在Nature Communications 上的Phosphorylation and stabilization of EZH2 by DCAF1/VprBP trigger aberrant gene silencing in colon cancer中研究人員詳細的解釋了DCAF1基因的具體機制,并利用該機制相關的化合物對潛在腫瘤治療效果進行初步探討。
DDB1和CUL4相關因子1(DCAF1),也稱為VprBP(HIV-1 Vpr結合蛋白),最初被確定為與HIV-1 Vpr相互作用的蛋白質,并被認為是細胞周期和細胞增殖的調節因子。DCAF1在結腸癌中過表達并催化H2A的T120位點磷酸化滅活編碼細胞生長和增殖主要調節因子的基因;另外,許多組蛋白修飾酶也靶向非組蛋白,這也暗示可能通過非組蛋白底物可以介導其他DCAF1功能。因此,研究DCAF1在非組蛋白修飾中的功可以為致癌信號通路提供更深入的見解,并為解決結腸癌和其他癌癥提供更有效的策略。
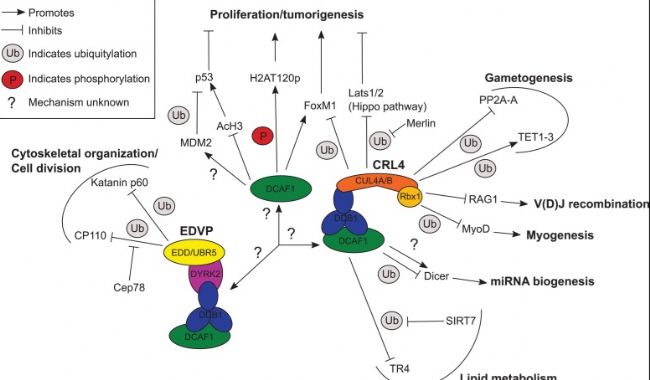
而該工作首先證明了DCAF1在結腸癌發展過程中介導EZH2的T367位點磷酸化的作用。DCAF1介導的EZH2 T367p通過EZH2蛋白的積累和EZH2酶活性的激活刺激癌細胞生長,并催化導致癌癥細胞中的H3K27me3。這一甲基化的作用與生長調節基因的失活高度相關,導致細胞增殖和生長不受控制。DCAF1介導的EZH2磷酸化具有致癌作用,敲除或抑制DCAF1會重新激活大量抑癌基因并阻礙癌癥細胞增殖。
而后確定了DCAF1的抑制劑B32B3和EZH2的抑制劑Taz對結腸癌細胞系的生長抑制作用后。研究者選擇使用在他們最近的研究中成功使用的結腸癌患者來源的更生理相關性的類器官(PDO)模型評估B32B3與Taz。PDO首先使用來自消化結腸腫瘤標本的細胞懸浮液按照之前的方案進行建立。然后,用濃度梯度的B32B3和Taz對PDO處理5天,并通過測量多功能酶標儀發光強度細胞活力檢測來確定藥物治療的反應;同時,利用Operetta CLS對PDO樣品進行監測,Taz與B32B3協同處理后,類器官總數量和大小發生了更顯著的變化。

為了進一步評估Taz和B32B3在體內的影響,研究人員通過皮下注射表達增強綠色熒光蛋白(eGFP)的SW620細胞到裸鼠的兩側來生成異種移植模型。當Taz和B32B3在單獨處理異種移植小鼠21天時,它們能夠限制SW620異種移植腫瘤的增殖能力。然后測試Taz和B32B3組合。與PDO中結果類似,與用單一藥物(Taz或B32B3)治療相比,Taz與B32B3治療在SW620異種移植腫瘤的生長中引起更顯著的抑制效果高達70-80%。
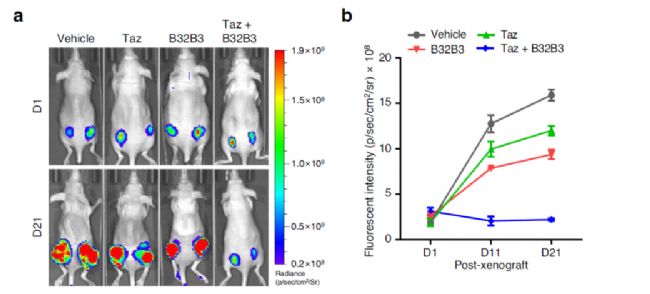
這是一個重要的發現,因為它表明DCAF1和EZH2抑制劑可以通過在生長調節基因上的不同表觀遺傳狀態進行組合治療,以達到對結腸癌患者更有利的治療效果。為下一步臨床治療策略的創新提供依據。


本研究工作在細胞模型中,利用傳統的WB,PCR,質譜,圓二色性檢測等工具對信號通路進行詳細研究;并利用類器官和動物模型進行藥效評價。該評價過程使用到了多功能檢測技術,高內涵成像分析技術(Operetta CLS)和小動物光學活體成像技術(IVIS Lumina/Spectrum)。
參考文獻
Ghate N B, Kim S, Shin Y, et al. Phosphorylation and stabilization of EZH2 by DCAF1/VprBP trigger aberrant gene silencing in colon cancer[J]. Nature Communications, 2023, 14(1): 2140.





