黑色素瘤中痛覺神經元通過增加CGRP產生影響CD8+T細胞能力的研究
Nature文獻解析:疼痛竟然還可以幫助癌癥?快來一看究竟!
在癌細胞復雜的生物學特性中,有一個很少被討論但卻至關重要的組成部分:神經纖維。 近期,一篇發表在Nature上的文獻《Nociceptor neurons affect cancer immunosurveillance》解釋了黑色素瘤如何利用神經纖維生存【1】。黑色素瘤似乎利用了疼痛的力量來破壞我們身體的防御機制。
黑色素瘤與神經相互作用
癌癥豐富的神經纖維網絡是導致其發病的不常見因素之一【2】。例如,在前列腺癌中,神經祖細胞最終會有助于腫瘤的發展和擴散【3】。雖然神經纖維嵌入腫瘤內并不是什么新鮮事,但這種相互作用的后果,尤其是與疼痛信號感覺神經元(痛覺神經元)的相互作用的后果,卻一直難以捉摸。在這項令人難以置信的合作研究中,科學家們發現,當黑色素瘤細胞與這些痛覺神經元相互作用時,它們不僅會促進這些神經元的生長和活動,而且還會提高它們對疼痛刺激的敏感性【4】。
提高疼痛探測器的靈敏度
黑色素瘤會主動影響鄰近痛覺感受器的行為,使其反應更加敏感。研究人員能夠證明,當在黑色素瘤細胞存在的情況下培養痛覺感受器時,它們對疼痛刺激的反應會增強,這說明了黑色素瘤的操縱能力。
在探索黑色素瘤與神經的相互作用時,他們注意到,盡管人類惡性細胞和免疫細胞都不表達神經元起源基因(通過 RNA 測序確定),但在黑色素瘤患者的活檢組織中卻能看到它們的表達。使用Alomone Lab的Anti-TRPV1 antibody(#ACC-030)來識別TRPV1+神經元,他們發現這些神經元與痛覺有關,與鄰近的健康組織相比,這些神經元在黑色素瘤中的表達量大約增加了兩倍。有趣的是,他們發現腫瘤浸潤淋巴細胞(TILs)的數量與這些疼痛受體的增加有關(圖 1)。
支配患者黑色素瘤的 TRPV1+ 神經元
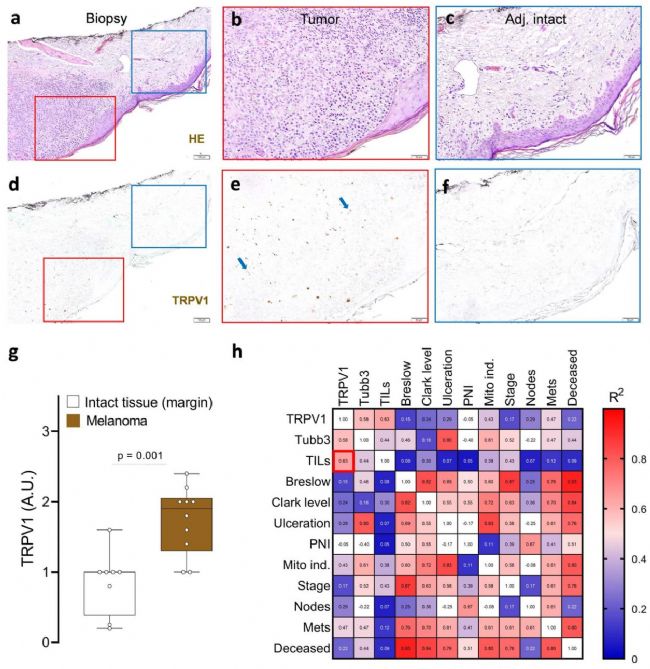
圖 1.患者黑色素瘤切片經蘇木精-伊紅染色(a-f),并通過免疫組化方法分析 TRPV1(d-f;棕色)神經元的存在(使用Alomone的Anti-TRPV1 antibody (#ACC-030))與鄰近的健康皮膚(藍色方框劃定;a,c,d,f)相比,腫瘤(紅色方框劃定;a-b,d-e)中的 TRPV1+ 神經元(g)含量增加。腫瘤切片中 TRPV1 免疫標記的增加主要與腫瘤浸潤白細胞(h)水平的增加相關,這是對患者病理報告進行回顧性相關分析后得出的結果。數據顯示為具有代表性的免疫組化圖像(a-f)、框須圖(從最小值到最大值;框從第 25 百分位數到第 75 百分位數,中間線表示中位數),其中單個數據點已給出(g)或顯示皮爾遜相關性(R2)的熱圖(h)。人數如下:a-f:n=10;g:完整(n=8)、腫瘤(n=10);h:n=10。切片由兩名經驗豐富的醫學病理學家盲法評分。P 值顯示在圖中,通過雙側非配對學生 t 檢驗確定(g)。比例尺 = 100 μm(a,d),50 μm(b,c,e,f)。圖片和圖例來自 Balood, M. et al. (2022) Nature, 611(7935), 405-412.
為了深入探討這一問題,我們將表達 GFP 的黑色素瘤細胞引入特定品種的小鼠體內,結果發現腫瘤周圍和內部存在大量 NaV1.8+ 痛覺感受器神經元。其他體外研究表明,當 TRPV1+ 感受器和黑色素瘤細胞一起培養時,感受器會主動向黑色素瘤細胞生長。這種行為類似于癌癥的新血管生成,即形成新的血管為腫瘤提供營養。
黑色素瘤似乎有能力改變痛覺感受器的敏感性。涉及有害配體的測試表明,黑色素瘤細胞會提高這些痛覺感受器的反應能力,從而導致痛覺感受器的敏感性增強。當DRG神經元與黑色素瘤細胞共同培養時,培養基中會主動釋放降鈣素基因相關肽(CGRP),這是一種免疫調節神經肽。基因表達分析證實,與疼痛和疼痛調節有關的基因在接觸黑色素瘤細胞后發生了顯著變化。
SLPI 在痛覺感受器敏化中的作用
為了了解黑色素瘤致敏痛覺感受器的機制,我們開發了一種模擬黑色素瘤環境的共培養系統。一個重要發現是,當黑色素瘤細胞與DRG神經元或特異性細胞毒性T細胞共培養時,分泌型白細胞蛋白酶抑制劑(SLPI)在黑色素瘤細胞中過度表達。研究發現,SLPI 除了已知的功能外,還能激活 DRG 神經元,尤其是痛覺神經元。這種激活導致這些神經元釋放 CGRP,從而揭示了黑色素瘤可能用于提高疼痛敏感性的途徑。體內試驗進一步證實,將SLPI引入小鼠體內確實會導致疼痛敏感性增強。
研究人員還發現,黑色素瘤分泌的SLPI可作用于痛覺感受器,啟動鈣離子流入、神經肽釋放和熱超敏反應。這表明,這些痛覺感受器可以檢測到惡性細胞的存在,并可能對其做出反應。一個耐人尋味的觀察結果是,對熱痛敏感性的提高與腫瘤內特異性免疫細胞的增加呈正相關(圖2)。
SLP1激活并作用于痛覺神經元
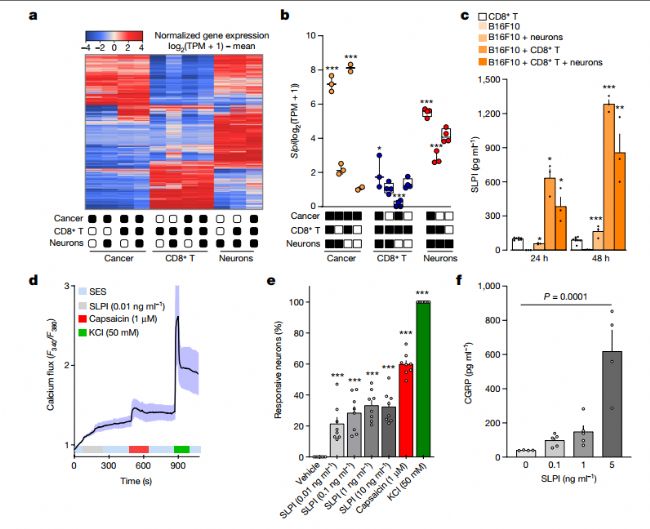
圖2:腫瘤分泌的SLPI驅動傷害感受器神經元釋放CGRP。a-c、幼稚DRG神經元(Trpv1cre::- cherff - egfpfl /WT)、B16F10-mCherryOVA細胞和ova特異性細胞毒性CD8+ T細胞單獨或聯合培養。48 h后,收集細胞,純化FACS并進行RNA測序。a,分類神經元分子圖譜的分層聚類描述了每組中富集的不同轉錄本組。b,計算deg,當與ova特異性細胞毒性CD8+ T細胞、DRG神經元或兩者共培養時,發現Slpi在癌細胞中過表達。c, B16F10-mCherry-OVA細胞在與原始DRG神經元和ova特異性細胞毒性CD8+ T細胞共培養(24 h或48 h)時分泌SLPI,在48 h后效果最大。d - f,使用鈣顯微鏡,我們發現SLPI (10 pg ml−1 - 10 ng ml−1)激活了大約20%培養的初始DRG神經元(d,e)。用SLPI激活培養的神經元(3小時)也會導致CGRP的顯著釋放(f)。數據顯示為顯示標準化基因表達的熱圖(log2(1 + TPM) - mean (a)),框和哨子圖(如圖1b,c) (b)所定義)或mean±s.e.m。(氟)。N如下:a,b: N = 2-4組;c:除CD8+ T細胞外,其余各組n = 3 (n = 8);D: n = 17;E: n = 8 /組;f: 0 ng毫升−1 (n = 4), 0.1 ng毫升−1 (n = 5), 1 ng毫升−1 (n = 5), 5 ng毫升−1 (n = 4)。c-f的實驗獨立重復了三次,結果相似。測序實驗不重復(a,b)。P值采用事后Bonferroni (b,e,f)或雙側未配對Student 's t檢驗(c)進行單因素方差分析。*P≤0.05,**P≤0.01,***P≤0.001。
CGRP 的作用:一把雙刃劍
神經肽 CGRP 是這一惡性聯盟的關鍵角色之一。CGRP 由這些超敏痛覺感受器大量產生,它有一個陰險的作用:直接導致 CD8+ T 細胞衰竭,而 CD8+ T 細胞是我們的免疫系統抵御黑色素瘤的主要屏障。這又是為什么呢?T 細胞,尤其是具有細胞毒性的 CD8+ 細胞,完全有能力消除癌細胞等威脅。但 CGRP 似乎消耗了它們的活力,損害了它們抵御黑色素瘤入侵的能力。
利用三陰性黑色素瘤小鼠模型,將 B16F10-mCherry-OVA 細胞引入八周大的小鼠體內。研究結果表明,在沒有痛覺感受器的情況下,小鼠的壽命不僅延長了約 2.5 倍,而且腫瘤的生長也明顯減少。值得注意的是,在腫瘤生長減少的同時,細胞毒性腫瘤浸潤 CD8+ T 細胞也在增加。相反,在通過注射Alomone的Resiniferatoxin #(R-400)(TRPV1通道蛋白的激活劑)后,PD-1+LAG3+TIM3+ CD8+ T 細胞的比例明顯下降(圖 3)。
這些數據描繪了一幅令人信服的圖景,暗示痛覺神經元在驅動瘤內衰竭 T 細胞群方面發揮著關鍵作用。有證據顯示,在瘤內 CD8+ T 細胞明顯衰竭前數天就出現了熱超敏反應,這進一步支持了這一假設。值得注意的是,這種痛覺過敏在任何可測量的腫瘤生長之前就已出現。
細胞衰竭之所以重要,是因為衰竭的 T 細胞失去了功能效力,包括產生關鍵免疫分子(IFNγ、TNF 和 IL-2)的能力和增殖能力。這些 T 細胞還會同時增加衰竭標記物(如 PD-1、LAG3 和 TIM3)的表達,從而降低它們消滅癌細胞的效率。
基因消融痛覺感受器可保護抗腫瘤免疫力
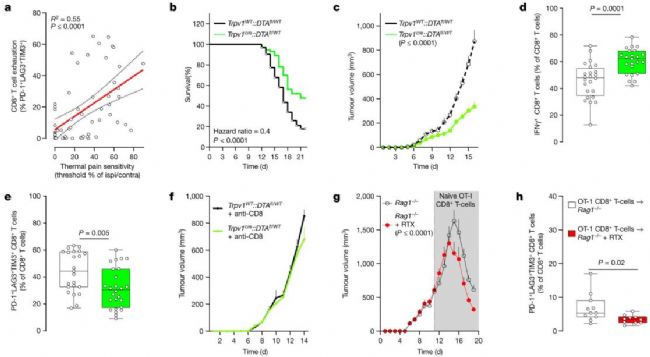
圖 3:a,野生型小鼠的左后爪注射異位 B16F10-mCherry-OVA 細胞(2 × 105 cells,i.d.)。腫瘤接種后第13天,瘤內CD8+ T細胞衰竭與熱痛覺過敏呈正相關(R2 = 0.55,P ≤ 0.0001)。熱痛超敏度代表同側爪子(接種腫瘤)與對側爪子的退縮潛伏期比值。 b, 將異位 B16F10-mCherry-OVA (5 × 105 cells,i.d. )接種到八周大的雄性和雌性小鼠的側腹,這些小鼠的感覺神經元完好無損(Trpv1WT::DTAfl/WT)或被消融(Trpv1cre::DTAfl/WT)。c-f, 接種腫瘤 16 天后,感覺神經元消減的小鼠腫瘤生長減少(c),IFNγ+ CD8+ T 細胞的腫瘤浸潤增加(d),PD-1+LAG3+TIM3+ CD8+ T 細胞的比例減少(e)。B16F10-mCherry-OVA(5 × 105 cells,i.d.)腫瘤體積的減少在全身性耗竭 CD8+ T 細胞的神經感受器缺失小鼠中不存在(f;評估至第 14 天;抗 CD8,每只小鼠 200 μg,i.p.,每 3 天一次)。g,h, 為了化學性地耗竭它們的神經感受器神經元,Rag1-/- 小鼠被注射了 RTX (Resiniferatoxin (R-400))。28 天后,給小鼠接種 B16F10-mCherry-OVA (5 × 105 個細胞,i.d.)。與藥物暴露的 Rag1-/ 小鼠相比,RTX 注射的小鼠經收養轉入天真 OVA 特異性 CD8+ T 細胞(靜脈注射,1 × 106 個細胞,當腫瘤達到約 500 mm3 時)后,腫瘤生長(g;評估至第 19 天)和衰竭(h)均有所減少。數據顯示為線性回歸分析 ± s.e.(a)、Mantel-Cox 回歸(b)、平均值 ± s.e.m.(c,f,g)或箱輻圖(如圖 1b,c 所定義),并給出了單個數據點(d,e,h)。n 如下:a:n = 60;b:完好(n = 62),消融(n = 73);c:完好(n = 20),消融(n = 25);d:完好(n = 24),消融(n = 23);e:完整(n = 23),消融(n = 26);f:完整 + 抗 CD8(n = 10),消融 + 抗 CD8(n = 8);g:載體(n = 12),RTX(n = 10);h:載體(n = 11),RTX(n = 10)。實驗獨立重復兩次(a,f-h)或六次(b-e),結果相似。P 值通過簡單線性回歸分析(a)、Mantel-Cox 回歸分析(b)、雙向方差分析及事后 Bonferroni 檢驗(c,f,g)或雙側非配對學生 t 檢驗(d,e,h)確定。圖片和圖例來自 Balood, M. et al. (2022) Nature, 611(7935), 405-412.
為了解決早期消融神經元亞群可能導致的代償性變化,研究人員使用肉毒桿菌神經毒素A(BoNT/A)對神經元進行了沉默處理。BoNT/A能有效減少腫瘤生長,同時不影響腫瘤細胞和CD8+ T細胞的功能。然而,其療效似乎取決于痛覺神經元的存在。我們采用了另一種方法,對已知的痛覺感受器選擇性策略的沉默效果進行了研究。QX-314 被用來阻斷大孔離子通道,從而產生持久的電阻斷。值得注意的是,QX-314 不僅能減少黑色素瘤的生長,還能保持瘤內 CD8+ T 細胞的完整性和功能性,從而加強了其在癌癥領域的潛在治療作用。
更廣闊的視野和對癌癥治療的影響
本文所述研究探討了黑色素瘤中痛覺神經元的存在如何增加 CGRP 的產生,進而影響腫瘤附近 CD8+ T 細胞的能力。CGRP 水平的升高與 CD8+ T 細胞中免疫檢查點受體的高表達相關,從而導致它們對抗腫瘤的能力減弱。
這種神經和免疫系統的交會對黑色素瘤研究和癌癥治療具有深遠的影響。深入了解 CGRP 在降低 CD8+ T 細胞抗癌能力方面的作用至關重要。我們現在知道,當痛覺感受器神經元的活動受到抑制時,CD8+ T 細胞的功能仍能保持,這突出表明了 CGRP 在 T 細胞衰竭中的重要作用。此外,RAMP1拮抗劑BIBN4096在減少腫瘤生長和CD8+ T細胞衰竭頻率方面表現良好,這表明該藥物有可能針對有利于腫瘤進展的神經-免疫相互作用。
這項研究的一些數據表明,黑色素瘤研究和癌癥治療有可能取得突破。作者推測,通過干擾CGRP-RAMP1軸,有可能使CD8+ T細胞重新煥發活力,增強機體對抗黑色素瘤等癌癥的先天能力。這不僅為開發針對CGRP-RAMP1軸的藥物打開了大門,也為那些對目前的免疫療法(如免疫檢查點抑制劑)產生抗藥性的患者帶來了希望。通過解決助長癌癥環境的神經-免疫聯系,可以設想出新的治療策略,協同神經和免疫系統的力量對抗惡性腫瘤。
黑色素瘤細胞與引發疼痛的神經元之間的這種交織有助于我們理解疼痛的進展。雖然疼痛與癌癥的交會乍看之下可能有悖常理或不太可能,但了解其動態變化很可能會為黑色素瘤研究領域提供新的治療策略。
【1】Balood M, Ahmadi M, Eichwald T, et al. Nociceptor neurons affect cancer immunosurveillance[J]. Nature, 2022.
【2】Zahalka A H, Frenette P S. Nerves in cancer[J]. Nat Rev Cancer, 2020, 20(3): 143-157.
【3】Magnon C, Hall SJ, Lin J, et al.Autonomic nerve development contributes to prostate cancer progression.Science. 2013 Jul 12;341(6142):1236361.
【4】Balood M, Ahmadi M, Eichwald T, et al. Nociceptor neurons affect cancer immunosurveillance. Nature. 2022;611(7935):405-412