活體光學成像在腫瘤臨床前檢測中的應用
在全球范圍內,癌癥是主要的公共衛生問題,而中國惡性腫瘤發病和死亡人數位居世界之首。如今,惡性腫瘤發病率和死亡率均呈逐年上升趨,給家庭和社會帶來極大的痛苦和負擔。腫瘤發病早期在微觀分子尺度上變化很小,也沒有明顯的外在表現,患者很容易忽略腫瘤的存在。因此,找到高靈敏度的臨床前檢測方案對腫瘤早期篩查有很大幫助,而腫瘤發生、發展和轉移的動態可視化監測也將在患者的個性化精準治療過程中發揮重要的作用。
熒光成像技術具有較高的空間分辨率和靈敏度,生物相容性良好的熒光探針被廣泛應用在在臨床前檢測。其中近紅外發射的熒光探針由于組織穿透性更好,快速實時的體內外監測能力而蓬勃發展。由于腫瘤有異常表達的生物標志物,因此研究人員可利用特殊標志物進行腫瘤細胞的特異性識別,從而設計腫瘤臨床前檢測的有力工具。
1、pH激活的近紅外熒光探針用于檢測肺轉移性腫瘤
腫瘤從原發位置擴散到身體其他部位發生轉移將影響整體的治療進程,而肺轉移幾乎占所有惡性腫瘤轉移的一半以上。因此,通過對肺轉移的特異性檢測可以獲得及時可靠的信息來阻止轉移進展,從而改善治療效果。研究人員對親脂性染料IR780進行改造,通過與pH敏感的磷酸鈣相結合獲得了一種pH響應的熒光探針——肺轉移示蹤劑9(PMT9)。Revvity活體光學成像結果表明,PMT9對肺部腫瘤有較高的特異性,可以準確識別原發性肺部腫瘤和肺部轉移腫瘤灶(如圖1)。
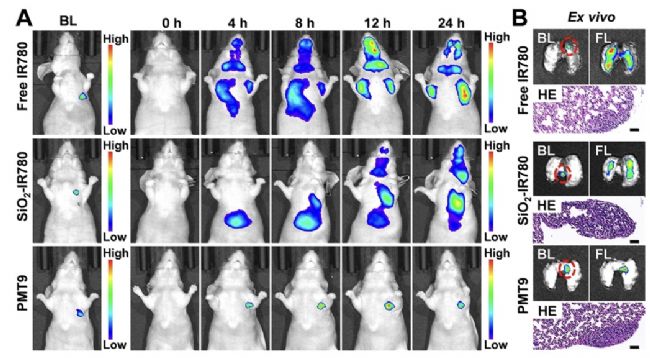
圖1 PMT9體內特異性識別原位肺腫瘤
2、超靈敏的深近紅外(NIR)納米探針用于腫瘤早期檢測
目前通過磁共振成像和正電子發射斷層掃描可以對早期腫瘤進行檢測,但是極限成像尺寸約為1mm,小于1mm的腫瘤很難被發現。因此,研究人員利用熒光成像極高的靈敏度,進行早期微米級腫瘤灶的檢測,為腫瘤早期檢測提供了新思路。文獻報道了一種可被酸性和乏氧次序激活的熒光納米探針Ir-D,該探針由可被酸降解的聚乙二醇殼和氧氣敏感的銥配合物疏水核構成。在腫瘤部位酸性條件下,酸敏感亞胺斷裂使探針的聚乙二醇外殼逐漸脫落,銥配合物疏水核由此暴露出來并發生聚集伴隨發出近紅外波段熒光。由于酸性和乏氧是腫瘤特異性的微環境,因此該探針可以準確識別體內腫瘤病灶。如圖2所示,Ir-D探針在不同種類的皮下瘤、轉移瘤以及PDX腫瘤模型中都能實現高靈敏度的成像。
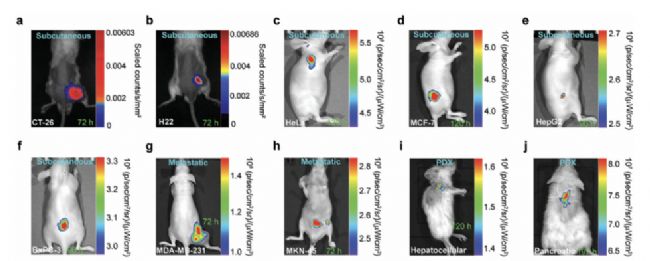
圖2 Ir-D探針在不同腫瘤模型中成像
隨后,研究人員還進行了探針的靈敏度的測試。在小鼠背部植入不同數量的H22細胞后,尾靜脈注射Ir-D熒光探針,實驗結果表明,注射探針8h后小鼠背部觀察到明顯的熒光信號,并且僅注射數百個腫瘤細胞的小鼠信號強度比對照組平均高約2.0倍。為了進一步評估Ir-D對于微小腫瘤灶的檢測能力,研究人員將腫瘤類器官植入到小鼠乳腺構建了早期腫瘤模型,并在建模成功后尾靜脈注射Ir-D探針,通過Revvity活體光學成像進行觀察。實驗結果表明Ir-D可以識別到微小腫瘤,組織切片結果顯示腫瘤大小僅為260×290μm(如圖3)。
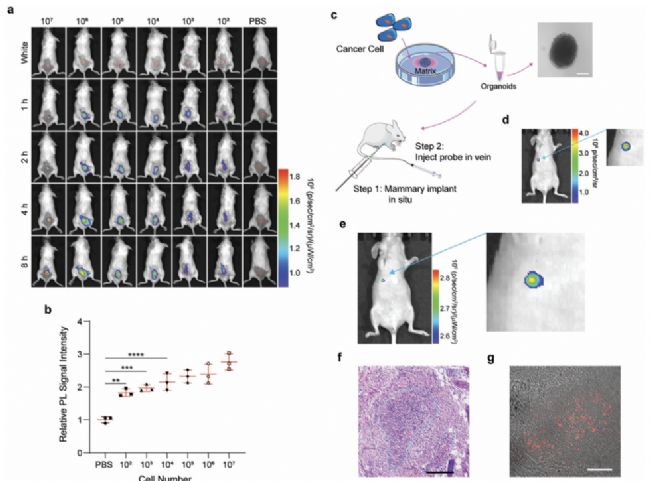
圖3 Ir-D探針靈敏度檢測
3、有機分子放射余輝探針用于腫瘤篩查和協同治療
熒光探針雖然廣泛應用在腫瘤早期檢測,但是由于背景光和組織自發熒光的干擾,信噪比不是很理想,限制在臨床上的應用。因此,能在激發光停止照射后儲存能量并緩慢釋放光子的余輝探針應運而生,在去除了組織自發熒光的干擾后,余輝探針具有極高的檢測靈敏度和信噪比。與熒光激發相比,X射線具有更深的組織穿透性,不但可以將高能量傳送到深層腫瘤部位,而且可以在余輝成像的同時起到放射治療的協同效果。現在對此類探針的研究仍然很少,主要集中在無機納米磷光體,還沒有有機分子在X射線照射后發出余輝的報道。該研究首次闡述了有機分子的放射動力學過程,解釋了單線態氧產生及余輝信號的產生原理,該探針可以用來進行體內腫瘤的超靈敏檢測。
研究人員基于受體-苯氧基-金剛烷烯骨架的合成方法成功制備余輝動態發光體。X射線輻照IDPA會產生單線態氧,然后原位生成的單線態氧通過環加成反應與IDPA反應轉化為二氧雜環丁烷中間體,該中間體逐漸分解并釋放光子,產生余輝信號,圖4展示了X射線和光學激發穿透深度的差異。
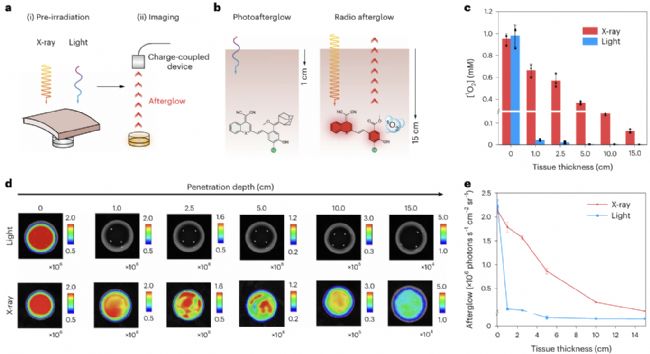
圖4 深層組織射電余輝動態過程
隨后,研究人員用生物發光標記的U87細胞構建皮下腫瘤模型,通過Revvity活體光學成像進靈敏度檢測,實驗結果表明尾靜脈注射X射線激發的余輝探針可以實現體內微小腫瘤灶的檢測,實驗檢測到腫瘤最小體積1.08mm3,直徑0.64mm(如圖5所示)。
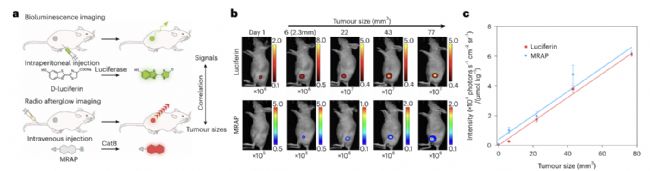
圖5 余輝探針的靈敏度檢測
參考文獻
1. Jia, Qian, et al. "An Activatable Near‐Infrared Fluorescent Probe for Precise Detection of the Pulmonary Metastatic Tumors: A Traditional Molecule Having a Stunning Turn." Angewandte Chemie (2023): e202313420.
2. Zhou, Sensen, et al. "Acid and Hypoxia Tandem‐Activatable Deep Near‐Infrared Nanoprobe for Two‐Step Signal Amplification And Early Detection of Cancer." Advanced Materials (2023): 2212231.
3. Huang, Jingsheng, et al. "Molecular radio afterglow probes for cancer radiodynamic theranostics." Nature Materials 22.11 (2023): 1421-1429.





