染色質重塑/組蛋白修飾/DNA甲基化應用:人早期胚胎發育的表觀遺傳調控
哺乳動物發育研究促進了對協調胚胎發生遺傳、表觀遺傳和細胞過程的理解,并揭示了對人類胚胎發生特異性新見解。最近研究生成了人類早期胚胎發生的第一個表觀遺傳學圖譜,激發了關于表觀遺傳學重編程、細胞命運調控以及支撐人類胚胎發育可塑性的潛在機制新想法。本綜述討論了這些對人類早期發育的表觀遺傳學調控新見解以及這些過程對保護發育的重要性,還強調了尚未解決的問題和尚待解決的關鍵挑戰。
背景(Introduction)
表觀基因組在胚胎發育的最初幾天會發生巨大變化。表觀基因組重置和建立在胚胎發生的更廣泛過程中進行協調和促進。因此需要表觀遺傳調控來保護發育并建立在整個生命過程中對基因組功能有影響的長期表觀遺傳狀態。
表觀遺傳信息通過告訴細胞它們的過去、現在和未來來促進胚胎發育。它提供了對所做決定和過去遇到情況的分子記憶,將早期事件作為化學標記整合到基因組中并穩定傳遞。這些標記也會預示未來事件,尤其是譜系分化決定,并由不同的表觀遺傳調節因子的調控下發揮廣泛作用,這些調節因子本身具有不同的功能并劃分不同的基因組元件。多種表觀遺傳通路(包括染色質重塑、組蛋白修飾和DNA甲基化)的協調調控著基因時空表達,并嚴格限制胚胎發生過程中重復元件的必要但潛在有害的活動。
受精后,高度特化的精子和卵母細胞的表觀基因組被重編程,以建立適合胚胎發育的全能性狀態。母系遺傳因素在受精后的前3天維持人類胚胎的分裂,然后在4細胞期(4C)到8細胞(8C)期發生胚胎基因組激活(embryonic genome activation,EGA)的主要波。經過EGA后,人類胚胎首先形成桑葚胚,然后形成具有明確內細胞團(ICM)的早期囊胚,植入囊胚有三種不同的細胞系:上胚層(epiblast,產生所有胎兒組織)、下胚層(hypoblast,形成卵黃囊)和滋養外胚層(trophectoderm,后來形成胎盤)。在接下來的一周內,胚胎形成額外的胚胎外譜系,外胚層開始按照原腸胚形成的預期進行定型,這在胚胎發生的第三周開始。
關于人類胚胎發生的許多知識來自于對組織學的集合研究。最近改進的方法使人類胚胎的體外培養和研究成為可能,直到大約胚胎第14天(E)。與此同時,由于人類胚胎研究存在重大技術和倫理挑戰,大量的體外系統旨在復制全部或部分早期人類胚胎。這些細胞包括反映原腸胚形成前期的細胞,包括8c樣細胞(8clc)、初始和啟動的人多能干細胞(hPSCs)和譜系限制性細胞系。其中一些細胞類型還提供了構建更復雜結構的基礎,如基于干細胞的整合模型(囊胚和植入后組裝體)和非整合模型,如原腸樣細胞。
本綜述討論了早期人類發育的表觀遺傳表征的新見解。這些研究對于理解表觀遺傳過程如何幫助調控和協調人類胚胎發生,以及表觀遺傳過程如何在這一時期與其他細胞和分子通路協調發生具有重要意義。對表觀遺傳過程的深入了解也將揭示表觀基因組對遺傳和環境變異的脆弱性。盡管重點是人類胚胎發育,但在相關條件下與其他物種的新數據以及基于干細胞的胚胎模型進行了比較。這些替代系統對于幫助建立發育過程中表觀遺傳過程的因果關系至關重要。此外還概述了當前的知識差距和關鍵的未決問題。
染色質重塑:打開胚胎基因組以塑造發育程序
在人類胚胎發生期間,染色質廣泛重塑以改變其可及性,最大變化與關鍵發育的重要階段重合(圖1)。染色質可及性可定義為DNA可用于因子(包括轉錄機制和表觀遺傳修飾因子)結合的程度,其中主要決定因素包括核小體密度和間距。這樣,染色質可及性代表了區域調控基因表達的潛力。
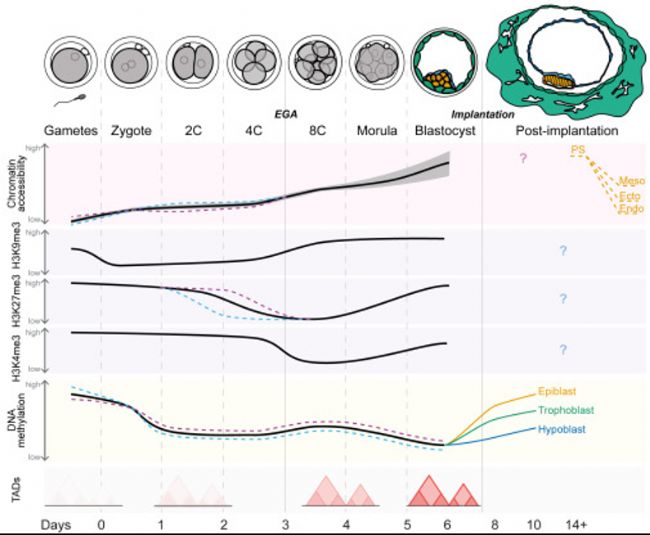
圖1:人類胚胎發育中的整體表觀基因組變化
染色質可及性(可及區域的數量)、組蛋白修飾和DNA甲基化的整體水平(黑色實線)的相對變化,以及TAD信號的相對變化。粉色和藍色虛線分別表示母本和父本基因組之間的差異。灰色陰影表示變異性。橙色虛線表示食蟹猴胚胎的動態變化。Ecto,外胚層(ectoderm);Endo,內胚層(endoderm); Meso,中胚層(mesoderm);PS,原始條紋(primitive streak)。
酶的DNA可及性是用于定量染色質可及性的技術基礎。這些酶既可以切割可及DNA (DNase-seq和ATAC-seq),也可以甲基化可及胞嘧啶(NOMe-seq),這兩種酶都可以通過高通量測序進行檢測。將這些方法應用于微量(low-input)和單細胞(single-cell)應用,能夠對人類胚胎的染色質可及性進行分析。
這些研究的一致發現是,在2-細胞(2C)和囊胚期之間,人類胚胎基因組中已鑒定的可接近區域的數量逐漸增加(圖1)。不同研究中增加的程度有很大差異,可能是由于用于鑒定可接近染色質的實驗和計算方法不同。但總體趨勢一致。與可接近區域的數量相反,在增加到囊胚期之前,從受精卵到8C期的總染色質可及性(通過基于甲基化的基因組中可及胞嘧啶比例定量確定)短暫降低。這一模式可能表明人類受精卵具有全基因組開放的染色質狀態,這是切割方法無法檢測到的。總之,這些染色質可及性的動態變化支持基因調控網絡(GRNs)在早期發育過程中多次重塑,以建立新的發育程序。
受精卵的初始重塑定義pre-EGA染色質可及性
在整個人類胚胎發育過程中,可及性區域富集了啟動子、CpG島和遠端調控元件(如增強子),與卵母細胞相比,超過8000個啟動子在人類受精卵中獲得可及性,這些啟動子通常在植入前發育的整個過程中保持開放狀態。
鑒于胚胎基因組的主要轉錄直到EGA才發生,那么在8C期之前大量可及性染色質區域的功能是什么?一種可能性是這些染色質變化是親本基因組從配子狀態重塑到胚胎狀態的副作用。卵母細胞的染色質相對開放,而精子的染色質高度濃縮在人類胚胎中,受精后父源基因組的可及性迅速增加,達到高于母源基因組的水平。這種不對稱差異一直維持至4C期,此時母本和父本基因組的可及性在EGA中相等。
另一種可能性是在受精卵中獲得可及性區域支持次要EGA,即少量基因在主要pre-EGA轉錄。然而這并不能完全解釋在pre-EGA胚胎中存在數千個可及區域。第三種情況與發育基因調控相關。人類2C胚胎中的大多數可及啟動子也在8C期獲得,盡管這些啟動子轉錄不在2C期發生,但其中許多基因后來在8C期表達 (圖2A)。因此,這些可接近啟動子可能在2C期“蓄勢”以備以后的激活,這意味著pre-EGA染色質譜的建立可能對EGA主要基因子集的及時表達非常重要。這種pre-EGA啟動子形式已經在斑馬魚中報道過,在人類胚胎中,在pre-EGA獲得可及性區域在代謝和生物合成等功能上富集。單細胞方法表明,相同胚胎期的單個細胞之間總是可接近這些區域 (圖2B)。與在早期發育后期獲得可及性或以更異質性方式獲得可及性的基因相比,這種早期可及性獲得同質模式的基因在EGA后表達更高。因此,pre-EGA染色質可及性景觀也可能為重要的管家(housekeeping)基因提供高水平表達的基礎,從而為發育過程的發生提供基礎。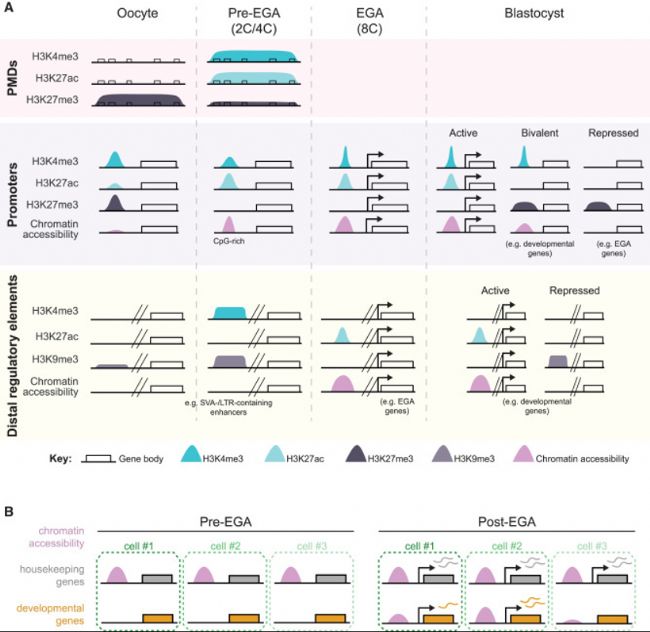
圖2:人類植入前胚胎發育中染色質可及性和組蛋白修飾的區域特異性動態變化
EGA的主要染色質可及性重塑
早期人類胚胎中染色質可及性的最大差異,特別是在啟動子上,區分了4C和早期與8C和后期。這個分離點與EGA一致,事實上,大多數在EGA轉錄上調的基因在4C和8C期之間變得可接近。
這種染色質譜的重塑在EGA中是否具有功能作用?單細胞中染色質可及性和轉錄組的聯合分析顯示,從2C到桑椹胚期的基因表達動態反映在其啟動子和假定的遠端調控區的可及性動態。這些關系的因果關系尚不清楚。許多啟動子在EGA處表現出其可及性區域擴大,這與轉錄增加一致。然而在經轉錄抑制劑α-amanitin處理的胚胎中,大多數啟動子的可及性區域都會擴大。這表明,至少對于啟動子來說,可及性增加主要先于基因表達增加。相反,可接近啟動子的轉錄非依賴性擴大可以通過重新定位核小體的整體過程來介導。相反,α-amanitin處理也導致8C胚胎具有類似于Pre-EGA胚胎的遠端調節元件可及性。這表明轉錄對于EGA染色質可及性的改變是必要的,至少在遠端元件是如此。總之,調控區域染色質可及性與基因表達相關;然而染色質可及性變化可能在不同的調控區環境中驅動或反映EGA結果。
染色質可及性變化與譜系特異性有關
從人類發育的桑葚胚期及其以后在其啟動子處獲得可及性的基因在發育過程中富集。這一可及性的增加先于第一次譜系決定,表明染色質可及性可能在細胞譜系分離過程中對GRN形成具有重要的功能。僅從轉錄組數據就可以推斷出GRN。然而,在GRN分析中納入染色質可及性數據可提高準確性,特別是對于人類胚胎數據等低樣本量的數據,并且可以預測增強子相關性。這些方法在人類囊胚譜系中鑒定出保守的GRN,由JUND和SOX4組成,它們共同調節TFAP2C表達,而TFAP2C又調控GCM1表達。這些結果強調了染色質可及性圖譜對于理解GRN在早期胚胎發育過程中如何變化的價值。
可能影響細胞命運決定的另一個重要特征是,染色質可及性(尤其是啟動子)的細胞間變化從桑葚胚期開始顯著增加(圖1)。啟動子可及性與這些區域的基因表達呈強相關,這意味著啟動子可及性變化可能驅動基因表達變化(圖2B)。同時,ICM調節因子(OCT4、KLF和SOX家族)和滋養細胞外胚層調節因子(GATA和TEAD家族)的motif區域富集。因此,胚胎內染色質可及性異質性可能提供了細胞命運決定的靈活性,或使細胞偏向于特定命運。
盡管人類胚胎中介導與譜系分離和變化相關的染色質可及性變化因子尚未鑒定,但有幾個很有前景的線索。這包括早期小鼠胚胎發育所需的核小體重塑復合物(SWI/SNF、CHD和ISWI) ,以及與初始hPSCs中的外胚層轉錄因子OCT4相關的核小體重塑SNF2家族亞基,以調節囊胚譜系基因。此外雖然在人類植入前發育的所有階段,可及性和DNA甲基化之間呈負相關,但在同一胚胎期細胞中,染色質可及性最可變區域是最一致的低甲基化區域。這表明低甲基化可能支持染色質可及性變化。這可能通過允許甲基化微小變化驅動核小體占位實質性變化,從而實現染色質可及性。或者低甲基化可能構成一種允許其他因子(包括轉錄因子)結合的狀態,而轉錄因子又根據可變的可利用性影響染色質可及性。通過這種方式,染色質重塑和DNA甲基化互作可能有助于人類早期發育的細胞可塑性。
對于大多數啟動子,post-EGA期可及性增加與該階段各自基因轉錄相關。然而其他基因顯示出更復雜的關系,可能意味著調控發育基因的不同機制。高達30%啟動子在8C或桑椹胚期可及,但在post-EGA植入前期沒有表達。這些啟動子可以在植入后期被激活。雖然這種可能性需要進一步研究,但一項相關發現是8CLC可及區域富集通常與原腸胚形成后譜系相關的轉錄因子motif。這些可及基因可能在早期表達,但在被其他過程沉默時保持其可及性。一個例子是EGA基因在桑葚胚期被沉默。
人類胚胎植入后的染色質可及性還有待研究。因此染色質可及性譜如何在植入后譜系中解決仍然未知。然而染色質可及性已在食蟹猴胚胎植入后發育中進行了研究。該研究結果表明,染色質可及性在原始條索狀細胞中達到峰值,之后在分化較強的胚層譜系中下降(圖1)。這在人類胚胎中是否保守具有重要意義。為此研究者在基于干細胞植入后人類發育模型中共同研究了染色質可及性和轉錄組數據進行聯合分析,以研究這一人類模型對靈長類胚胎是否顯示出類似的染色質可及性動態變化,以及植入后的譜系命運是否可能在發育早期就已確定。
總之染色質重塑改變了早期人類胚胎發育的多個時期可及性圖譜,并涉及從胚胎轉錄激活到未來基因表達鑒定等廣泛過程。關鍵問題包括:啟動子狀態是否持續至植入后階段?染色質可及性變化是否指導細胞命運決定,這種變化的誘導因子?人類胚胎發育背景下可及性區域廣度如何影響區域調控潛力?轉錄因子、核小體重塑因子和轉錄本身可能部分導致染色質可及性變化。然而染色質重塑發生在更廣泛的表觀遺傳重編程背景下,因此DNA甲基化和組蛋白修飾變化也可能有助于染色質重塑的最終功能結局。
組蛋白修飾:基因組激活和發育基因的動態調控因子
與染色質可及性相似,組蛋白修飾在發育過程中也高度動態(圖1)。組蛋白修飾變化普遍存在,發生在不同的發育時期和不同類型的基因組區域之間。組蛋白修飾具有組合作用,大致可分為兩類:(1)促進性染色質相關修飾,如啟動子上的H3K4me3,增強子和其他基因間區域的H3K4me1,以及活性增強子和啟動子上的H3K27ac;(2)抑制性染色質相關修飾,如H3K27me3和H3K9me3。每一種修飾又會招募下游效應因子,進而介導對基因組功能和活性的進一步影響。可以識別或調節組蛋白的系統具有多種亞基、亞型和變異體,其復雜性非常巨大,而且還在不斷擴大。
發育過程中組蛋白修飾圖譜繪制落后于其他表觀遺傳標記,主要是因為組蛋白分析方法通常需要數千~數百萬個細胞,因此與可用胚胎細胞數量匹配。同時也已經開發出需要更少樣本的方法,例如low-input染色質免疫沉淀測序(ChIP-seq)、CUT&RUN和CUT&Tag,并已被用于生成第一個人類胚胎和其他物種的組蛋白修飾圖。
卵母細胞和早期胚胎中的經典和非經典組蛋白修飾模式
在哺乳動物卵母細胞和早期胚胎生長過程中,組蛋白標記沉積在時間和空間上受到高度調節。人類和其他哺乳動物的卵母細胞含有較大的非轉錄部分DNA甲基化結構域(PMDs)。在大多數哺乳動物物種中,卵母細胞中的PMD由H3K4me3標記。但在人類卵母細胞中,PMDs沒有被H3K4me3標記,相反卵母細胞在基因啟動子處具有H3K4me3強富集的狹窄區域的典型模式,精子中也存在類似的模式(圖2A)。受精后,2C和4C人類胚胎在卵母細胞遺傳的PMD中獲得中等水平的H3K4me3。這樣pre-EGA人類胚胎獲得了在這個發育期與小鼠胚胎更相似的一種整體H3K4me3模式。然而與小鼠相比,人類卵母細胞PMDs中H3K4me3增加是有限,因為這些區域的H3K4me3水平相對于啟動子中的H3K4me3水平較低,并且也僅限于富集基因的卵母細胞的PMD子集。此外一些啟動子獲得H3K4me3,與轉錄無關,但似乎反映了活性甲基轉移酶的靶向性,特別是對未甲基化的CpG富集區域。在小鼠中,H3K4甲基轉移酶KMT2B在啟動子和PMD上以不依賴轉錄的方式催化H3K4me3,并可能在pre-EGA人類胚胎發揮類似作用。
其他組蛋白修飾的式在物種間更為保守。在人類和其他物種的卵母細胞中,PMD具有廣泛的H3K27me3覆蓋率。雖然這種覆蓋率功能尚不確定,但小鼠卵母細胞和早期胚胎中較大的基因間H3K27me3修飾區域形成了自我互作結構域,據推測這些結構域可以劃分母本基因組以誘導抑制重復元件。H3K27me3也存在于人類卵母細胞、精子和早期胚胎中,位于與發育基因啟動子重疊的強富集典型位點。H3K9me3相對于其他胚胎期,在人類卵母細胞的基因密集區域富集,這可能提供了抑制卵母細胞轉錄的另一種機制。
到2C期,大多數精子遺傳的H3K27me3丟失,而卵母細胞特異性H3K27me3被短暫保留,然后在4C期去除。這些動態變化與受精后的牛和豬胚胎相似,但與小鼠胚胎不同,小鼠胚胎在囊胚期前保留了一些卵母細胞遺傳的H3K27me3。這些差異對小鼠依賴卵母細胞來源的H3K27me3維持過程具有重要意義。與受精后PMD中H3K27me3去除相一致,這些廣泛區域中的大多數基因在2C和4C胚胎中被H3K27ac標記,與H3K4me3重疊。鑒于這些結構域在卵母細胞中被H3K27me3修飾,H3K27ac很可能在受精后的PMDs中de novo 建立。需要在人卵母細胞對H3K27ac進行分析來證實這一假設。
特別重要的是這些表觀基因組變化是否調控EGA基因激活。可能調節EGA基因的增強子序列經歷重編程,從而導致H3K9me3丟失,并在4C期和8C期之間更易接近性,這與EGA基因被激活時間相對應。通過表達dCas9-KRAB誘導H3K9甲基轉移酶的位點特異性募集,從而在人類胚胎中實驗性強制H3K9me3的持久性,導致EGA基因不能完全激活和發育遲緩。這些實驗表明EGA基因調控區域需要重塑,以調控其在發育過程中的激活時間。另一種可能性是4C胚胎中廣泛的H3K4me3結構域有助于瞬時抑制EGA直到合適時間。這一觀點在小鼠和豬受精卵中H3K4me3去甲基化酶敲除的研究中得到支持,這導致EGA基因激活減少且未能發育到囊胚期。這表明及時解決這些大結構域是必需步驟。成功EGA可能需要將H3K27ac的廣泛結構域分解成narrow peaks,因為人類受精卵中組蛋白去乙酰化酶失活限制EGA基因子集轉錄誘導。總之,EGA前調控去除特定組蛋白修飾是確保發育進展的主要表觀遺傳事件。
Post-EGA表觀遺傳重構建立新的發育程序
從8C期到囊胚期人類胚胎發育涵蓋了廣泛的組蛋白修飾變化(圖2A)。這一時期的一個顯著特征是8C人類胚胎中幾乎不存在H3K27me3。這可能是由于缺乏母體提供的催化H3K27me3的polycomb蛋白,以及受精后不久H3K27me3(尤其是精子來源的H3K27me3)主動清除。在EGA之前,啟動子區H3K27me3的去除在物種間高度保守。
8 C期EGA顯著改變了表觀遺傳修飾因子豐度,每個修飾因子都有其對經典或非經典靶點偏好。因此,EGA(母系遺傳)前與EGA(基因組轉錄)后表觀遺傳修飾因子可用性差異重塑表觀基因組。例如,Polycomb組蛋白在EGA之后轉錄,并在發育基因附近沉積H3K27me3,在此過程中將大多數CpG富集調節區域分解為活性、二價或抑制染色質狀態(圖2A)。確認共修飾的二價核小體(H3K27me3和H3K4me3)需要進一步分析,如單核小體分析或ChIP分析。H3K27me3的另一個潛在功能是在EGA完成后幫助抑制啟動EGA基因。在囊胚中,H3K27me3存在于EGA基因啟動子處,表明其可能在影響EGA退出中發揮作用。已在牛胚胎中使用α-amanitin蛋白阻斷胚胎基因組轉錄,從而誘導polycomb組蛋白表達。處理后胚胎的染色質狀態保持在pre-EGA模式,表明轉錄和激活polycomb組蛋白表達是重組EGA后表觀遺傳圖譜所必需。H3K4me3水平在4C和8C期間也發生顯著變化,這與卵母細胞遺傳的PMDs中H3K4me3減少和許多基因啟動子中H3K4me3減少有關。這些變化伴隨著H3K4去甲基化酶KDM5B的轉錄誘導和H3K4甲基轉移酶KMT2B的下調,盡管這些蛋白在人類胚胎中的功能作用尚未驗證。
一個關鍵的問題是為什么胚胎在早期胚胎發生中經歷組蛋白標記重編程。有幾個潛在的原因:解決預先存在的染色質狀態,去除親本遺傳的表觀遺傳標記和表觀突變(epimutations),或支持發病和關閉EGA。無論是什么原因,一旦重置,新的染色質狀態將繼續建立,由CpG序列存在、染色質蛋白可用性以及與其他基因調控過程互作,從而導致順式調控區域的重新標記和發育程序出現。
組蛋白修飾對胚胎譜系分化的影響
組蛋白修飾是否以及如何影響植入前人類胚胎的譜系命運是重要的,尚未解決的問題。一些外胚層特異性和內胚層特異性基因在滋養外胚層細胞中被H3K27me3標記,盡管大多數滋養外胚層特異性基因在早期胚泡的ICM細胞中基本上沒有H3K27me3。這些不對稱模式可能會隨著胚胎的發育而加強譜系決定。在牛胚泡中也觀察到了某些譜系調節因子的交叉抑制模。事實上,干擾H3K27me3在人胚泡細胞和初始hPSC中的沉積會導致從外胚層樣狀態轉變為滋養外胚層樣狀態。
同樣的,可以拮抗某些轉錄因子與其靶序列結合的H3K9me3也可能有助于形成新的GRN。H3K9me3沉積中的細胞特異性差異可能通過限制早期滋養外胚層中的特定轉錄因子結合和激活可能促進ICM命運的基因來加強譜系障礙。為了進一步定義GRN,繪制H3K27ac和染色質可及性已經確定了8C和ICM細胞中假定的活性增強子(圖2A)。在這些增強子上富集的DNA序列包括那些與譜系限制性轉錄因子的目標motif匹配的序列。
總之,在早期人類胚胎發育過程中,組蛋白修飾在全基因組范圍內發生重大變化,且在EGA因子和發育基因調控的特定基因組表征上發生變化。關鍵的未解決問題包括:組蛋白修飾是否調控EGA基因的及時誘導和隨后的抑制?染色質修飾過程在賦予早期胚胎細胞與多譜系分化的持續能力相關的發育可塑性方面的確切作用是什么?在更多的胚胎期(包括植入后)對組蛋白修飾進行進一步分析,以及有針對性的表觀基因組工程和功能喪失方法,以檢測定義因子在胚胎和胚胎模型中的致病作用,將有助于克服其中一些知識空白。更廣泛地說,在其他情況下的研究已經證實,染色質的組蛋白狀態也決定了其他基本的細胞過程,包括DNA復制和DNA修復。更好地了解組蛋白修飾與早期人類胚胎發生中DNA復制/修復之間的關系是一個很有前景的研究方向。鑒于人類胚胎中非整倍體細胞的高發生率,這一點尤其重要。
DNA甲基化:保護基因組穩定性和發育基因表達
DNA甲基化是指在胞嘧啶中添加甲基以形成5-甲基胞嘧啶(5-methylcytosine, 5mC),其主要發生在CpG二核苷酸上。DNA甲基化模式由DNA甲基轉移酶DNMT3A和DNMT3B建立,并由DNMT1維持,非催化蛋白DNMT3L作為輔因子,在它們缺失的情況下,5mC通過被動去甲基化或通過TET羥化酶將5mC氧化成5-羥甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)的主動DNA去甲基化從基因組中去除。檢測胚胎發生過程中DNA甲基化的主要方法是用識別5mC的抗體進行免疫細胞化學和分析技術,包括簡化基因組甲基化測序(reduced representation bisulfite sequencing,RRBS),全基因組重亞硫酸鹽測序(whole-genome bisulfite sequencing,WGBS)和PBAT甲基化測序(post-bisulfite adapter tagging)。
胚胎植入前發育過程中DNA去甲基化和甲基化變化
DNA甲基化的重編程涉及在人類胚胎發育的植入前和植入后期去除和重建DNA甲基化模式(圖1)。這些事件對于重置遺傳親本甲基化至關重要,從而構建新的DNA甲基化譜。
整體DNA甲基化去除發生在植入前人類胚胎發育的幾個時期。受精后12小時內發生了一次主要的去甲基化,其中基因間區域(如增強子)以及基因體區域主要發生去甲基化。從受精卵后期到2C期,然后從8C到桑椹胚和胚泡期,進一步發生去甲基化。在這些階段,內含子和SINE元件尤其是年輕Alu亞家族的去甲基化很明顯。小鼠中有幾個因子與受精卵的快速去甲基化有關,最顯著的是TET3,小鼠胚胎分析顯示,去甲基化位點在5hmC中大量富集。TET3在人卵母細胞中也高表達;然而,介導去甲基化過程的機制以及不同機制是否在不同時期起作用仍有待在人類胚胎中進行實驗驗證。
幾項研究進一步確定了父源基因組和母源基因組之間去甲基化存在顯著差異。與小鼠類似,人類精子的甲基化水平高于卵母細胞,在胚胎植入前的所有時期,父源基因組經歷更快的去甲基化,而母源基因組在所有植入前階段都保持較高的殘留甲基化水平。除了不同的親本效應外,甲基化標記的基因組位點也存在差異,從而在受精卵的兩個親本基因組之間產生差異甲基化區域:父本高甲基化區域在基因間區域相對富集,而母本高甲基化區域在基因內區域富集,包括外顯子和內含子。這些母系遺傳的甲基化標記中的一些一直持續到胚泡期和胎盤中。除了幾個特定序列外,由于親本基因組之間的大多數DNA甲基化差異似乎不影響植入前階段的等位基因特異性基因表達,親本特異性甲基化的功能重要性仍不確定。
發育中的胚胎中的大多數常染色體基因都在兩個基因組中表達,但一組印跡基因表現出親本依賴性表達,其中一個拷貝被關閉。在這些印跡基因中,一個等位基因在配子發生過程中在其相應的初級印跡調控區(ICR)被DNA甲基化標記。為保護ICR免受去甲基化,在人類發育過程中保護ICR的蛋白質開始被發現,并且可能具有物種特異性。其他逃脫DNA去甲基化區域由一個年輕的LINE家族代表,特別是L1PA家族。這表明了一種保護機制,可以防止這些進化上年輕的轉座元件激活。
盡管在植入前發育過程中發生了甲基化丟失,但從4C期到8C期也發生了de novo DNA甲基化。新的甲基化區域在重復元件富集,例如SINE,LINEs和長末端重復序列(LTR)。且經歷de novo甲基化的區域通常在桑椹胚和囊胚期再次去甲基化,強調了甲基化變化的瞬時性和動態性。
DNA甲基化對植入后胚胎發育的影響
在人類囊胚中,ICM和滋養外胚層具有相似的DNA甲基化譜,表明滋養外胚層的初始誘導在很大程度上獨立于DNA甲基化。然而DNA甲基化如何影響人類胚胎的譜系成熟和植入后發育是關鍵問題。植入后人類胚胎的DNA甲基化組分析表明,相當大的DNA再甲基化發生在E7和E12之間。調節de novo甲基化機制已在小鼠中得到表征,但DNMT3A和DNMT3B的相對功能貢獻(兩者在植入后在人類胚胎中轉錄上調)仍有待在人類植入后發育中進行實驗驗證。人類胚胎的外胚層,滋養外胚層和內胚層在DNA de novo甲基化模式中具有顯著的變異性和不同步性。特別是植入后,植入后,與外胚層和滋養外胚層譜系的細胞相比,內胚層的DNA再甲基化速度較慢,并且在同一發育時期,內胚層的中位DNA甲基化水平約為外胚層的一半(33%:60%)。這表明盡管外胚層和內胚層細胞都起源于ICM,但它們具有不同的DNA再甲基化機制。也許這表明在這個特定的發育時期,相對于外胚層譜系,內胚層具有更大的發育可塑性。
三個譜系中的DNA再甲基化也發生在具有譜系特異性表征的特定基因組元件上。在植入后人類發育過程中,超過200個啟動子區域DNA甲基化。此外,E8的每個細胞譜系都具有特定的甲基化模式:外胚層相關基因的啟動子在滋養外胚層中被甲基化,但在外胚層和內胚層譜系中均未被甲基化。相比之下,滋養外胚層限制基因的啟動子在外胚層和內胚層譜系中被甲基化,內胚層相關基因啟動子在外胚層和滋養外胚層譜系中被甲基化。這些發現表明DNA甲基化一旦形成,可能有助于維持不同的譜系命運。
通過原腸胚形成和神經形成期培養食蟹猴胚胎的新方法,為研究植入后胚胎的表觀遺傳變化提供了機會。單細胞多組學分析結果表明,食蟹猴胚胎在每種鑒定的細胞類型中都會經歷特定的DNA甲基化模式。胚胎細胞的DNA甲基化水平明顯高于胚外細胞。這一發現與先前在小鼠和人類中的報道一致。重要的是,食蟹猴胚胎中的啟動子區域、LINEs、LTR區域和SINEs在食蟹猴胚胎中顯示出與在每種細胞類型中觀察到的總體DNA甲基化相似模式。然而,這些元件中的每一個都表現出不同程度的甲基化,這與小鼠的觀察結果一致。
總之,DNA甲基化在早期胚胎發生過程中是一個高度動態的過程,涉及一系列的去甲基化和de novo甲基化。關鍵的問題包括:植入后人類胚胎發育中DNA甲基化的譜系特異性變化、基因組特征和功能調節因子是什么?植入前和植入后的物種特異性DNA甲基化模式是什么,這些信息可以更全面地了解進化過程中保守的DNA甲基化模式?
人類發育表觀遺傳學的重要性
確保胚胎發生過程中忠實的表觀遺傳調控的重要性不僅體現上述實驗研究,而且還體現在表觀遺傳過程破壞的個體發育結果以及在某些人類胚胎模型和類器官中喪失表觀遺傳保真度中。
在模式生物中,許多表觀遺傳調節因子編碼基因的純合突變會導致早期發育失敗。據推測,人類類似功能喪失突變也會導致早期妊娠丟失。人類其他突變(通常為雜合突變或半合突變)通常與發育一致,但可引起多種先天性疾病,包括Rubinstein-Taybi綜合征(乙酰轉移酶CBP和p300編碼基因突變)、ICF綜合征(通常與DNA甲基轉移酶DNMT3B編碼基因突變相關)和Kabuki綜合征(影響組蛋白甲基轉移酶KMT2D遺傳變異)。
另一個重要特征是表觀基因組建立可以使早期人類胚胎特別容易受應激或表觀基因組改變過程中的變化影響。這種脆弱性與理解早期環境暴露的后果以及體外培養改變卵母細胞和植入前胚胎表觀基因組的潛力相關。鑒于輔助生殖技術的日益普及,目前的工作至關重要,以確定這些技術對發育表觀基因組的影響。
最后,必須強調的是,廣泛應用的體外細胞模型也可能發生異常表觀基因組變化。hPSCs基因組印記和XCI變化影響胚胎模型和這些細胞系源類器官的保真度。進一步的意義是,目前由初始hPSCs生成的大多數人類母細胞模型由于異常印記而存在“內在缺陷”。由于印記基因的忠實調控是哺乳動物發育所必需的,因此這一缺陷可能會限制人類母細胞持續發育的能力。未來的培養方法無疑將支持在初始hPSCs中維持正常印記,但在短期內,這一表觀遺傳異常對有關母細胞和其他胚胎模型的發育潛力和生存力的科學、倫理和政策討論具有影響。即使在hPSCs中大多數印記達到了完美的保真度,重要的是要注意,胎盤特異性DNA甲基化印記在包括hPSCs在內的表母細胞來源的細胞系中缺失。胎盤印記及其相關基因的錯誤調節會破壞hPSCs來源的滋養層細胞的誘導和生長,因此,這種內在的錯誤調節也可能影響hPSCs來源的胚外細胞類型的干細胞胚胎模型的保真度。
參考文獻:
Wilkinson AL, Zorzan I, Rugg-Gunn PJ. Epigenetic regulation of early human embryo development. Cell Stem Cell. 2023 Oct 12. pii: S1934-5909(23)00331-4. doi: 10.1016/j.stem.2023.09.010. PubMed PMID: 37858333.
背景(Introduction)
表觀基因組在胚胎發育的最初幾天會發生巨大變化。表觀基因組重置和建立在胚胎發生的更廣泛過程中進行協調和促進。因此需要表觀遺傳調控來保護發育并建立在整個生命過程中對基因組功能有影響的長期表觀遺傳狀態。
表觀遺傳信息通過告訴細胞它們的過去、現在和未來來促進胚胎發育。它提供了對所做決定和過去遇到情況的分子記憶,將早期事件作為化學標記整合到基因組中并穩定傳遞。這些標記也會預示未來事件,尤其是譜系分化決定,并由不同的表觀遺傳調節因子的調控下發揮廣泛作用,這些調節因子本身具有不同的功能并劃分不同的基因組元件。多種表觀遺傳通路(包括染色質重塑、組蛋白修飾和DNA甲基化)的協調調控著基因時空表達,并嚴格限制胚胎發生過程中重復元件的必要但潛在有害的活動。
受精后,高度特化的精子和卵母細胞的表觀基因組被重編程,以建立適合胚胎發育的全能性狀態。母系遺傳因素在受精后的前3天維持人類胚胎的分裂,然后在4細胞期(4C)到8細胞(8C)期發生胚胎基因組激活(embryonic genome activation,EGA)的主要波。經過EGA后,人類胚胎首先形成桑葚胚,然后形成具有明確內細胞團(ICM)的早期囊胚,植入囊胚有三種不同的細胞系:上胚層(epiblast,產生所有胎兒組織)、下胚層(hypoblast,形成卵黃囊)和滋養外胚層(trophectoderm,后來形成胎盤)。在接下來的一周內,胚胎形成額外的胚胎外譜系,外胚層開始按照原腸胚形成的預期進行定型,這在胚胎發生的第三周開始。
關于人類胚胎發生的許多知識來自于對組織學的集合研究。最近改進的方法使人類胚胎的體外培養和研究成為可能,直到大約胚胎第14天(E)。與此同時,由于人類胚胎研究存在重大技術和倫理挑戰,大量的體外系統旨在復制全部或部分早期人類胚胎。這些細胞包括反映原腸胚形成前期的細胞,包括8c樣細胞(8clc)、初始和啟動的人多能干細胞(hPSCs)和譜系限制性細胞系。其中一些細胞類型還提供了構建更復雜結構的基礎,如基于干細胞的整合模型(囊胚和植入后組裝體)和非整合模型,如原腸樣細胞。
本綜述討論了早期人類發育的表觀遺傳表征的新見解。這些研究對于理解表觀遺傳過程如何幫助調控和協調人類胚胎發生,以及表觀遺傳過程如何在這一時期與其他細胞和分子通路協調發生具有重要意義。對表觀遺傳過程的深入了解也將揭示表觀基因組對遺傳和環境變異的脆弱性。盡管重點是人類胚胎發育,但在相關條件下與其他物種的新數據以及基于干細胞的胚胎模型進行了比較。這些替代系統對于幫助建立發育過程中表觀遺傳過程的因果關系至關重要。此外還概述了當前的知識差距和關鍵的未決問題。
染色質重塑:打開胚胎基因組以塑造發育程序
在人類胚胎發生期間,染色質廣泛重塑以改變其可及性,最大變化與關鍵發育的重要階段重合(圖1)。染色質可及性可定義為DNA可用于因子(包括轉錄機制和表觀遺傳修飾因子)結合的程度,其中主要決定因素包括核小體密度和間距。這樣,染色質可及性代表了區域調控基因表達的潛力。

圖1:人類胚胎發育中的整體表觀基因組變化
酶的DNA可及性是用于定量染色質可及性的技術基礎。這些酶既可以切割可及DNA (DNase-seq和ATAC-seq),也可以甲基化可及胞嘧啶(NOMe-seq),這兩種酶都可以通過高通量測序進行檢測。將這些方法應用于微量(low-input)和單細胞(single-cell)應用,能夠對人類胚胎的染色質可及性進行分析。
這些研究的一致發現是,在2-細胞(2C)和囊胚期之間,人類胚胎基因組中已鑒定的可接近區域的數量逐漸增加(圖1)。不同研究中增加的程度有很大差異,可能是由于用于鑒定可接近染色質的實驗和計算方法不同。但總體趨勢一致。與可接近區域的數量相反,在增加到囊胚期之前,從受精卵到8C期的總染色質可及性(通過基于甲基化的基因組中可及胞嘧啶比例定量確定)短暫降低。這一模式可能表明人類受精卵具有全基因組開放的染色質狀態,這是切割方法無法檢測到的。總之,這些染色質可及性的動態變化支持基因調控網絡(GRNs)在早期發育過程中多次重塑,以建立新的發育程序。
受精卵的初始重塑定義pre-EGA染色質可及性
在整個人類胚胎發育過程中,可及性區域富集了啟動子、CpG島和遠端調控元件(如增強子),與卵母細胞相比,超過8000個啟動子在人類受精卵中獲得可及性,這些啟動子通常在植入前發育的整個過程中保持開放狀態。
鑒于胚胎基因組的主要轉錄直到EGA才發生,那么在8C期之前大量可及性染色質區域的功能是什么?一種可能性是這些染色質變化是親本基因組從配子狀態重塑到胚胎狀態的副作用。卵母細胞的染色質相對開放,而精子的染色質高度濃縮在人類胚胎中,受精后父源基因組的可及性迅速增加,達到高于母源基因組的水平。這種不對稱差異一直維持至4C期,此時母本和父本基因組的可及性在EGA中相等。
另一種可能性是在受精卵中獲得可及性區域支持次要EGA,即少量基因在主要pre-EGA轉錄。然而這并不能完全解釋在pre-EGA胚胎中存在數千個可及區域。第三種情況與發育基因調控相關。人類2C胚胎中的大多數可及啟動子也在8C期獲得,盡管這些啟動子轉錄不在2C期發生,但其中許多基因后來在8C期表達 (圖2A)。因此,這些可接近啟動子可能在2C期“蓄勢”以備以后的激活,這意味著pre-EGA染色質譜的建立可能對EGA主要基因子集的及時表達非常重要。這種pre-EGA啟動子形式已經在斑馬魚中報道過,在人類胚胎中,在pre-EGA獲得可及性區域在代謝和生物合成等功能上富集。單細胞方法表明,相同胚胎期的單個細胞之間總是可接近這些區域 (圖2B)。與在早期發育后期獲得可及性或以更異質性方式獲得可及性的基因相比,這種早期可及性獲得同質模式的基因在EGA后表達更高。因此,pre-EGA染色質可及性景觀也可能為重要的管家(housekeeping)基因提供高水平表達的基礎,從而為發育過程的發生提供基礎。

圖2:人類植入前胚胎發育中染色質可及性和組蛋白修飾的區域特異性動態變化
- 植入前胚胎發育過程中PMD、啟動子和遠端調控元件(包括增強子)的組蛋白修飾。
- 同一胚胎細胞在Pre-EGA和Post-EGA期的染色質可及性在管家基因中的變化,這些基因在Pre-EGA均勻可及,在Post-EGA表現出高表達;在發育基因中,這些基因在Pre-EGA不可及,在Post-EGA表現出不同水平的可及性和表達。
EGA的主要染色質可及性重塑
早期人類胚胎中染色質可及性的最大差異,特別是在啟動子上,區分了4C和早期與8C和后期。這個分離點與EGA一致,事實上,大多數在EGA轉錄上調的基因在4C和8C期之間變得可接近。
這種染色質譜的重塑在EGA中是否具有功能作用?單細胞中染色質可及性和轉錄組的聯合分析顯示,從2C到桑椹胚期的基因表達動態反映在其啟動子和假定的遠端調控區的可及性動態。這些關系的因果關系尚不清楚。許多啟動子在EGA處表現出其可及性區域擴大,這與轉錄增加一致。然而在經轉錄抑制劑α-amanitin處理的胚胎中,大多數啟動子的可及性區域都會擴大。這表明,至少對于啟動子來說,可及性增加主要先于基因表達增加。相反,可接近啟動子的轉錄非依賴性擴大可以通過重新定位核小體的整體過程來介導。相反,α-amanitin處理也導致8C胚胎具有類似于Pre-EGA胚胎的遠端調節元件可及性。這表明轉錄對于EGA染色質可及性的改變是必要的,至少在遠端元件是如此。總之,調控區域染色質可及性與基因表達相關;然而染色質可及性變化可能在不同的調控區環境中驅動或反映EGA結果。
染色質可及性變化與譜系特異性有關
從人類發育的桑葚胚期及其以后在其啟動子處獲得可及性的基因在發育過程中富集。這一可及性的增加先于第一次譜系決定,表明染色質可及性可能在細胞譜系分離過程中對GRN形成具有重要的功能。僅從轉錄組數據就可以推斷出GRN。然而,在GRN分析中納入染色質可及性數據可提高準確性,特別是對于人類胚胎數據等低樣本量的數據,并且可以預測增強子相關性。這些方法在人類囊胚譜系中鑒定出保守的GRN,由JUND和SOX4組成,它們共同調節TFAP2C表達,而TFAP2C又調控GCM1表達。這些結果強調了染色質可及性圖譜對于理解GRN在早期胚胎發育過程中如何變化的價值。
可能影響細胞命運決定的另一個重要特征是,染色質可及性(尤其是啟動子)的細胞間變化從桑葚胚期開始顯著增加(圖1)。啟動子可及性與這些區域的基因表達呈強相關,這意味著啟動子可及性變化可能驅動基因表達變化(圖2B)。同時,ICM調節因子(OCT4、KLF和SOX家族)和滋養細胞外胚層調節因子(GATA和TEAD家族)的motif區域富集。因此,胚胎內染色質可及性異質性可能提供了細胞命運決定的靈活性,或使細胞偏向于特定命運。
盡管人類胚胎中介導與譜系分離和變化相關的染色質可及性變化因子尚未鑒定,但有幾個很有前景的線索。這包括早期小鼠胚胎發育所需的核小體重塑復合物(SWI/SNF、CHD和ISWI) ,以及與初始hPSCs中的外胚層轉錄因子OCT4相關的核小體重塑SNF2家族亞基,以調節囊胚譜系基因。此外雖然在人類植入前發育的所有階段,可及性和DNA甲基化之間呈負相關,但在同一胚胎期細胞中,染色質可及性最可變區域是最一致的低甲基化區域。這表明低甲基化可能支持染色質可及性變化。這可能通過允許甲基化微小變化驅動核小體占位實質性變化,從而實現染色質可及性。或者低甲基化可能構成一種允許其他因子(包括轉錄因子)結合的狀態,而轉錄因子又根據可變的可利用性影響染色質可及性。通過這種方式,染色質重塑和DNA甲基化互作可能有助于人類早期發育的細胞可塑性。
對于大多數啟動子,post-EGA期可及性增加與該階段各自基因轉錄相關。然而其他基因顯示出更復雜的關系,可能意味著調控發育基因的不同機制。高達30%啟動子在8C或桑椹胚期可及,但在post-EGA植入前期沒有表達。這些啟動子可以在植入后期被激活。雖然這種可能性需要進一步研究,但一項相關發現是8CLC可及區域富集通常與原腸胚形成后譜系相關的轉錄因子motif。這些可及基因可能在早期表達,但在被其他過程沉默時保持其可及性。一個例子是EGA基因在桑葚胚期被沉默。
人類胚胎植入后的染色質可及性還有待研究。因此染色質可及性譜如何在植入后譜系中解決仍然未知。然而染色質可及性已在食蟹猴胚胎植入后發育中進行了研究。該研究結果表明,染色質可及性在原始條索狀細胞中達到峰值,之后在分化較強的胚層譜系中下降(圖1)。這在人類胚胎中是否保守具有重要意義。為此研究者在基于干細胞植入后人類發育模型中共同研究了染色質可及性和轉錄組數據進行聯合分析,以研究這一人類模型對靈長類胚胎是否顯示出類似的染色質可及性動態變化,以及植入后的譜系命運是否可能在發育早期就已確定。
總之染色質重塑改變了早期人類胚胎發育的多個時期可及性圖譜,并涉及從胚胎轉錄激活到未來基因表達鑒定等廣泛過程。關鍵問題包括:啟動子狀態是否持續至植入后階段?染色質可及性變化是否指導細胞命運決定,這種變化的誘導因子?人類胚胎發育背景下可及性區域廣度如何影響區域調控潛力?轉錄因子、核小體重塑因子和轉錄本身可能部分導致染色質可及性變化。然而染色質重塑發生在更廣泛的表觀遺傳重編程背景下,因此DNA甲基化和組蛋白修飾變化也可能有助于染色質重塑的最終功能結局。
組蛋白修飾:基因組激活和發育基因的動態調控因子
與染色質可及性相似,組蛋白修飾在發育過程中也高度動態(圖1)。組蛋白修飾變化普遍存在,發生在不同的發育時期和不同類型的基因組區域之間。組蛋白修飾具有組合作用,大致可分為兩類:(1)促進性染色質相關修飾,如啟動子上的H3K4me3,增強子和其他基因間區域的H3K4me1,以及活性增強子和啟動子上的H3K27ac;(2)抑制性染色質相關修飾,如H3K27me3和H3K9me3。每一種修飾又會招募下游效應因子,進而介導對基因組功能和活性的進一步影響。可以識別或調節組蛋白的系統具有多種亞基、亞型和變異體,其復雜性非常巨大,而且還在不斷擴大。
發育過程中組蛋白修飾圖譜繪制落后于其他表觀遺傳標記,主要是因為組蛋白分析方法通常需要數千~數百萬個細胞,因此與可用胚胎細胞數量匹配。同時也已經開發出需要更少樣本的方法,例如low-input染色質免疫沉淀測序(ChIP-seq)、CUT&RUN和CUT&Tag,并已被用于生成第一個人類胚胎和其他物種的組蛋白修飾圖。
卵母細胞和早期胚胎中的經典和非經典組蛋白修飾模式
在哺乳動物卵母細胞和早期胚胎生長過程中,組蛋白標記沉積在時間和空間上受到高度調節。人類和其他哺乳動物的卵母細胞含有較大的非轉錄部分DNA甲基化結構域(PMDs)。在大多數哺乳動物物種中,卵母細胞中的PMD由H3K4me3標記。但在人類卵母細胞中,PMDs沒有被H3K4me3標記,相反卵母細胞在基因啟動子處具有H3K4me3強富集的狹窄區域的典型模式,精子中也存在類似的模式(圖2A)。受精后,2C和4C人類胚胎在卵母細胞遺傳的PMD中獲得中等水平的H3K4me3。這樣pre-EGA人類胚胎獲得了在這個發育期與小鼠胚胎更相似的一種整體H3K4me3模式。然而與小鼠相比,人類卵母細胞PMDs中H3K4me3增加是有限,因為這些區域的H3K4me3水平相對于啟動子中的H3K4me3水平較低,并且也僅限于富集基因的卵母細胞的PMD子集。此外一些啟動子獲得H3K4me3,與轉錄無關,但似乎反映了活性甲基轉移酶的靶向性,特別是對未甲基化的CpG富集區域。在小鼠中,H3K4甲基轉移酶KMT2B在啟動子和PMD上以不依賴轉錄的方式催化H3K4me3,并可能在pre-EGA人類胚胎發揮類似作用。
其他組蛋白修飾的式在物種間更為保守。在人類和其他物種的卵母細胞中,PMD具有廣泛的H3K27me3覆蓋率。雖然這種覆蓋率功能尚不確定,但小鼠卵母細胞和早期胚胎中較大的基因間H3K27me3修飾區域形成了自我互作結構域,據推測這些結構域可以劃分母本基因組以誘導抑制重復元件。H3K27me3也存在于人類卵母細胞、精子和早期胚胎中,位于與發育基因啟動子重疊的強富集典型位點。H3K9me3相對于其他胚胎期,在人類卵母細胞的基因密集區域富集,這可能提供了抑制卵母細胞轉錄的另一種機制。
到2C期,大多數精子遺傳的H3K27me3丟失,而卵母細胞特異性H3K27me3被短暫保留,然后在4C期去除。這些動態變化與受精后的牛和豬胚胎相似,但與小鼠胚胎不同,小鼠胚胎在囊胚期前保留了一些卵母細胞遺傳的H3K27me3。這些差異對小鼠依賴卵母細胞來源的H3K27me3維持過程具有重要意義。與受精后PMD中H3K27me3去除相一致,這些廣泛區域中的大多數基因在2C和4C胚胎中被H3K27ac標記,與H3K4me3重疊。鑒于這些結構域在卵母細胞中被H3K27me3修飾,H3K27ac很可能在受精后的PMDs中de novo 建立。需要在人卵母細胞對H3K27ac進行分析來證實這一假設。
特別重要的是這些表觀基因組變化是否調控EGA基因激活。可能調節EGA基因的增強子序列經歷重編程,從而導致H3K9me3丟失,并在4C期和8C期之間更易接近性,這與EGA基因被激活時間相對應。通過表達dCas9-KRAB誘導H3K9甲基轉移酶的位點特異性募集,從而在人類胚胎中實驗性強制H3K9me3的持久性,導致EGA基因不能完全激活和發育遲緩。這些實驗表明EGA基因調控區域需要重塑,以調控其在發育過程中的激活時間。另一種可能性是4C胚胎中廣泛的H3K4me3結構域有助于瞬時抑制EGA直到合適時間。這一觀點在小鼠和豬受精卵中H3K4me3去甲基化酶敲除的研究中得到支持,這導致EGA基因激活減少且未能發育到囊胚期。這表明及時解決這些大結構域是必需步驟。成功EGA可能需要將H3K27ac的廣泛結構域分解成narrow peaks,因為人類受精卵中組蛋白去乙酰化酶失活限制EGA基因子集轉錄誘導。總之,EGA前調控去除特定組蛋白修飾是確保發育進展的主要表觀遺傳事件。
Post-EGA表觀遺傳重構建立新的發育程序
從8C期到囊胚期人類胚胎發育涵蓋了廣泛的組蛋白修飾變化(圖2A)。這一時期的一個顯著特征是8C人類胚胎中幾乎不存在H3K27me3。這可能是由于缺乏母體提供的催化H3K27me3的polycomb蛋白,以及受精后不久H3K27me3(尤其是精子來源的H3K27me3)主動清除。在EGA之前,啟動子區H3K27me3的去除在物種間高度保守。
8 C期EGA顯著改變了表觀遺傳修飾因子豐度,每個修飾因子都有其對經典或非經典靶點偏好。因此,EGA(母系遺傳)前與EGA(基因組轉錄)后表觀遺傳修飾因子可用性差異重塑表觀基因組。例如,Polycomb組蛋白在EGA之后轉錄,并在發育基因附近沉積H3K27me3,在此過程中將大多數CpG富集調節區域分解為活性、二價或抑制染色質狀態(圖2A)。確認共修飾的二價核小體(H3K27me3和H3K4me3)需要進一步分析,如單核小體分析或ChIP分析。H3K27me3的另一個潛在功能是在EGA完成后幫助抑制啟動EGA基因。在囊胚中,H3K27me3存在于EGA基因啟動子處,表明其可能在影響EGA退出中發揮作用。已在牛胚胎中使用α-amanitin蛋白阻斷胚胎基因組轉錄,從而誘導polycomb組蛋白表達。處理后胚胎的染色質狀態保持在pre-EGA模式,表明轉錄和激活polycomb組蛋白表達是重組EGA后表觀遺傳圖譜所必需。H3K4me3水平在4C和8C期間也發生顯著變化,這與卵母細胞遺傳的PMDs中H3K4me3減少和許多基因啟動子中H3K4me3減少有關。這些變化伴隨著H3K4去甲基化酶KDM5B的轉錄誘導和H3K4甲基轉移酶KMT2B的下調,盡管這些蛋白在人類胚胎中的功能作用尚未驗證。
一個關鍵的問題是為什么胚胎在早期胚胎發生中經歷組蛋白標記重編程。有幾個潛在的原因:解決預先存在的染色質狀態,去除親本遺傳的表觀遺傳標記和表觀突變(epimutations),或支持發病和關閉EGA。無論是什么原因,一旦重置,新的染色質狀態將繼續建立,由CpG序列存在、染色質蛋白可用性以及與其他基因調控過程互作,從而導致順式調控區域的重新標記和發育程序出現。
組蛋白修飾對胚胎譜系分化的影響
組蛋白修飾是否以及如何影響植入前人類胚胎的譜系命運是重要的,尚未解決的問題。一些外胚層特異性和內胚層特異性基因在滋養外胚層細胞中被H3K27me3標記,盡管大多數滋養外胚層特異性基因在早期胚泡的ICM細胞中基本上沒有H3K27me3。這些不對稱模式可能會隨著胚胎的發育而加強譜系決定。在牛胚泡中也觀察到了某些譜系調節因子的交叉抑制模。事實上,干擾H3K27me3在人胚泡細胞和初始hPSC中的沉積會導致從外胚層樣狀態轉變為滋養外胚層樣狀態。
同樣的,可以拮抗某些轉錄因子與其靶序列結合的H3K9me3也可能有助于形成新的GRN。H3K9me3沉積中的細胞特異性差異可能通過限制早期滋養外胚層中的特定轉錄因子結合和激活可能促進ICM命運的基因來加強譜系障礙。為了進一步定義GRN,繪制H3K27ac和染色質可及性已經確定了8C和ICM細胞中假定的活性增強子(圖2A)。在這些增強子上富集的DNA序列包括那些與譜系限制性轉錄因子的目標motif匹配的序列。
總之,在早期人類胚胎發育過程中,組蛋白修飾在全基因組范圍內發生重大變化,且在EGA因子和發育基因調控的特定基因組表征上發生變化。關鍵的未解決問題包括:組蛋白修飾是否調控EGA基因的及時誘導和隨后的抑制?染色質修飾過程在賦予早期胚胎細胞與多譜系分化的持續能力相關的發育可塑性方面的確切作用是什么?在更多的胚胎期(包括植入后)對組蛋白修飾進行進一步分析,以及有針對性的表觀基因組工程和功能喪失方法,以檢測定義因子在胚胎和胚胎模型中的致病作用,將有助于克服其中一些知識空白。更廣泛地說,在其他情況下的研究已經證實,染色質的組蛋白狀態也決定了其他基本的細胞過程,包括DNA復制和DNA修復。更好地了解組蛋白修飾與早期人類胚胎發生中DNA復制/修復之間的關系是一個很有前景的研究方向。鑒于人類胚胎中非整倍體細胞的高發生率,這一點尤其重要。
DNA甲基化:保護基因組穩定性和發育基因表達
DNA甲基化是指在胞嘧啶中添加甲基以形成5-甲基胞嘧啶(5-methylcytosine, 5mC),其主要發生在CpG二核苷酸上。DNA甲基化模式由DNA甲基轉移酶DNMT3A和DNMT3B建立,并由DNMT1維持,非催化蛋白DNMT3L作為輔因子,在它們缺失的情況下,5mC通過被動去甲基化或通過TET羥化酶將5mC氧化成5-羥甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)的主動DNA去甲基化從基因組中去除。檢測胚胎發生過程中DNA甲基化的主要方法是用識別5mC的抗體進行免疫細胞化學和分析技術,包括簡化基因組甲基化測序(reduced representation bisulfite sequencing,RRBS),全基因組重亞硫酸鹽測序(whole-genome bisulfite sequencing,WGBS)和PBAT甲基化測序(post-bisulfite adapter tagging)。
胚胎植入前發育過程中DNA去甲基化和甲基化變化
DNA甲基化的重編程涉及在人類胚胎發育的植入前和植入后期去除和重建DNA甲基化模式(圖1)。這些事件對于重置遺傳親本甲基化至關重要,從而構建新的DNA甲基化譜。
整體DNA甲基化去除發生在植入前人類胚胎發育的幾個時期。受精后12小時內發生了一次主要的去甲基化,其中基因間區域(如增強子)以及基因體區域主要發生去甲基化。從受精卵后期到2C期,然后從8C到桑椹胚和胚泡期,進一步發生去甲基化。在這些階段,內含子和SINE元件尤其是年輕Alu亞家族的去甲基化很明顯。小鼠中有幾個因子與受精卵的快速去甲基化有關,最顯著的是TET3,小鼠胚胎分析顯示,去甲基化位點在5hmC中大量富集。TET3在人卵母細胞中也高表達;然而,介導去甲基化過程的機制以及不同機制是否在不同時期起作用仍有待在人類胚胎中進行實驗驗證。
幾項研究進一步確定了父源基因組和母源基因組之間去甲基化存在顯著差異。與小鼠類似,人類精子的甲基化水平高于卵母細胞,在胚胎植入前的所有時期,父源基因組經歷更快的去甲基化,而母源基因組在所有植入前階段都保持較高的殘留甲基化水平。除了不同的親本效應外,甲基化標記的基因組位點也存在差異,從而在受精卵的兩個親本基因組之間產生差異甲基化區域:父本高甲基化區域在基因間區域相對富集,而母本高甲基化區域在基因內區域富集,包括外顯子和內含子。這些母系遺傳的甲基化標記中的一些一直持續到胚泡期和胎盤中。除了幾個特定序列外,由于親本基因組之間的大多數DNA甲基化差異似乎不影響植入前階段的等位基因特異性基因表達,親本特異性甲基化的功能重要性仍不確定。
發育中的胚胎中的大多數常染色體基因都在兩個基因組中表達,但一組印跡基因表現出親本依賴性表達,其中一個拷貝被關閉。在這些印跡基因中,一個等位基因在配子發生過程中在其相應的初級印跡調控區(ICR)被DNA甲基化標記。為保護ICR免受去甲基化,在人類發育過程中保護ICR的蛋白質開始被發現,并且可能具有物種特異性。其他逃脫DNA去甲基化區域由一個年輕的LINE家族代表,特別是L1PA家族。這表明了一種保護機制,可以防止這些進化上年輕的轉座元件激活。
盡管在植入前發育過程中發生了甲基化丟失,但從4C期到8C期也發生了de novo DNA甲基化。新的甲基化區域在重復元件富集,例如SINE,LINEs和長末端重復序列(LTR)。且經歷de novo甲基化的區域通常在桑椹胚和囊胚期再次去甲基化,強調了甲基化變化的瞬時性和動態性。
DNA甲基化對植入后胚胎發育的影響
在人類囊胚中,ICM和滋養外胚層具有相似的DNA甲基化譜,表明滋養外胚層的初始誘導在很大程度上獨立于DNA甲基化。然而DNA甲基化如何影響人類胚胎的譜系成熟和植入后發育是關鍵問題。植入后人類胚胎的DNA甲基化組分析表明,相當大的DNA再甲基化發生在E7和E12之間。調節de novo甲基化機制已在小鼠中得到表征,但DNMT3A和DNMT3B的相對功能貢獻(兩者在植入后在人類胚胎中轉錄上調)仍有待在人類植入后發育中進行實驗驗證。人類胚胎的外胚層,滋養外胚層和內胚層在DNA de novo甲基化模式中具有顯著的變異性和不同步性。特別是植入后,植入后,與外胚層和滋養外胚層譜系的細胞相比,內胚層的DNA再甲基化速度較慢,并且在同一發育時期,內胚層的中位DNA甲基化水平約為外胚層的一半(33%:60%)。這表明盡管外胚層和內胚層細胞都起源于ICM,但它們具有不同的DNA再甲基化機制。也許這表明在這個特定的發育時期,相對于外胚層譜系,內胚層具有更大的發育可塑性。
三個譜系中的DNA再甲基化也發生在具有譜系特異性表征的特定基因組元件上。在植入后人類發育過程中,超過200個啟動子區域DNA甲基化。此外,E8的每個細胞譜系都具有特定的甲基化模式:外胚層相關基因的啟動子在滋養外胚層中被甲基化,但在外胚層和內胚層譜系中均未被甲基化。相比之下,滋養外胚層限制基因的啟動子在外胚層和內胚層譜系中被甲基化,內胚層相關基因啟動子在外胚層和滋養外胚層譜系中被甲基化。這些發現表明DNA甲基化一旦形成,可能有助于維持不同的譜系命運。
通過原腸胚形成和神經形成期培養食蟹猴胚胎的新方法,為研究植入后胚胎的表觀遺傳變化提供了機會。單細胞多組學分析結果表明,食蟹猴胚胎在每種鑒定的細胞類型中都會經歷特定的DNA甲基化模式。胚胎細胞的DNA甲基化水平明顯高于胚外細胞。這一發現與先前在小鼠和人類中的報道一致。重要的是,食蟹猴胚胎中的啟動子區域、LINEs、LTR區域和SINEs在食蟹猴胚胎中顯示出與在每種細胞類型中觀察到的總體DNA甲基化相似模式。然而,這些元件中的每一個都表現出不同程度的甲基化,這與小鼠的觀察結果一致。
總之,DNA甲基化在早期胚胎發生過程中是一個高度動態的過程,涉及一系列的去甲基化和de novo甲基化。關鍵的問題包括:植入后人類胚胎發育中DNA甲基化的譜系特異性變化、基因組特征和功能調節因子是什么?植入前和植入后的物種特異性DNA甲基化模式是什么,這些信息可以更全面地了解進化過程中保守的DNA甲基化模式?
人類發育表觀遺傳學的重要性
確保胚胎發生過程中忠實的表觀遺傳調控的重要性不僅體現上述實驗研究,而且還體現在表觀遺傳過程破壞的個體發育結果以及在某些人類胚胎模型和類器官中喪失表觀遺傳保真度中。
在模式生物中,許多表觀遺傳調節因子編碼基因的純合突變會導致早期發育失敗。據推測,人類類似功能喪失突變也會導致早期妊娠丟失。人類其他突變(通常為雜合突變或半合突變)通常與發育一致,但可引起多種先天性疾病,包括Rubinstein-Taybi綜合征(乙酰轉移酶CBP和p300編碼基因突變)、ICF綜合征(通常與DNA甲基轉移酶DNMT3B編碼基因突變相關)和Kabuki綜合征(影響組蛋白甲基轉移酶KMT2D遺傳變異)。
另一個重要特征是表觀基因組建立可以使早期人類胚胎特別容易受應激或表觀基因組改變過程中的變化影響。這種脆弱性與理解早期環境暴露的后果以及體外培養改變卵母細胞和植入前胚胎表觀基因組的潛力相關。鑒于輔助生殖技術的日益普及,目前的工作至關重要,以確定這些技術對發育表觀基因組的影響。
最后,必須強調的是,廣泛應用的體外細胞模型也可能發生異常表觀基因組變化。hPSCs基因組印記和XCI變化影響胚胎模型和這些細胞系源類器官的保真度。進一步的意義是,目前由初始hPSCs生成的大多數人類母細胞模型由于異常印記而存在“內在缺陷”。由于印記基因的忠實調控是哺乳動物發育所必需的,因此這一缺陷可能會限制人類母細胞持續發育的能力。未來的培養方法無疑將支持在初始hPSCs中維持正常印記,但在短期內,這一表觀遺傳異常對有關母細胞和其他胚胎模型的發育潛力和生存力的科學、倫理和政策討論具有影響。即使在hPSCs中大多數印記達到了完美的保真度,重要的是要注意,胎盤特異性DNA甲基化印記在包括hPSCs在內的表母細胞來源的細胞系中缺失。胎盤印記及其相關基因的錯誤調節會破壞hPSCs來源的滋養層細胞的誘導和生長,因此,這種內在的錯誤調節也可能影響hPSCs來源的胚外細胞類型的干細胞胚胎模型的保真度。

圖3:圍繞人類胚胎發育的表觀遺傳調控的開放性問題以及解決這些問題的潛在解決方案
參考文獻:
Wilkinson AL, Zorzan I, Rugg-Gunn PJ. Epigenetic regulation of early human embryo development. Cell Stem Cell. 2023 Oct 12. pii: S1934-5909(23)00331-4. doi: 10.1016/j.stem.2023.09.010. PubMed PMID: 37858333.
標簽:
DNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





