非靶標代謝組+脂質組學在乳腺癌亞型新解析中的應用助力乳腺癌治療
文章題目:Molecular classification of hormone receptor-positive HER2-negative breast cancer
發表期刊:nature genetics
影響因子:30.8
百趣提供的產品服務:非靶標代謝組+脂質組學
研究背景
乳腺癌是世界上最常見的女性癌癥,分為不同的亞型。目前主要根據腫瘤的激素受體(hormone receptor, HR)和人表皮生長因子受體-2(Human Epidermal GrowthFactor Receptor 2, HER2)的狀態進行治療。其中HR陽性/HER2陰性(HR+/HER2-)乳腺癌是最常見的類型,占所有乳腺癌的三分之二。研究表明,使用靶向療法,可以有效改善HR+/HER2-乳腺癌。但靶向藥物和不同生物標志物的生物學相關性仍然不確定。
對乳腺腫瘤的分子特征挖掘能夠促進臨床治療策略的改善。在臨床試驗中,也進一步驗證了基于乳腺癌亞型的靶向治療的好處。目前,HR+/HER2-乳腺癌的臨床實踐中已使用了幾種分子模型,但是現有的臨床分期系統或預后模型不能準確反映生物學行為。為了解決這個問題,作者采用DNA和RNA測序,結合代謝組學和蛋白質組學,專注于開發一種反映HR+/HER2-乳腺癌異質性的生物學特征。此外,作者還通過深度學習開發了卷積神經網絡(convolutional neural network, CNN)模型,幫助從病理全圖像中推斷出乳腺癌亞型。
技術路線
為了進行多組學亞型分析,作者建立了包含579名患者的中國HR+/HER2−乳腺癌大規模多組學隊列。隨后,研究了每種亞型的分子特征,并確定了每種亞型特有的治療方法。同時還設計了一種基于人工智能的臨床適用方法來推斷每種亞型(圖1)。

圖1 研究的簡要概述
通過不同維度,使用相似性網絡融合(Similarity Network Fusion, SNF)(將多組學數據整合起來,優化可視化結果的一種方法,是一種確定癌癥亞型的有效聚類方法)對351名具有重疊數據集的患者進行多組學聚類(圖1),數據表明SNF聚類分析的最佳聚類數為4,即SNF1-4(經典腔面型SNF1, 免疫調節型SNF2, 增值型SNF3, RTK驅動型SNF4)(圖2)。
SNF1和SNF3腫瘤幾乎完全由PAM50 luminal A/PAM50 luminal B亞型組成。SNF1 中超過一半(51%)的腫瘤具有PIK3CA突變,而較少(11%)的腫瘤具有TP53突變(圖2 a)。SNF3腫瘤則表現出更高的CCND1、FGFR1和MDM2拷貝數增益頻率以及更多的細胞周期通路激活(圖2 a、b)。在SNF3腫瘤中也觀察到同源重組修回缺陷(homologous recombination deficiency, HRD),表明基因組的高度不穩定性(圖2 a)。
SNF2和SNF4腫瘤含有較少的PAM50 luminal A/PAM50 luminal B亞型和較少的激素受體途徑激活(圖2 b)。SNF2 顯示出豐富的適應性免疫反應途徑(圖2 b)。對于SNF4腫瘤,與受體蛋白激酶和細胞外基質結構成分相關的表達特征高度豐富(圖2 b)。

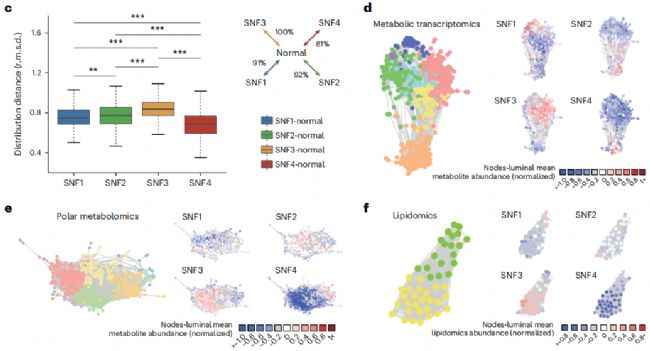
圖2 HR+ /HER2− 乳腺癌的綜合分析
2 HR+ /HER2− 乳腺癌的代謝組學分析
作者應用歐式距離來分析SNF亞型及其相應正常組織內代謝表達的整體差異。發現SNF3亞型相比其他亞型代謝失調程度最高,而SNF4是代謝失調程度最低的亞型(圖2 c)。這也進一步確定不同亞型腫瘤內的代謝組學特征。
隨后通過構建網絡模型來探索不同亞型腫瘤中的差異代謝基因、極性代謝物和脂質,并說明不同亞型之間的代謝特征(圖2 d-f)。結果顯示大多數失調通路在SNF3亞型中上調,但在SNF4亞型中下調。此外,SNF1和SNF2亞型以磷脂代謝為特征,并鑒定出參與磷脂合成的基因(例如PIP5K1A15和PIK3CG16)的高表達。
3 四種SNF 亞型的獨特臨床特征
作者進一步分析了臨床病理特征(圖3 a–d)。通過免疫組織化學(immunohistochemistry, IHC)染色測量,SNF3腫瘤具有較高的Ki67指數(在臨床應用中,反映Ki-67核蛋白表達水平的指標稱為Ki-67指數。Ki-67指數是指所有腫瘤細胞中免疫組織化學核染陽性的百分率。)和腫瘤分級,而SNF2腫瘤具有較低的ER表達(圖3 a–c)。SNF亞型之間的HER2狀態沒有顯著差異(圖3 d)。另外,SNF4的無轉移生存率(P = 0.0021)和無復發生存率(P = 0.00093)相比于其他三種亞型較差(圖3 e)。特別是對于PAM50 luminal A的患者,SNF4的預后遠不如其他亞型(圖3 f)。單變量和多變量Cox(proportional hazards model)分析的應用明確證實了SNF4亞型是一個獨立的預后指標(圖3 g)。總之,作者將HR+/HER2腫瘤重新分類為四種亞型,每種亞型都具有不同的臨床病理和多組學特征。
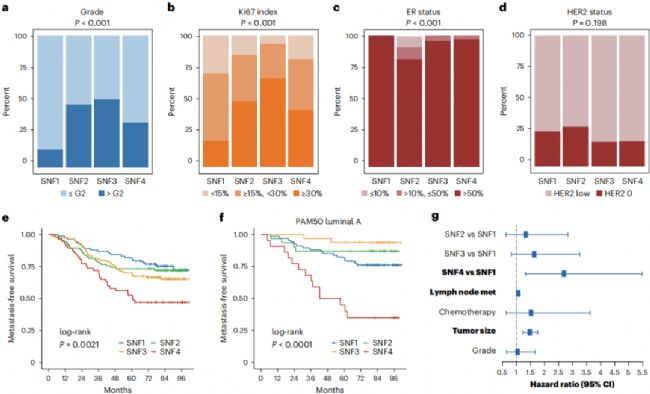

圖3 四種SNF亞型的獨特臨床特征和病理模式
4 臨床適用的SNF亞型分類方法
為了系統的推斷亞型分類,作者使用了兩種分類器,一種基于數字病理學數據,另一種基于轉錄組學數據。
對于基于數字病理學的方法,作者使用了243名患者的全切片圖像以及多組學SNF亞型結果,采用基于深度學習的流程來開發CNN模型來識別四種亞型中的每一種。結果顯示,ROC曲線下方的面積大小(Area Under Curve, AUC)SNF1亞型為0.87,SNF2亞型為0.81,SNF3亞型為0.78,SNF4亞型為0.78(圖3 h)。基于我們開發的模型,指示每種SNF亞型的圖塊的形態特征可總結如下(圖3 i):SNF1部分保留正常乳腺的形態;SNF2高免疫細胞浸潤;SNF3高豐度的非典型腫瘤細胞;SNF4腫瘤細胞簇與周圍成纖維細胞的富集。總體而言,這些結果揭示了 SNF 亞型之間病理模式的差異,并表明基于數字病理學區分SNF亞型的可行性。
對于基于轉錄組學數據的方法,作者根據每個SNF亞型高表達基因的數據開發了一個隨機森林分類器(圖4 a)。在數字病理學模型的開發中使用了相同的交叉驗證隊列。結果顯示:SNF1亞型的AUC為0.95,SNF2亞型為0.93,SNF3亞型為0.85,SNF4亞型為 0.82(圖4 b),高于CNN模型。
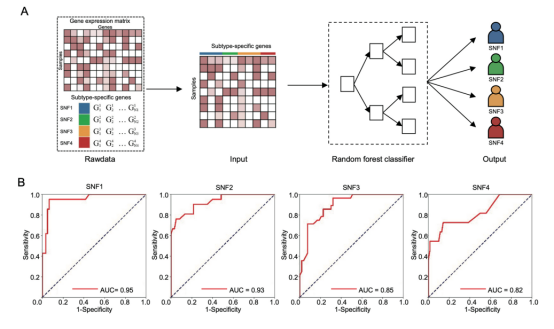
圖4 基于轉錄組學數據的SNF亞型預測
5 SNF3 亞型細胞周期途徑的上調
通過基因組分析,作者發現SNF3樣本中某些細胞周期基因的拷貝數變異(copy number alteration, CAN)頻率整體增加(圖5 a)。然后分析這些CNA與RNA或蛋白質表達之間的關聯。觀察到CCND1等癌基因的RNA和蛋白質表達大幅增加,而RB1等腫瘤抑制基因的表達減少(圖5 b),表明SNF3基因組改變驅動細胞周期信號順式激活(圖5 c)。
通過G2/M的兩種調節因子,也觀察到SNF3中細胞周期信號傳導的順式調節(cis-regulation)(圖5 e)。此外,HRD和染色體不穩定性(chromosome instability, CIN)評分(圖5 f、g)在SNF3腫瘤中更高。由于高HRD評分與對DNA修復酶抑制劑(poly ADP-ribose polymerase, PARP)的敏感性相關,作者觀察到來自SNF3腫瘤的患者的類器官的生長被單一藥物抑制,并被阿貝昔單抗和奧拉帕尼的組合進一步抑制(圖5 h)。這些結果表明,SNF3亞型富集用于激活G1/S和G2/M細胞周期進程。
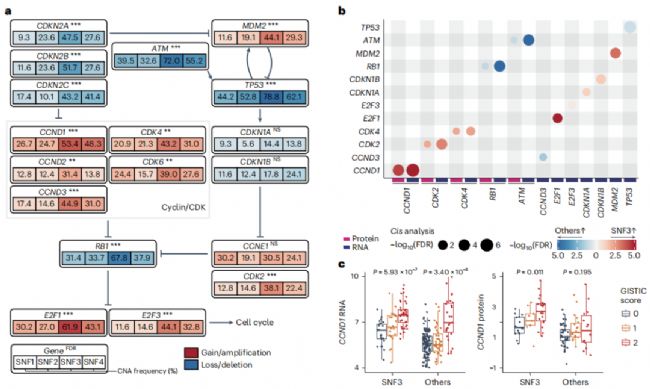
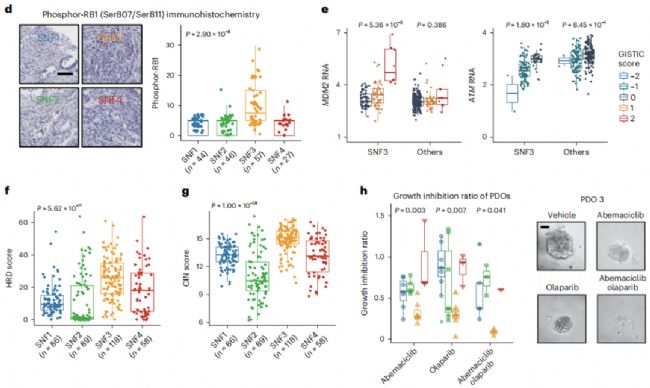
圖5 蛋白質組學分析揭示細胞周期信號傳導是 SNF3 亞型的靶標
6 HR+ /HER2− 乳腺癌的微環境景觀
腫瘤微環境(The tumor microenvironment, TME)參與腫瘤的發展。因此,作者對四種SNF亞型的微環境特征進行了綜合分析。通過使用CIBERSORT(利用線性支持向量回歸的原理對免疫細胞亞型的表達矩陣進行去卷積,來估計免疫細胞的豐度)和微環境細胞群計數器的單樣本基因富集分析(Gene Set EnrichmentAnalysis, GSEA)評估,SNF2腫瘤中免疫細胞群的豐度顯著增加,特別是適應性免疫系統的細胞(圖6 a)。
隨后通過scRNA-seq進一步分析了SNF2和SNF4腫瘤的TME特征。總共分析了來自9個腫瘤的69,479個細胞,并鑒定了11個不同的簇(圖6 b)。觀察到 SNF2 樣本中 CD8+T細胞的比例較高(圖6 c),而SNF4樣本中癌癥相關成纖維細胞(cancer associated fibroblast, CAF)的比例較高(圖6 d),這驗證了批量 RNA-seq 數據的反卷積結果。
另外還發現,在接受抗程序性死亡配體1(PD-L1)抑制劑治療的手臂中,大多數SNF2樣本(93%)實現了病理學完全緩解(圖6 i)。總體而言,全面剖析了SNF亞型之間的TME異質性,并表明SNF2腫瘤以免疫激活狀態為特征,可能支持對這些腫瘤使用免疫檢查點阻斷。

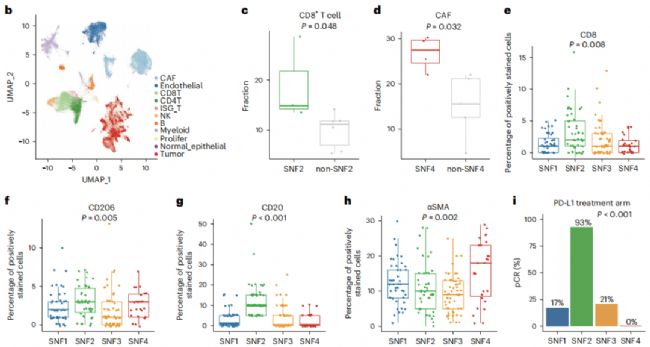
圖6 HR+/HER2−乳腺癌的微環境景觀
7 SNF4 亞型衍生的 CAF 增強腫瘤生長
通過RNA-seq、scRNA-seq和磷酸化蛋白質組學的綜合分析,作者觀察到兩種SNF4高表達的RTK主要在CAF中表達并且高度磷酸化(圖7 a)。通過蛋白質印跡,驗證了PDGFRA和EGFR在SNF4腫瘤樣本中高表達和高磷酸化,特別是在SNF4衍生的CAF中(圖7 b、c)。
此外,作者還觀察到來自SNF4衍生的CAF的條件培養基可以促進SNF1和SNF4衍生的癌細胞的增殖(圖7 e),表明CAF豐度可能是SNF1和SNF4衍生的癌細胞侵襲性的機制之一。
據報道,多RTK抑制劑索拉非尼可以有效靶向RAF–MAPK通路,從而抑制EGFR和PDGFRA的激活。通過癌癥細胞和CAFs的共培養模型,作者進一步驗證了索拉非尼治療消除了由SNF4亞型衍生的CAFs共培養誘導的腫瘤生長表型(圖7 f、g)。總之,CAFs中EGFR/PDGFRA的高表達和下游MAPK信號通路的激活可能有助于SNF4腫瘤的侵襲性,這也表明了SNF4患者的潛在治療靶點(圖7 h)。
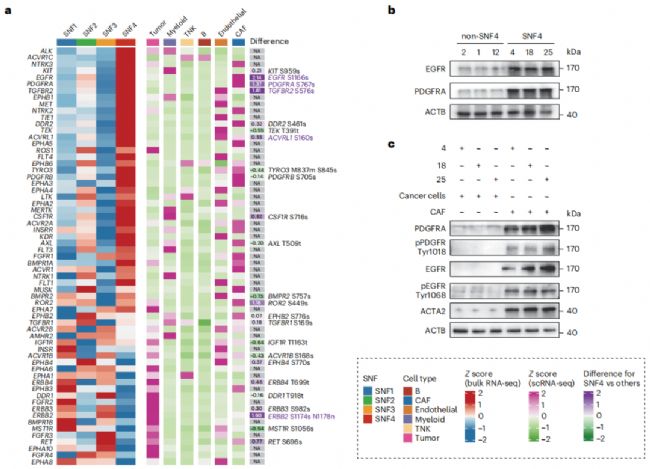
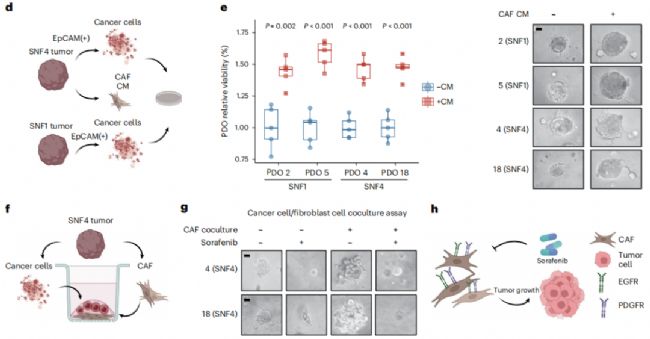
圖7 RTK 驅動(SNF4)亞型衍生的CAF可以促進腫瘤生長,并且容易受到索拉非尼的影響
總結
該研究基于大規模多組學隊列,發現HR+/HER2−癌癥在突變、拷貝數、轉錄、蛋白質組、代謝組和病理學特征方面存在顯著差異。并且通過分析這些差異性,成功將所有HR+/HER2−群體分為四個亞型。最后針對每一個亞型的異質性,進一步提出了對應的精確治療方法,為改善精準醫療在HR+/HER2−乳腺癌中的應用鋪平道路。





