IF 16.6文章分享:水凝膠微球疫苗增強消融后抗腫瘤免疫反應的研究
胰腺癌對化療或免疫治療的應答率較低。雖然微創不可逆電穿孔(IRE)消融術是治療不可切除胰腺癌的一種選擇,但是這種腫瘤類型的免疫抑制腫瘤微環境容易導致腫瘤復發。因此,加強內源性適應性抗腫瘤免疫是提高消融治療和消融后免疫治療效果的關鍵。
近日,上海交通大學王忠敏教授和崔文國教授在Nature communications(IF=16.6)上發表了題為“Interventional hydrogel microsphere vaccineas an immune amplifier for activated antitumour immunity after ablation therapy”的研究論文。他們提出一種水凝膠微球疫苗,通過在腫瘤床相對較低的pH下釋放其攜帶的Flt3L和CD40L來放大消融后的抗癌免疫反應。該疫苗促進腫瘤駐留的Ⅰ型常規樹突狀細胞(CDc1)遷移到腫瘤引流淋巴結(TdLN),從而啟動cDC1介導的抗原交叉壓力級聯反應,導致增強的內源性CD8+T細胞反應。在雄性小鼠原位胰腺癌模型中顯示,水凝膠微球疫苗以安全有效的方式將免疫冷腫瘤微環境轉變為熱腫瘤,從而顯著提高存活率并抑制遠處轉移瘤的生長。

可注射水凝膠微球疫苗的設計及功能
研究人員設計了CD103+CD11b−cDC1激活水凝膠微球疫苗,作為“免疫放大器”來放大消融治療后cDC1/CD8+T細胞抗瘤軸。
他們分別將Cas9質粒和CD40L加載到脂質體和CaCO3納米顆粒中,然后將它們與FLT3L細胞因子和透明質酸混合,制成微流體控制下的水凝膠微球疫苗(圖1a)。水凝膠微球疫苗誘導cDC1介導的抗原交叉遞呈和CD8+T細胞激活的火箭樣級聯放大,以安全和有效的方式促進胰腺癌從冷腫瘤向熱腫瘤轉化(圖1b,c)。最后,水凝膠疫苗有效地激活了系統抗腫瘤免疫,抑制了遠處轉移,并提高了荷瘤小鼠的存活率(圖1d)。
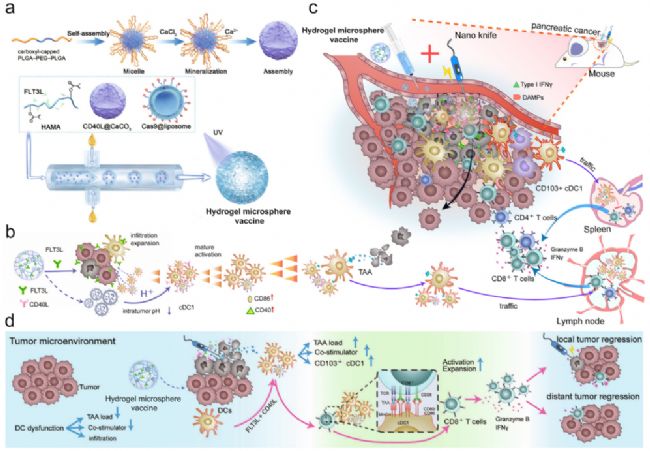
圖1 cDC1激活的水凝膠微球疫苗作為通用免疫放大器,在消融治療后擴增cDC1/CD8+T細胞抗瘤軸
最后,作者也提出了這項研究的局限性。復雜的藥物配方增加了批量生產和臨床翻譯的難度。藥物輸送工具的簡化和后續制藥技術的支持對于隨后的臨床轉型是必要的。由于目前的技術限制,他們使用了MHC-I封鎖,而不是有針對性的cDC1耗盡。這種方法不能完全排除其他APCs激活CD8+T細胞的可能性,后續工作還應重點研究CD8+T細胞在免疫激活中的上游激活途徑。
水凝膠微球疫苗為腫瘤免疫治療提供了一種策略,通過促進cDC1介導的免疫級聯,有效地放大內源性CD8+T細胞的抗腫瘤免疫。與傳統的ICB治療相比,聯合治療策略也可能是未來腫瘤內免疫治療的一種趨勢。
上述研究由愛必信(上海)生物科技有限公司提供D-Lin-MC3-DMA(abs820381,一種可電離的陽離子脂質, 有效的siRNA遞送載體)制備脂質納米顆粒。除此之外,愛必信還可為廣大科研學者提供mRNA定制服務,助力mRNA疫苗的研發!
小愛科普:自2020年以來,mRNA疫苗成為了一項重要武器。mRNA COVID-19疫苗的成功,離不開幾十年來對脂質載體給藥系統的研究。該技術被用于向目標細胞和組織傳遞各種生物活性分子(如小分子抑制劑、核酸藥物)。脂質載體技術與傳統的藥物傳遞方式相比有很多優勢,如提高藥物穩定性,降低藥物的毒性,發揮更佳的治療效果等。
參考文獻
[1] Liu X , Zhuang Y , Huang W ,et al.Interventional hydrogel microsphere vaccine as an immune amplifier for activated antitumour immunity after ablation therapy[J].Nature Communications, 2023, 14(1).
* 溫馨提示:absin所有產品僅用于科學研究,請勿藥物、家用或其他用途。





