微流控技術的介紹及電阻抗譜測量以推斷細胞的大小和速度
微流控技術(Microfluidics)作為一種在微觀尺寸下操控微量體積流體的技術,是一門新興的交叉學科,涉及微機械、流體、物理、材料、生物、化學和生物醫學等領域 。因為具有微型化、集成化等特征,微流控裝置通常被稱為微流控芯片,也被稱為芯片實驗室(Lab on a Chip)和微全分析系統(micro-Total Analytical System(μTAS))。目前,微流控被認為在生物醫學研究中具有巨大的發展潛力和廣泛的應用前景。
生物醫學的發展對細胞和亞細胞成分(細胞核,RNA,DNA)的電阻抗譜測量提出了更高的要求。與過去的幾 MHz 的頻率范圍相比,現在的應用范圍已經擴展到了更高的頻段,并且同時需要具備更高的測量靈敏度。此外,在幾個頻率上同時進行測量的能力也很重要,因為這意味著可以在微流控中實時獲取細胞的阻抗曲線。
目前有三種常見的方法來觀察微流控通道中細胞的大小和速度。
第一種是基于光學方法的細胞計數。它需要使用激光照射微流控通道中已經標記好的細胞,并檢測產生的散射或熒光。除了使用的染料可能有毒或昂貴之外,維護和設置激光及檢測系統同樣會限制該技術的便攜性和耐用性。
第二種是基于圖像的細胞計數。它依賴于高速相機的使用。在使用其它設備將細胞分類到不同通道之前,您需要通過進行圖像處理來判斷細胞的大小。普通攝像機的幀速會限制其檢測速度,每記錄一幀可能需要 200 微秒的時間。
第三種選擇是阻抗細胞計數法。它具有快速的響應時間,無需標記且可集成分類操作。該技術基于監控細胞通過微流控通道中兩個電極對時產生的介電特性的變化。其中一種方法使用鎖相放大器,例如 OE2042,和匹配的電流放大器(Current Amplifier,CA) 來測量微流控通道中兩個電極對之間電流的變化,具體連線如圖1所示。由于實驗中使用了差分電流測量的方法來測量電流的變化,來自流體的背景信號會在很大程度上被抑制。這使得測量到的電流信號更清晰,方便您從中推斷出細胞的大小和速度。
詳細微流控實驗裝置如圖1所示,細胞懸浮液經過注射泵(Syringe pump,neMESYS,ce[1]toni GmbH,Korbussen,Germany)通過聚四氟乙烯管道(PTFE tube)進入微流控芯片(Microfluidic device)。懸浮液流速保持在 0.5 µL/min。由壓力控制器(Pressure controller,OB1 MK3+,Elveflow,Paris,France)提供壓強使得捕獲孔位內外兩側壓強不同從而進行細胞或測試微粒的捕獲。而后由數字鎖相放大器(DLIA)提供 1Vpp 的激勵信號對捕獲的細胞或測試微粒進行激勵而后測量微流控芯片中反饋的電流信號。經由電流放大器(Current Amplifier,CA)轉換為電壓信號方便數字鎖相放大器測量。然后在計算機(PC)端收集數據并計算細胞的阻抗信息。
生物醫學的發展對細胞和亞細胞成分(細胞核,RNA,DNA)的電阻抗譜測量提出了更高的要求。與過去的幾 MHz 的頻率范圍相比,現在的應用范圍已經擴展到了更高的頻段,并且同時需要具備更高的測量靈敏度。此外,在幾個頻率上同時進行測量的能力也很重要,因為這意味著可以在微流控中實時獲取細胞的阻抗曲線。
目前有三種常見的方法來觀察微流控通道中細胞的大小和速度。
第一種是基于光學方法的細胞計數。它需要使用激光照射微流控通道中已經標記好的細胞,并檢測產生的散射或熒光。除了使用的染料可能有毒或昂貴之外,維護和設置激光及檢測系統同樣會限制該技術的便攜性和耐用性。
第二種是基于圖像的細胞計數。它依賴于高速相機的使用。在使用其它設備將細胞分類到不同通道之前,您需要通過進行圖像處理來判斷細胞的大小。普通攝像機的幀速會限制其檢測速度,每記錄一幀可能需要 200 微秒的時間。
第三種選擇是阻抗細胞計數法。它具有快速的響應時間,無需標記且可集成分類操作。該技術基于監控細胞通過微流控通道中兩個電極對時產生的介電特性的變化。其中一種方法使用鎖相放大器,例如 OE2042,和匹配的電流放大器(Current Amplifier,CA) 來測量微流控通道中兩個電極對之間電流的變化,具體連線如圖1所示。由于實驗中使用了差分電流測量的方法來測量電流的變化,來自流體的背景信號會在很大程度上被抑制。這使得測量到的電流信號更清晰,方便您從中推斷出細胞的大小和速度。
詳細微流控實驗裝置如圖1所示,細胞懸浮液經過注射泵(Syringe pump,neMESYS,ce[1]toni GmbH,Korbussen,Germany)通過聚四氟乙烯管道(PTFE tube)進入微流控芯片(Microfluidic device)。懸浮液流速保持在 0.5 µL/min。由壓力控制器(Pressure controller,OB1 MK3+,Elveflow,Paris,France)提供壓強使得捕獲孔位內外兩側壓強不同從而進行細胞或測試微粒的捕獲。而后由數字鎖相放大器(DLIA)提供 1Vpp 的激勵信號對捕獲的細胞或測試微粒進行激勵而后測量微流控芯片中反饋的電流信號。經由電流放大器(Current Amplifier,CA)轉換為電壓信號方便數字鎖相放大器測量。然后在計算機(PC)端收集數據并計算細胞的阻抗信息。

Figure1. 微流控阻抗測試的整體架構圖 (b).微流體裝置的顯微照片(比例尺為100 μm)
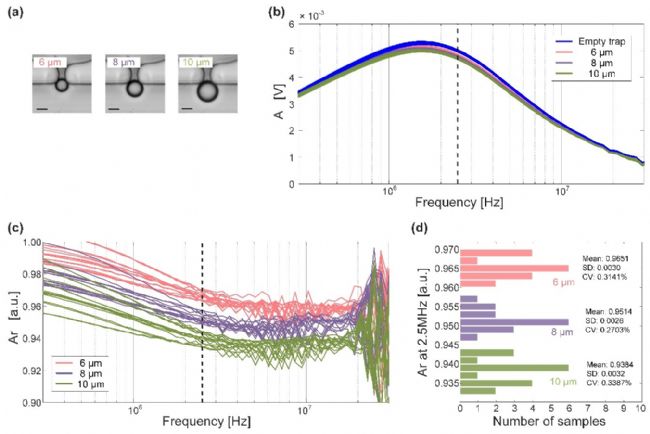
Figure2. 細胞微流控阻抗測量結果(標尺為 5 µm)
在幅頻響應曲線(圖2-b)中,沒有捕獲到粒子以及捕獲到不同粒子的 幅頻響應曲線在低頻域與高頻域都混合在一起難以分辨,而單靠幅頻響應曲線難以確定最佳的頻率點來區分粒子,故對測量得到的幅頻響應曲線做歸一化處理,即如下式所示進行計算。
Ar = A * Ae
其中 A 為不同粒子捕獲后測量的幅值,Ae 為沒有捕獲到粒子是測量得到的幅值。經過歸一化處理后可以看到,在頻率為 2.5 MHz 時測量所得幅值最容易區分不同粒子。 故將輸入激勵信號的頻率固定為 2.5 MHz 后重新對不同粒子進行多次測量,得到的結 果如圖2-28d 所示。可以看到,針對不同粒子進行多組測量后得到的 6 µm 粒子平均幅 值為 0.9651,標準差(SD)為 0.0030,波動系數(CV)為 0.3141%,8 µm 粒子平均幅值 為 0.9514,標準差為 0.0028,波動系數為 0.2703%,10 µm 粒子平均幅值為 0.9384,標 準差為 0.0032,波動系數為 0.3387%。極小的標準差和波動系數表明本次測量的靈敏度 與穩定性都非常高,而差異明顯的幅值平均值也是區分粒子的有力證據。
標簽:
微流控電阻抗譜測量
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





