探討生活飲用水中碘化物的兩種檢測方法
碘作為人體必需的微量元素之一,雖然在人體的含量極低,但作用卻很重要。人體缺碘會造成不同程度的損害,如地方性甲狀腺腫、地方性克汀病和對兒童智力發育的潛在性損傷。我國曾是全球碘缺乏病嚴重流行的國家之一,大部分地區外環境缺碘,部分省份存在水源性高碘地區。人體碘元素的來源主要是水和食物,在無外來碘食物的環境下,水碘含量是衡量當地居民碘攝入量的重要指標。環境中水碘含量過低會導致碘缺乏病的發生,水碘含量過高時,則可引起高碘甲狀腺腫。因此準確測定飲用水中碘化物的含量對人類的健康有著至關重要的作用。
水中碘化物的測定方法較多,相關報道也比較多,主要有催化還原光譜法、氣相色譜法、離子色譜法、電感耦合等離子體質譜法和分光光度法,本文從測定范圍、檢出限、精密度、準確度等方面對比研究了離子色譜法和硫酸鈰催化分光光度法兩種測定方法,通過對比發現,兩種不同的方法都存在各自的利弊,實驗過程中可根據樣品量、樣品濃度范圍,實驗室條件等選擇合適的方法。
一、材料與方法
1.1 儀器與試劑
UV-1500紫外可見分光光度計;
離子色譜;0.45μm濾膜;碘標準溶液(100μg/mL);碳酸鈉(優級純);氫氧化鈉(優級純);三氧化二砷;氯化鈉(優級純);硫酸鈰銨;碘化鉀(優級純);過硫酸銨;純水(重蒸水或去離子水,電導率<1.0μs/cm)。
1.2 方法原理
1.2.1硫酸鈰催化分光光度法測定生活飲用水中碘化物的原理
利用碘對砷鈰氧化還原反應的催化作用H3AsO3+2Ce4++H2O→H3AsO3+2Ce3++2H+反應中黃色的Ce4+被亞砷酸還原成無色的Ce3+,碘含量越高,反應速度越快,剩余的Ce4+則越少,控制反應溫度和時間,在一定波長下測定體系中剩余的Ce4+的吸光度,求出碘含量。
1.2.2離子色譜法測定生活飲用水中碘化物的原理
水樣注入儀器后,在淋洗液的攜帶下流經陰離子分離柱,由于水樣中各種陰離子對分離柱中陰離子交換樹脂的親和力不同,移動速度亦不同,從而使碘化物與其他離子得以分離,分離出來的碘離子流經脈沖安培檢測器,在一定的電極電位下,發生電極反應,所產生的電流強度在一定范圍內與碘離子含量成正比。
1.3方法
1.3.1水樣前處理硫酸鈰催化分光光度法:直接取樣;離子色譜法:水樣過0.45μm濾膜。
1.3.2標準溶液的配制將碘標準溶液(100μg/mL)用純水稀釋成1μg/mL標準使用液,再配置相應的標準系列。硫酸鈰催化分光光度法系列(μg/L)20、40、60、80、100;離子色譜法標準溶液系列(μg/L)5、10、20、50、100、200。
1.3.3儀器條件
可見分光光度計:分析波長420nm。
離子色譜工作條件:泵流速0.7mL/min,抑制器電流75mA,陰離子交換柱,淋洗液濃度為3.2mmol/LNa2CO3+1.0mmol/LNaHCO3+15%丙酮。進樣量25μL。
二、結果與討論
2.1標準曲線與線性回歸方程硫酸鈰催化分光光度法測定生活飲用水中碘化物的線性范圍為0~100μg/L,相關系數為0.9998,離子色譜法測定生活飲用水中碘化物的線性范圍為0~200μg/L,相關系數為0.9999,線性范圍內線性關系均良好。
2.2 方法檢出限
分光光度法的檢出限是以吸光度(扣除空白)為0.01相對應的濃度值為檢出限,硫酸鈰催化分光光度法最低檢測質量濃度為0.2μg/L,若取2mL水樣,最低檢測質量為0.4ng。根據公式QL=3Sb/S(Sb為空白多次測量的標準偏差,S為方法的靈敏度即標準曲線的斜率),計算離子色譜法測定水中碘化物的檢出限,本實驗空白測量次數n=20,計算其檢出限為2μg/L。
2.3加標回收和精密度實驗
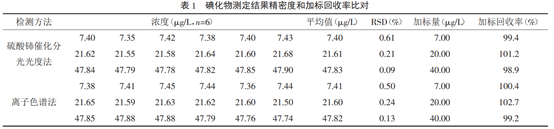
選取高、中、低濃度的三份水樣,分別用分光光度法、離子色譜法平行測定6次,計算其相對標準偏差(RSD),RSD分別為0.09%~0.61%,0.13%~0.50%,RSD均小于5.00%,三份樣品分別加與本底濃度相當的碘標準溶液,再用三種方法分別做加標回收實驗,加標回收率在99.2%~102.7%之間,結果見表1。說明兩種方法都具有較好的精密度和準確度。
三、小結
硫酸鈰分光光度法,離子色譜法分析生活飲用水中碘化物都有很高的精密度和準確度。硫酸鈰分光光度法操作麻煩,操作過程條件要求苛刻,恒溫水浴,加試劑,比色時間精確到秒,稍有不慎就會造成結果偏差,試劑用量大,且要用到強腐蝕性的濃硫酸和劇毒的三氧化二砷試劑,對實驗室環境和人體造成危害。離子色譜法線性范圍寬,靈敏度高,操作簡便,試劑用量少,對環境污染小,分析一個樣品需要17min左右對大批量樣品不太適用。綜上所述,兩種不同的方法都存在各自的利弊,各實驗室可根據樣品量、樣品濃度范圍,實驗室條件等選擇合適的方法。
水中碘化物的測定方法較多,相關報道也比較多,主要有催化還原光譜法、氣相色譜法、離子色譜法、電感耦合等離子體質譜法和分光光度法,本文從測定范圍、檢出限、精密度、準確度等方面對比研究了離子色譜法和硫酸鈰催化分光光度法兩種測定方法,通過對比發現,兩種不同的方法都存在各自的利弊,實驗過程中可根據樣品量、樣品濃度范圍,實驗室條件等選擇合適的方法。
一、材料與方法
1.1 儀器與試劑
UV-1500紫外可見分光光度計;
離子色譜;0.45μm濾膜;碘標準溶液(100μg/mL);碳酸鈉(優級純);氫氧化鈉(優級純);三氧化二砷;氯化鈉(優級純);硫酸鈰銨;碘化鉀(優級純);過硫酸銨;純水(重蒸水或去離子水,電導率<1.0μs/cm)。
1.2 方法原理
1.2.1硫酸鈰催化分光光度法測定生活飲用水中碘化物的原理
利用碘對砷鈰氧化還原反應的催化作用H3AsO3+2Ce4++H2O→H3AsO3+2Ce3++2H+反應中黃色的Ce4+被亞砷酸還原成無色的Ce3+,碘含量越高,反應速度越快,剩余的Ce4+則越少,控制反應溫度和時間,在一定波長下測定體系中剩余的Ce4+的吸光度,求出碘含量。
1.2.2離子色譜法測定生活飲用水中碘化物的原理
水樣注入儀器后,在淋洗液的攜帶下流經陰離子分離柱,由于水樣中各種陰離子對分離柱中陰離子交換樹脂的親和力不同,移動速度亦不同,從而使碘化物與其他離子得以分離,分離出來的碘離子流經脈沖安培檢測器,在一定的電極電位下,發生電極反應,所產生的電流強度在一定范圍內與碘離子含量成正比。
1.3方法
1.3.1水樣前處理硫酸鈰催化分光光度法:直接取樣;離子色譜法:水樣過0.45μm濾膜。
1.3.2標準溶液的配制將碘標準溶液(100μg/mL)用純水稀釋成1μg/mL標準使用液,再配置相應的標準系列。硫酸鈰催化分光光度法系列(μg/L)20、40、60、80、100;離子色譜法標準溶液系列(μg/L)5、10、20、50、100、200。
1.3.3儀器條件
可見分光光度計:分析波長420nm。
離子色譜工作條件:泵流速0.7mL/min,抑制器電流75mA,陰離子交換柱,淋洗液濃度為3.2mmol/LNa2CO3+1.0mmol/LNaHCO3+15%丙酮。進樣量25μL。
二、結果與討論
2.1標準曲線與線性回歸方程硫酸鈰催化分光光度法測定生活飲用水中碘化物的線性范圍為0~100μg/L,相關系數為0.9998,離子色譜法測定生活飲用水中碘化物的線性范圍為0~200μg/L,相關系數為0.9999,線性范圍內線性關系均良好。
2.2 方法檢出限
分光光度法的檢出限是以吸光度(扣除空白)為0.01相對應的濃度值為檢出限,硫酸鈰催化分光光度法最低檢測質量濃度為0.2μg/L,若取2mL水樣,最低檢測質量為0.4ng。根據公式QL=3Sb/S(Sb為空白多次測量的標準偏差,S為方法的靈敏度即標準曲線的斜率),計算離子色譜法測定水中碘化物的檢出限,本實驗空白測量次數n=20,計算其檢出限為2μg/L。
2.3加標回收和精密度實驗
選取高、中、低濃度的三份水樣,分別用分光光度法、離子色譜法平行測定6次,計算其相對標準偏差(RSD),RSD分別為0.09%~0.61%,0.13%~0.50%,RSD均小于5.00%,三份樣品分別加與本底濃度相當的碘標準溶液,再用三種方法分別做加標回收實驗,加標回收率在99.2%~102.7%之間,結果見表1。說明兩種方法都具有較好的精密度和準確度。

三、小結
硫酸鈰分光光度法,離子色譜法分析生活飲用水中碘化物都有很高的精密度和準確度。硫酸鈰分光光度法操作麻煩,操作過程條件要求苛刻,恒溫水浴,加試劑,比色時間精確到秒,稍有不慎就會造成結果偏差,試劑用量大,且要用到強腐蝕性的濃硫酸和劇毒的三氧化二砷試劑,對實驗室環境和人體造成危害。離子色譜法線性范圍寬,靈敏度高,操作簡便,試劑用量少,對環境污染小,分析一個樣品需要17min左右對大批量樣品不太適用。綜上所述,兩種不同的方法都存在各自的利弊,各實驗室可根據樣品量、樣品濃度范圍,實驗室條件等選擇合適的方法。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





