Izon qEV尺寸排阻柱在癌癥診斷及開發(fā)中的應用

簡介:對于用于癌癥診斷的EV分離純化,選擇正確的方法可能是找到成功的診斷標記物與未能達到足夠的特異性和敏感性之間的區(qū)別。隨著qEV尺寸排阻柱提供卓越的EV純度,您的生物標志物有更大的機會在背景噪聲中脫穎而出。
隨著人口增長和老齡化,癌癥死亡率也在增加。好消息是,自1990年以來,經過年齡標準化的癌癥死亡率實際上有所下降,盡管截至2019年只下降了15.22%(圖1)。在此期間出現(xiàn)了數(shù)百種新的癌癥治療方法,但為什么存活率仍令人失望呢?正如世界衛(wèi)生組織所說,早期診斷可以挽救生命并降低治療成本。篩查的關鍵是非侵入性、可靠、可擴展的檢測方法,可以在病理發(fā)生的早期階段檢測到癌癥,以便進行快速治療。最近的研究表明,可能有一個答案:細胞外囊泡(EVs)。這些微小的蛋白質、核酸和小分子的包裹物可被所有細胞(包括癌細胞)釋放到體液中。
近年來,對EV作為癌癥診斷的興趣呈指數(shù)增長,2022年發(fā)表在這個主題上的文章數(shù)量比2011年多150倍(來源:Web of Science)。考慮到EV具有將癌細胞衍生的蛋白質、RNA甚至DNA運輸?shù)揭子诜乔秩胄栽\斷的生物液體的潛力,該領域的診斷潛力是巨大的。然而,這些診斷測試開發(fā)中使用的許多方法不夠純凈,可能無法擴展到診斷,更不用說大型篩查項目了。在本文中,我們將看一下EV癌癥診斷領域內的三篇論文,每篇比較不同的EV分離純化方法。
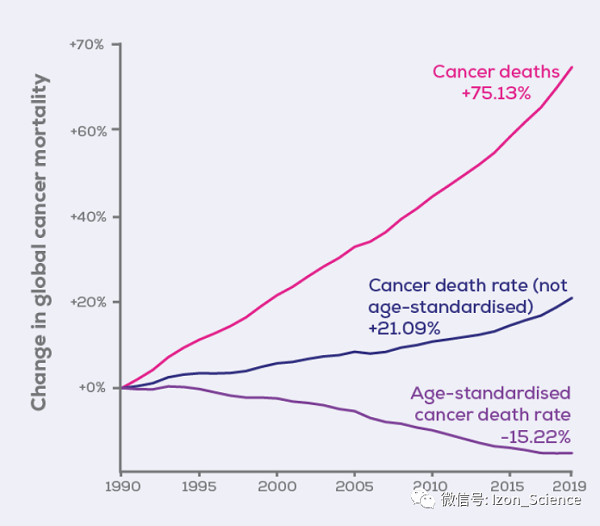
圖1. 全球癌癥死亡率變化。數(shù)據(jù)來自IHME Global Burden of Disease。死亡率的增加可能是由于全球人口的增加,而未經年齡標準化的癌癥死亡率的增加可能是由于全球人口的老齡化。年齡標準化癌癥死亡率的降低可能代表了診斷和治療的改進。
這三項比較EV分離純化方法用于癌癥診斷的研究之一是由Pang等人(2020)[1] 進行的,該研究來自前列腺癌診斷領域,目前的黃金診斷標準前列腺特異性抗原導致了許多不必要的活檢 [2]。在Pang等人的研究中,他們旨在確定前列腺來源的血漿EV是否可以攜帶更具體的生物標志物。
第二項研究是由Northrop-Albrecht等人(2022)[3]進行的,他們轉向人類大便上清液EV診斷結腸癌。早期診斷結腸癌尤為重要,因為較晚的診斷將局部癌癥的91% 5年生存率降至僅為13%的遠處擴散癌癥的生存率。
最后,Anastasi等人的研究(2020)[4]研究了一種多形性神經膠質母細胞瘤的小鼠模型,希望完善血清EV分離純化技術,以便識別疾病進展的縱向標志物。
比較的EV分離方法背后的原理
每項研究中比較的EV分離方法原理如圖2所示。
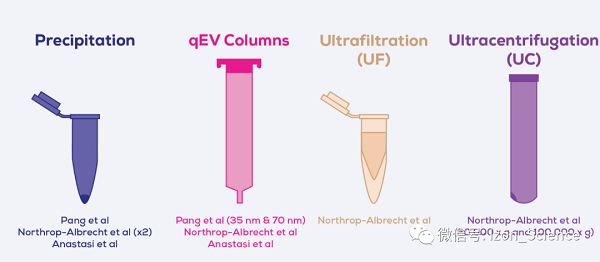
圖2. 每個研究比較的細胞外囊泡(EV)純化方法。
沉淀法利用聚合物(例如聚乙二醇,常縮寫為PEG)的聚合作用形成網(wǎng)狀結構,較大的顆粒物和許多較小的顆粒物會被困住。然后可以將此網(wǎng)狀物離心到管底。雖然此過程與特異性捕獲EV無關,但經常被使用。
qEV尺寸排阻柱使用尺寸排除色譜法根據(jù)其顆粒大小將EV與其他顆粒物分離。qEV有各種尺寸,可基于相同的原理分離從150 µL到100 mL的樣品。qEV有兩個系列:35 nm和70 nm系列,分別分離略有不同的EV范圍。
超濾將EV和任何其他較大的分子從起始樣品濃縮到較小的體積中,與沉淀一樣,不能真正單獨分離EV。
超速離心是EV領域的黃金標準。它使用逐漸增加的離心力將不同大小的顆粒沉淀,EV通常在或高于100,000 x g的離心下沉。雖然被認為是黃金標準,但由于純度低、加工時間長以及EV受離心力損傷等問題,這種技術越來越不受青睞。
那么,在癌癥診斷的背景下,這些方法如何比較呢?
這些方法中,qEV可以分離出更純的EVs
非EV組分的污染會覆蓋真正的癌癥EV生物標志物的信號,阻礙生物標志物的發(fā)現(xiàn)、驗證和關鍵的早期診斷。對于與EV相關的蛋白生物標志物,這意味著必須去除可溶性蛋白和脂蛋白。而對于EV-RNA生物標志物,非EV RNA去除是關鍵。
qEV擅長去除蛋白質污染
EV分離物中可溶性蛋白質的污染程度通常由EV與蛋白質濃度的比率顯示。Pang等人和Anastasi等人發(fā)現(xiàn),與血漿和血清沉淀法相比,qEV的分離物具有更高的EV/蛋白質比率(圖3A和C)。qEV 70nm略優(yōu)于qEV 35nm,這是有道理的,因為35nm的尺寸截留較小,意味著可能會共同分離一些較大的蛋白復合物。Northrop-Albrecht等人發(fā)現(xiàn),在糞便上清樣品中,超速離心可能比其他技術提供略高的純度,盡管超速離心的純度變化非常大(圖3B)。

圖3. 使用不同方法分離出的細胞外囊泡(EVs)的純度。
A和D:Pang等人通過商業(yè)沉淀試劑盒或qEV 35 nm或qEV 70 nm從前列腺癌患者或健康對照組的血漿中分離出EVs,確定了在蛋白質污染(A;EV標記物CD81、CD9和CD63相對強度除以分離物中的蛋白質µg)和脂蛋白污染(D;分離物中的ApoB強度)方面的純度。統(tǒng)計分析采用One-way ANOVA 和 unspecified post-hoc test。
B和E:Northrop-Albrecht等人分析了用于結直腸癌診斷的人類大便中用不同方法分離出的EVs的純度(以蛋白質污染(B;每µg蛋白質的顆粒數(shù))和RNA污染(E;經蛋白酶K和RNase A處理后分離物中非EV RNA的降解)來表示)。UF=超濾;UC=超速離心;20k=20,000 x g沉淀;100k=100,000 x g沉淀。沉淀A和B代表兩種不同的商業(yè)沉淀試劑盒。統(tǒng)計分析采用Kruskal-Wallis檢驗。
C和F:Anastasi等人通過商業(yè)沉淀試劑盒或qEV 70 nm從小鼠膠質母細胞瘤模型中分離出的EVs,確定了分離物中蛋白質去除百分比(C;通過分離物中的蛋白質濃度除以起始材料中的5,000 µg/µL計算)和污染物或“外泌體”蛋白質的相對富集(F;DAVID富集分析)。統(tǒng)計分析采用成對T檢驗(C)或Fisher精確檢驗,采用假陽性發(fā)現(xiàn)率(FDR)多重檢驗校正。
*p<0.05;** p<0.01;*** p<0.001
qEV可顯著降低脂蛋白污染
由于他們分別使用了血漿和血清,Pang等人和Anastasi等人也對脂蛋白污染感興趣。Pang等人發(fā)現(xiàn),與沉淀法相比,qEV 70 nm的ApoB污染要低得多。qEV 35 nm顯示出比qEV 70 nm 高的ApoB水平,可能是由于這些柱的較低尺寸截留。Anastasi等人使用蛋白質組學確定,雖然在qEV 70 nm的分離物中沒有富集脂蛋白,但沉淀法分離物中富集了脂蛋白。這些數(shù)據(jù)表明,與常用的沉淀法相比,qEV 70 nm在去除脂蛋白污染方面更為優(yōu)秀。
qEV顯著降低非EV RNA污染 在非EV RNA污染方面,qEV 70 nm也表現(xiàn)最佳,經過蛋白酶K和RNase A處理以降解非EV RNA后,qEV 70 nm的RNA譜與處理前僅有微小差異(圖3E)。相反,超濾分離物卻會分離出大量非EV RNA,這將掩蓋EV RNA癌癥生物標志物的鑒定或測量。
就可規(guī)模化而言,qEV是優(yōu)秀的
要想使診斷測試成功,它必須是可規(guī)模化的。這意味著超速離心法因處理時間通常超過每個樣品3小時而被立即排除。這還不包括任何生物標志物測量。超速離心法還需要大型、昂貴且(如果使用不當)非常危險的設備。超濾法具有可擴展性和自動化的潛力,但僅使用超濾法來分離EV以用于診斷的吸引力受到技術相對不純的限制(圖2E)。
到目前為止,最快、最簡單的方法是沉淀法,這導致該技術在診斷研究和試驗中被使用。然而,它對EV的非選擇性非常高,對污染物的去除效果差(圖2A、C、D和F)。使用沉淀法在診斷研究中會阻礙發(fā)現(xiàn)過程嗎?鑒于這些結果,這是一個明確的可能性。
另一方面,qEV具有高度可擴展性,柱子有多種尺寸可適用于各種樣本類型。此外,我們提供了高度自動化的EV分離純化過程,使用qEV可以實現(xiàn)標準化的分離純化,非常適合用于提供高質量的診斷測試。

圖4.自動餾分收集器(AFC)與qEV相結合,可以實現(xiàn)精確、可定制和可重復的分離純化。
對于癌癥診斷,應選擇哪種分離方法?當然,我們是有偏見的,因為我們制造qEV尺寸排阻柱。但更多的科學證據(jù)支持了我們的觀點,EV診斷研究人員正轉向尺寸排除色譜,主要是因為相對于其他方法,它具有高度可擴展性和可重復性。使用qEV允許從臨床樣本中標準化、自動化地分離純EV用于診斷目的。使用更純的EV,通過自動化和優(yōu)質產品帶來的可重復性,使用qEV分離系統(tǒng)將確保您處于最佳位置,以識別有意義的生物標志物,以確保患者獲得所需的早期診斷。
事實上,我們的qEV已經被腫瘤診斷領域的研究人員在許多研究中使用。例如,Mercy Bioanalytics在其Mercy Halo™診斷測試中使用我們的qEV,如最近的一篇預印本所述,該預印本側重于在人血漿中檢測早期卵巢腫瘤。在非小細胞肺癌領域,David P. Carbone和Andreas Möller的小組使用qEV來追蹤疾病軌跡和治療反應。在乳腺癌方面,Sima Lev的團隊使用qEV分離EV來分析疾病進展和治療反應,F(xiàn)rancesco Fabbri的團隊使用qEV分離EV來識別早期診斷生物標志物,Clotilde Théry和Charlotte Proudhon的團隊使用qEV柱識別轉移性疾病的蛋白質生物標志物。在前列腺癌的研究中,Rienk Nieuwland的團隊在阿姆斯特丹大學醫(yī)療中心的研究中使用了qEV,Karla C. Williams及其團隊使用了qEV來鑒定潛在的血漿生物標志物STEAP1。這幾個例子只是癌癥研究人員使用qEV的文獻中的一小部分。
想了解更多嗎?請聯(lián)系我們,了解我們如何幫助您擴大和優(yōu)化診斷通量(包括定制解決方案)。
歡迎關注伯齊官方微信(微信公眾號:Bio-Gene)
回復:視頻,查看相關視頻
長按以下二維碼可識別關注公眾號

伯齊科技有限公司
Bio-Gene Technology Ltd.
熱線:176 2009 3784
www.bio-gene.com.cn
marketing@bio-gene.com.cn
香港 北京 上海 廣州 成都 濟南





