In-gel熒光檢測技術的介紹及其在泛素化蛋白互作中的應用
常規的蛋白質分析實驗中,在電泳分離結束后,還需進行蛋白染色、轉膜、western blot 等一系列鑒定步驟。In-gel熒光檢測技術,突破常規,在電泳分離后即可進行蛋白檢測,無需染色和western blot等后續操作。由于免去了凝膠電泳后的一系列操作,不僅大幅縮減了實驗時間,有效提升效率并降低試劑耗材等實驗成本,同時還能消除轉膜、封閉過程中眾多因素的影響。
In-gel熒光檢測的技術原理在于:在凝膠中,蛋白結合復合物的遷移率與未結合的蛋白不同,可被分離開來。使用熒光基團標記其中一種蛋白,樣品中該蛋白及其結合復合物的條帶均可被檢測出來。電泳結束后,使用成像設備(如Azure多功能分子成像系統、Sapphire FL激光掃描成像系統)進行成像檢測。目前,In-gel熒光檢測在融合蛋白表達、蛋白互作分析、凝膠阻滯實驗等方面已具有廣泛的應用。
— 實驗案例:泛素化蛋白互作 —
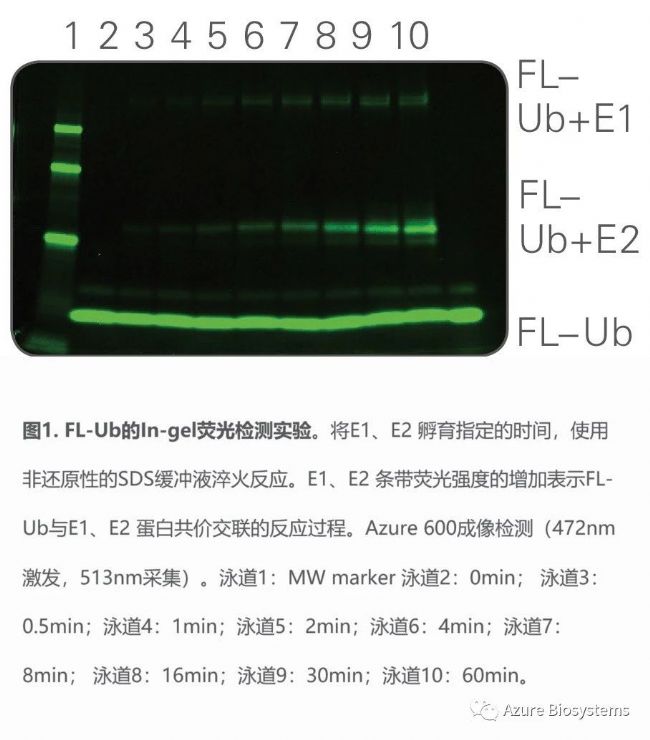
基于In-gel熒光檢測方法,對泛素化相關過程進行實驗分析。將熒光標記的泛素(Fluorescently labeled ubiquitin,以下簡稱為FL-Ub)與E1 泛素激活酶(以下簡稱為E1)和E2 泛素連接酶(以下簡稱為E2)孵育后進行凝膠電泳分離,并使用Azure 600 多功能分子成像系統進行成像檢測。
方法
熒光標記的FL-Ub與E1、E2 蛋白孵育結合,通過加入非變性SDS緩沖液,分別在0.5、1、2、4、8、16、30、和60min后淬火結合反應。在非變性條件下進行電泳,每個泳道FL-Ub上樣量約200ng。
電泳結束后,進行In-gel熒光檢測:使用Azure 600多功能分子成像系統的 EPI 藍光光源(472nm激發,513nm采集)進行成像,即可檢測FL-Ub及其復合物。
結果
In-gel熒光檢測圖像中,可見游離的FL-Ub條帶,同時顯示,FL-Ub+E1、FL-Ub+E2復合物的量均隨反應時間的增加而增加(圖 1)。
結論
In-gel熒光檢測,通過熒光標記蛋白,無需染色和Western Blot,即可實現蛋白互作的可視化分析,顯著提升了實驗效率、有效降低試劑耗材等方面成本。
Azure多功能分子成像系統、Sapphire FL激光掃描成像系統為代表的尖端熒光分子成科技,除In-gel熒光檢測功能外,其在各類Blots、凝膠、磷屏、微陣列(芯片)、培養皿、活體成像、組織切片等多領域,均具有廣泛靈活的應用,將持續為卓越分子成像呈獻更多可能!





