m6A-seq應用揭示RBM33參與調控m6A去甲基化酶ALKBH5活性及底物選擇性
RNA結合蛋白(RNA-binding protein,RBP)是一類結構和功能多樣化的蛋白質,參與多種生物過程。越來越多的證據表明,RBP通過調控編碼或非編碼RNA的可變剪接、轉運、穩定性、降解和翻譯,在基因表達的轉錄后調控中發揮著關鍵作用,但RBP中RNA結合motif蛋白33(RNA-binding motif protein 33, RBM33)的生物學功能在很大程度上未知。N6-甲基腺苷(m6A)甲基化是真核生物mRNA中最豐富的內部修飾,是一個動態可逆的過程, m6A由m6A甲基轉移酶復合體(MTC)沉積。盡管MTC可以被各種細胞組分招募到靶轉錄本,但目前還不清楚如何實現去甲基化選擇性,是否存在類似的接頭蛋白來促進所選轉錄本的m6A去甲基化呢?
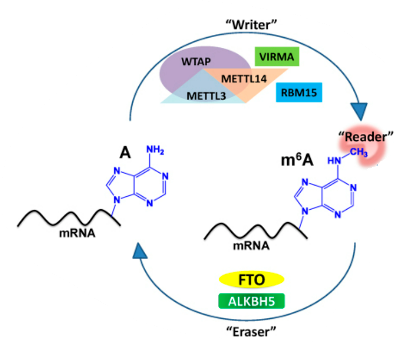
2023年5月30日,美國芝加哥大學何川教授團隊和美國佛羅里達大學錢志堅教授團隊合作在《Molecular Cell》雜志上發表題為“RBM33 is a unique m6A RNA binding protein that regulates ALKBH5 demethylase activity and substrate selectivity”的研究論文,該研究通過MeRIP-seq、RIP-seq、RNA-seq等實驗分析方法揭示了在頭頸鱗狀細胞癌 (head-neck squamous cell carcinoma,HNSCC) 中,RNA 結合蛋白RBM33參與調控m6A去甲基化酶ALKBH5活性及其底物選擇性,并進一步驗證了靶向ALKBH5/RBM33復合體m6A 去甲基化酶活性作為HNSCC 治療策略的潛在可能。

標題:RBM33 is a unique m6A RNA binding protein that regulates ALKBH5 demethylase activity and substrate selectivity(RBM33是一種特異性m6A RNA結合蛋白,可以調控ALKBH5去甲基化酶活性和底物選擇性)
時間:2023-05-30
期刊:Molecular Cell
影響因子:IF 16
技術平臺:PAR-CLIP-seq 、m6A-seq(MeRIP-seq)、RNA-seq、qRT-PCR、WB等
研究摘要:
本研究鑒定出一種以前未被識別的m6A結合蛋白——RBM33,RBM33通過與ALKBH5結合形成復合體,在ALKBH5介導的mRNA m6A去甲基化轉錄本亞群中發揮關鍵作用。RBM33將ALKBH5招募到其m6A標記的底物上,并通過去除其SUMO化來激活ALKBH5去甲基化酶活性。研究進一步證明RBM33對頭頸部鱗狀細胞癌(HNSCC)的腫瘤發生至關重要。RBM33通過招募ALKBH5去甲基化和穩定DDIT4 mRNA來促進自噬,進而促進RBM33在HNSCC細胞中的致癌功能。總之,本研究揭示了在腫瘤發生過程中m6A轉錄本亞群選擇性去甲基化的分子機制,這可能解釋了其他細胞過程中去甲基化的選擇性,并表明了它在維持HNSCC腫瘤發生中的重要性。
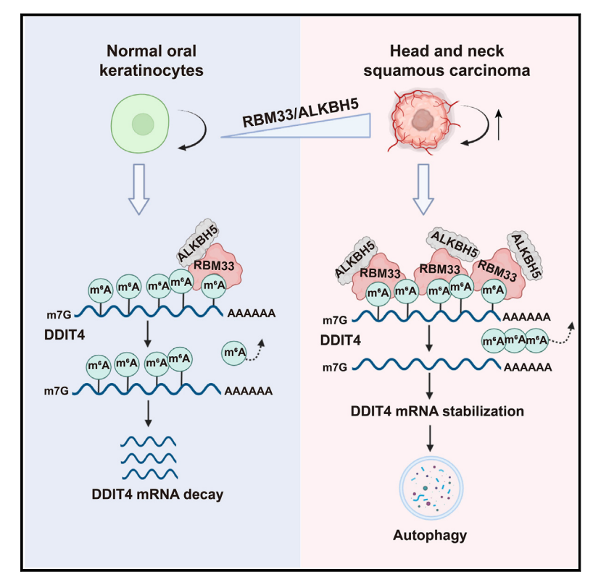
圖形摘要
研究設計
研究結果:
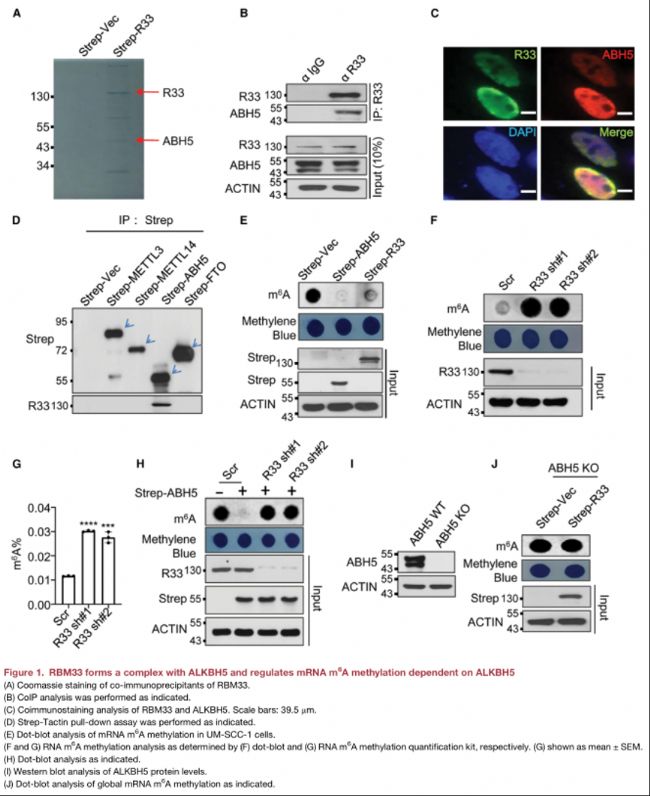
(1)RBM33與ALKBH5形成復合體,調控依賴ALKBH5的mRNA m6A甲基化
• LC-MS分析發現ALKBH5是UM-SCC-1細胞中與RBM33相互作用的蛋白質之一;
• 在UM-SCC-1細胞中,內源性ALKBH5可以和內源性RBM33發生相互作用;
• 免疫染色分析顯示,RBM33在細胞中與ALKBH5共定位。
• RBM33不與strep標記的METTL3、METTL14和FTO相互作用;
• 與ALKBH5過表達誘導的m6A去甲基化類似,RBM33過表達導致mRNA m6 A甲基化顯著降低;
• ALKBH5過表達引起的細胞mRNA m6A下調可以被敲低RBM33所逆轉;
• 同樣敲除ALKBH5 可以阻止RBM33過表達所介導的m6A下調。
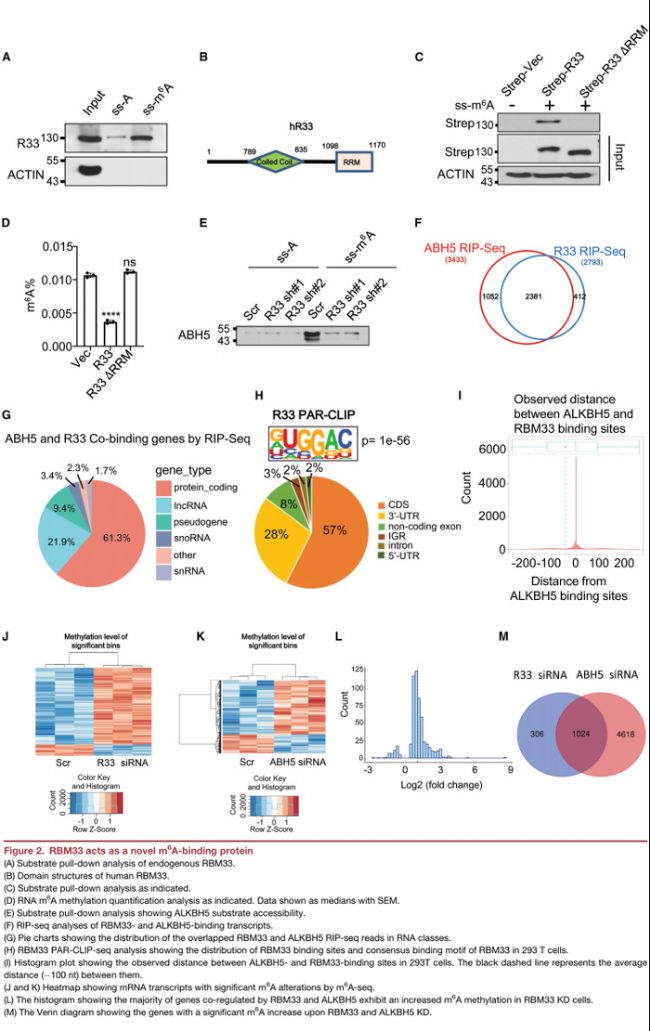
• 去除RBM33的RRM結構域去除后喪失其與m6A修飾的RNA寡核苷酸結合的能力;
• RIP-Seq顯示近70%的ALKBH5靶基因與RBM33結合。
• 絕大多數RBM33和ALKBH5的共同結合位點位于蛋白質編碼轉錄本和LncRNAs中;
• PAR-CLIP揭示m6A修飾經典序列“RACH”出現在RBM33結合位點;
• 超過50%的RBM33結合位點位于ALKBH5結合位點上游100 nt處;
• RBM33 KD導致1330個RNA轉錄本的m6A修飾上調,其中65%的轉錄本的m6A修飾同樣可以被ALKBH5 敲低所誘導。
 (3)ALKBH5通過RBM33結合m6A修飾底物以調節HNSCC細胞中m6A修飾
(3)ALKBH5通過RBM33結合m6A修飾底物以調節HNSCC細胞中m6A修飾
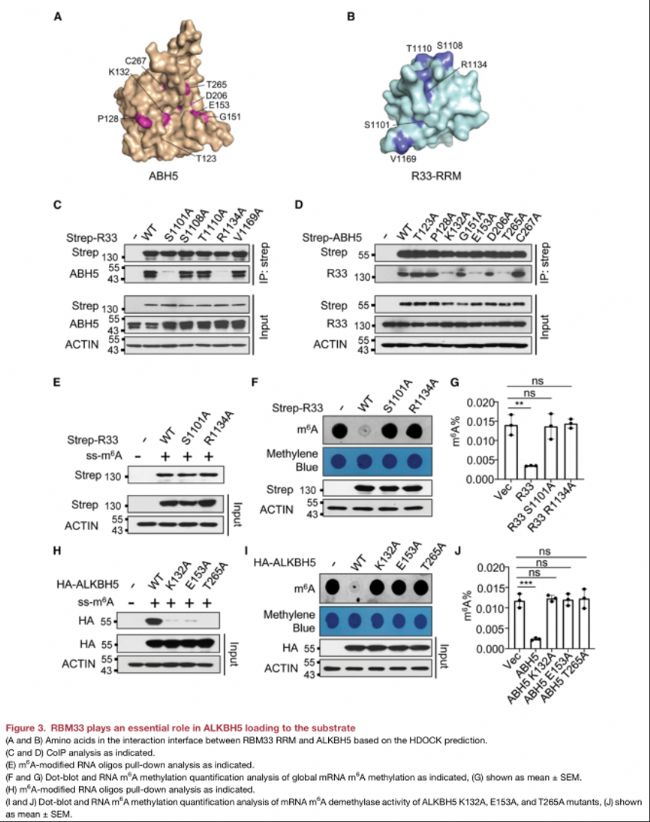
• RBM33蛋白中的S1101A或 R1134A顯著破壞了ALKBH5與RBM33之間的相互作用
• ALKBH5中的K132A、E153A或T265A,顯著破壞了ALKBH5與RBM33之間的相互作用。
• RBM33的S1101A和R1134A突變體與野生型RBM33對m6A修飾底物的結合親和力相似;
• RBM33S1101A和RBM33R1134A突變體都失去了調控mRNA m6A甲基化的能力;
• ALKBH5的K132A、E153A和T265A突變體喪失與m6A修飾底物的結合能力;
• ALKBH5的K132A、E153A和T265A突變體喪失m6A去甲基化酶活性。
(4)RBM33通過募集deSUMOylase SENP1激活ALKBH5去甲基化酶活性
• RBM33 KD顯著誘導ALKBH5 SUMOylation;
• RBM33 KD不影響ALKBH5和PIAS4相互作用,但破壞了ALKBH5和SENP1的相互作用;
• RBM33過表達增強了ALKBH5與SENP1的相互作用;
• RBM33與SENP1互作,而SENP1不依賴于ALKBH5。

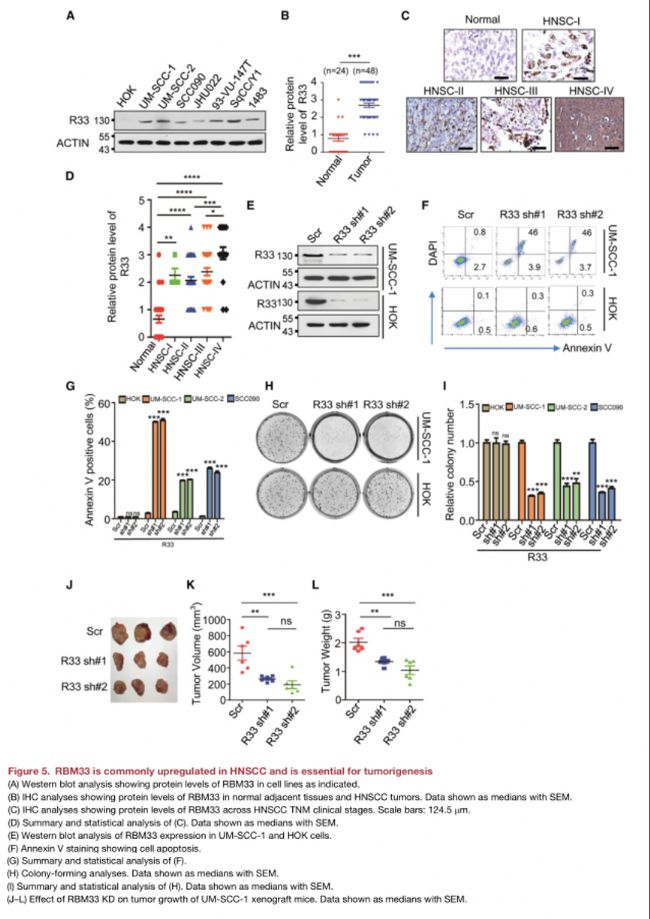
(5)RBM33通常在HNSCC中上調,并且是腫瘤發生所必需的
• 免疫組化顯示,RBM33在不同階段HNSCC患者原發腫瘤中的表達高表達;
• RBM33 KD特異性誘導HNSCC細胞凋亡并抑制其克隆形成;
• RBM33 KD抑制HNSCC細胞克隆形成;
• RBM33 KD顯著抑制異種移植小鼠體內HNSCC的生長。
(6)RBM33和ALKBH5相互依賴以維持HNSCC的致瘤性
• ALKBH5在HNSCC原發腫瘤中的表達遠高于正常鄰近組織;
• ALKBH5 KD可選擇性誘導HNSCC細胞凋亡;
• ALKBH5 KD顯著抑制HNSCC細胞的集落形成能力;
• 在UMSCC-1細胞中,ALKBH5過表達誘導的細胞增殖增加被RBM33 KD阻斷,反之亦然;
• ALKBH5 KD對異種移植小鼠HNSCC體內細胞生長的抑制作用略高于RBM33 KD;
• ALKBH5小分子抑制劑2,4- PDCA顯著抑制了小鼠中人HNSCC患者來源的異種移植物(PDX)的生長

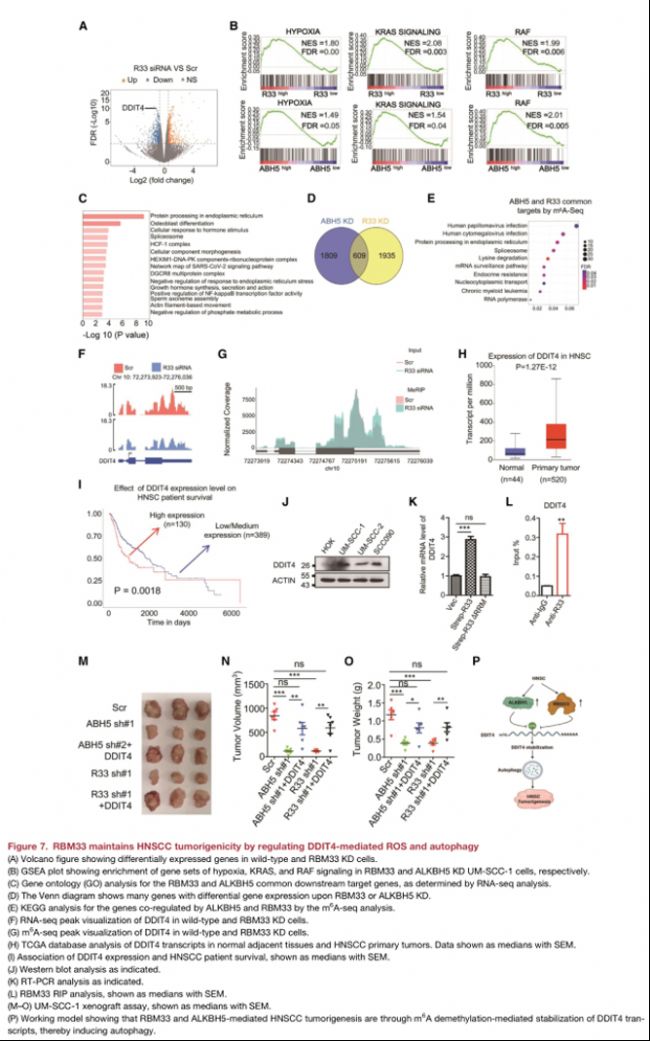
(7)DDIT4在HNSCC中是RBM33關鍵的下游靶點
• 基因集富集分析(GSEA)分析顯示,RBM33或ALKBH5 KD上的下調基因在缺氧、RAS和RAF通路中富集;
• GO分析表明,RBM33和ALKBH5共同調控的基因在內質網中蛋白質剪切途徑中富集;
• RBM33或ALKBH5 KD上m6A甲基化上調的轉錄本也參與內質網中蛋白質加工和剪接體途徑。
• DDIT4在RBM33或ALKBH5 KD上m6A甲基化修飾顯著增加;
• DDIT4的高表達與HNSCC患者的不良預后相關
• DDIT4的轉錄水平被野生型而不是△RRM的RBM33或ALKBH5突變體促進;
• DDIT4促進自噬,RBM33或ALKBH5 KD均能顯著抑制自噬。
• 過表達DDIT4解除RBM33或ALKBH5 KD介導的異種移植小鼠HNSCC生長抑制。
研究結論:
RBM33是一種新的m6A結合蛋白,可與ALKBH5形成復合物。ALKBH5/RBM33 通過特異性去除DDIT4 轉錄本上的m6A修飾、促進DDIT4 RNA 穩定性,促進細胞自噬,進而促進HNSCC 的生長。

參考文獻:
Yu F, Zhu AC, Liu S, Gao B, Wang Y, Khudaverdyan N, Yu C, Wu Q, Jiang Y, Song J, Jin L, He C, Qian Z. RBM33 is a unique m6A RNA-binding protein that regulates ALKBH5 demethylase activity and substrate selectivity. Mol Cell. 2023 Jun 15;83(12):2003-2019.e6.


標題:RBM33 is a unique m6A RNA binding protein that regulates ALKBH5 demethylase activity and substrate selectivity(RBM33是一種特異性m6A RNA結合蛋白,可以調控ALKBH5去甲基化酶活性和底物選擇性)
期刊:Molecular Cell
影響因子:IF 16
技術平臺:PAR-CLIP-seq 、m6A-seq(MeRIP-seq)、RNA-seq、qRT-PCR、WB等
研究摘要:
本研究鑒定出一種以前未被識別的m6A結合蛋白——RBM33,RBM33通過與ALKBH5結合形成復合體,在ALKBH5介導的mRNA m6A去甲基化轉錄本亞群中發揮關鍵作用。RBM33將ALKBH5招募到其m6A標記的底物上,并通過去除其SUMO化來激活ALKBH5去甲基化酶活性。研究進一步證明RBM33對頭頸部鱗狀細胞癌(HNSCC)的腫瘤發生至關重要。RBM33通過招募ALKBH5去甲基化和穩定DDIT4 mRNA來促進自噬,進而促進RBM33在HNSCC細胞中的致癌功能。總之,本研究揭示了在腫瘤發生過程中m6A轉錄本亞群選擇性去甲基化的分子機制,這可能解釋了其他細胞過程中去甲基化的選擇性,并表明了它在維持HNSCC腫瘤發生中的重要性。

圖形摘要
研究設計

(1)RBM33與ALKBH5形成復合體,調控依賴ALKBH5的mRNA m6A甲基化
• LC-MS分析發現ALKBH5是UM-SCC-1細胞中與RBM33相互作用的蛋白質之一;
• 在UM-SCC-1細胞中,內源性ALKBH5可以和內源性RBM33發生相互作用;
• 免疫染色分析顯示,RBM33在細胞中與ALKBH5共定位。
• RBM33不與strep標記的METTL3、METTL14和FTO相互作用;
• 與ALKBH5過表達誘導的m6A去甲基化類似,RBM33過表達導致mRNA m6 A甲基化顯著降低;
• ALKBH5過表達引起的細胞mRNA m6A下調可以被敲低RBM33所逆轉;
• 同樣敲除ALKBH5 可以阻止RBM33過表達所介導的m6A下調。

(2)RBM33是新的m6A結合蛋白,通過RRM結合m6A RNA轉錄本,并招募ALKBH5將其去甲基化
• 內源性RBM33與m6A修飾的RNA底物結合親和力比與未修飾的RNA寡核苷酸的結合親和力高;• 去除RBM33的RRM結構域去除后喪失其與m6A修飾的RNA寡核苷酸結合的能力;
• RIP-Seq顯示近70%的ALKBH5靶基因與RBM33結合。
• 絕大多數RBM33和ALKBH5的共同結合位點位于蛋白質編碼轉錄本和LncRNAs中;
• PAR-CLIP揭示m6A修飾經典序列“RACH”出現在RBM33結合位點;
• 超過50%的RBM33結合位點位于ALKBH5結合位點上游100 nt處;
• RBM33 KD導致1330個RNA轉錄本的m6A修飾上調,其中65%的轉錄本的m6A修飾同樣可以被ALKBH5 敲低所誘導。

• RBM33蛋白中的S1101A或 R1134A顯著破壞了ALKBH5與RBM33之間的相互作用
• ALKBH5中的K132A、E153A或T265A,顯著破壞了ALKBH5與RBM33之間的相互作用。
• RBM33的S1101A和R1134A突變體與野生型RBM33對m6A修飾底物的結合親和力相似;
• RBM33S1101A和RBM33R1134A突變體都失去了調控mRNA m6A甲基化的能力;
• ALKBH5的K132A、E153A和T265A突變體喪失與m6A修飾底物的結合能力;
• ALKBH5的K132A、E153A和T265A突變體喪失m6A去甲基化酶活性。

(4)RBM33通過募集deSUMOylase SENP1激活ALKBH5去甲基化酶活性
• RBM33 KD顯著誘導ALKBH5 SUMOylation;
• RBM33 KD不影響ALKBH5和PIAS4相互作用,但破壞了ALKBH5和SENP1的相互作用;
• RBM33過表達增強了ALKBH5與SENP1的相互作用;
• RBM33與SENP1互作,而SENP1不依賴于ALKBH5。

(5)RBM33通常在HNSCC中上調,并且是腫瘤發生所必需的
• 免疫組化顯示,RBM33在不同階段HNSCC患者原發腫瘤中的表達高表達;
• RBM33 KD特異性誘導HNSCC細胞凋亡并抑制其克隆形成;
• RBM33 KD抑制HNSCC細胞克隆形成;
• RBM33 KD顯著抑制異種移植小鼠體內HNSCC的生長。

(6)RBM33和ALKBH5相互依賴以維持HNSCC的致瘤性
• ALKBH5在HNSCC原發腫瘤中的表達遠高于正常鄰近組織;
• ALKBH5 KD可選擇性誘導HNSCC細胞凋亡;
• ALKBH5 KD顯著抑制HNSCC細胞的集落形成能力;
• 在UMSCC-1細胞中,ALKBH5過表達誘導的細胞增殖增加被RBM33 KD阻斷,反之亦然;
• ALKBH5 KD對異種移植小鼠HNSCC體內細胞生長的抑制作用略高于RBM33 KD;
• ALKBH5小分子抑制劑2,4- PDCA顯著抑制了小鼠中人HNSCC患者來源的異種移植物(PDX)的生長

(7)DDIT4在HNSCC中是RBM33關鍵的下游靶點
• 基因集富集分析(GSEA)分析顯示,RBM33或ALKBH5 KD上的下調基因在缺氧、RAS和RAF通路中富集;
• GO分析表明,RBM33和ALKBH5共同調控的基因在內質網中蛋白質剪切途徑中富集;
• RBM33或ALKBH5 KD上m6A甲基化上調的轉錄本也參與內質網中蛋白質加工和剪接體途徑。
• DDIT4在RBM33或ALKBH5 KD上m6A甲基化修飾顯著增加;
• DDIT4的高表達與HNSCC患者的不良預后相關
• DDIT4的轉錄水平被野生型而不是△RRM的RBM33或ALKBH5突變體促進;
• DDIT4促進自噬,RBM33或ALKBH5 KD均能顯著抑制自噬。
• 過表達DDIT4解除RBM33或ALKBH5 KD介導的異種移植小鼠HNSCC生長抑制。

研究結論:
RBM33是一種新的m6A結合蛋白,可與ALKBH5形成復合物。ALKBH5/RBM33 通過特異性去除DDIT4 轉錄本上的m6A修飾、促進DDIT4 RNA 穩定性,促進細胞自噬,進而促進HNSCC 的生長。

參考文獻:
Yu F, Zhu AC, Liu S, Gao B, Wang Y, Khudaverdyan N, Yu C, Wu Q, Jiang Y, Song J, Jin L, He C, Qian Z. RBM33 is a unique m6A RNA-binding protein that regulates ALKBH5 demethylase activity and substrate selectivity. Mol Cell. 2023 Jun 15;83(12):2003-2019.e6.
標簽:
RNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





