從細胞交替到心室顫動自發轉變的機制見解
以往的臨床研究表明,T波交替(TWA)與心臟疾病如長QT綜合征、急性心肌梗死、心力衰竭和多形性室性心動過速有關,增加了心律失常發生的風險。在細胞水平上,TWA可歸因于動作電位交替(AP交替)和/或胞內鈣瞬變(CaT交替),而在組織水平上,AP交替可表現為空間一致性和/或不一致性傳導交替(SCA/SDA)。就其性質而言,SDA有可能產生比SCA更大的空間復極化離散,從而導致單向傳導阻滯,發生折返。
SCA和/或SDA誘發心律失常的機制可能是由于SCA/SDA誘導的心臟組織功能異質性增強了原有的組織異質性,導致心律失常易感性增加。然而,一些實驗和模擬研究表明,預先存在的組織異質性可能不是SDA形成預測心律失常所必需的。有研究表明,APD的急劇恢復和傳導速度(CV)的恢復、細胞內鈣不穩定及自主神經系統的調節等動態特性可將SCA轉化為SDA,從而促進心律失常的發生。
以往的實驗研究證實,SDA增強了組織中的電異質性,形成了一種促心律失常發生的底物,促進了興奮折返的形成。在這些研究中,額外的期前刺激(模擬異位灶、DAD或EADs)應用在折返研究。在不涉及期前興奮、特別是在復極受損的情況下,細胞交替自發轉變為心室顫動(VF)的潛在機制尚不清楚。模擬研究預測,在一個有INa缺陷的組織中,從細胞電交替到組織水平的興奮折返的自發轉變是可能的,但缺乏支持這一預測的實驗證據。
本文研究了 TWA 與心臟猝死之間的關系及其機制。在這項研究中,使用了全細胞膜片鉗和熒光標測技術,用E-4031(抑制IKr)處理以模擬急性復極延長的條件,觀察了其對細胞和組織水平上TWA的影響。
結論:
復極延長時,心室肌細胞和離體豚鼠心臟中的AP交替更容易誘發。復極化受損時,心臟交替更穩定,更容易從SCA過渡到SDA,可能是動作電位時程(APD)恢復和傳導速度(CV)恢復曲線更陡的原因。
傳導交替增加了組織區域APD/CaT的空間異質性,APD/CaT離散度增強,導致傳導延長或阻滯增加心律失常的易感性。
該研究提供了關于TWA自發轉變為心室顫動潛在機制的實驗證據,特別是在E-4031藥物處理、不涉及期前興奮條件下。這有助于解釋在不需要EAD/DAD或異位起搏觸發的前提下,復極化受損時會導致室性心律失常易感性的增加。
關鍵詞:
心律失常、復極化受損、熒光標測、膜片鉗、空間不一致交替、心源性猝死、t波交替
結果:
3.1在細胞水平上出現AP交替
圖1展示了從健康豚鼠心室肌細胞中記錄的細胞膜動作電位(APs)以及E-4031對其APD的影響。E-4031延長APD,增加了動作電位交替的程度。動作電位交替的發生與刺激頻率有關,通過APD恢復曲線來展示。統計分析結果表明,E-4031給藥增加了動作電位交替的幅度和刺激周期長度(PCL)閾值,提示在復極化受損時AP交替更容易誘發且幅度增加。
E-4031干預增加了動作電位交替的穩定性。隨著E-4031濃度增加,APD恢復曲線的最大斜率和有效不應期也增加,與APD延長程度呈正相關。
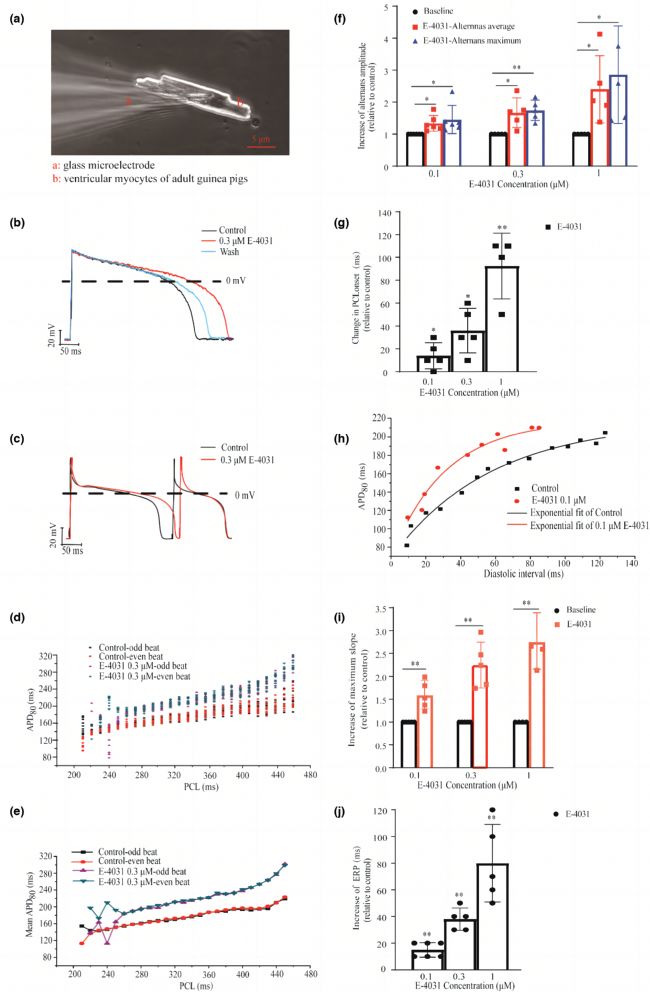
圖1 在正常和復極延長條件下產生的AP交替。
在本研究中,通過使用膜片鉗和熒光標測技術,測量了細胞和組織水平上動作電位和細胞內鈣交替。結果顯示,給予E-4031后,APD延長,使得動作電位交替的閾值增加,并且交替易感窗口增大。動作電位的延長促進了交替的發生,且在更大的刺激周期長度處誘導動作電位交替。
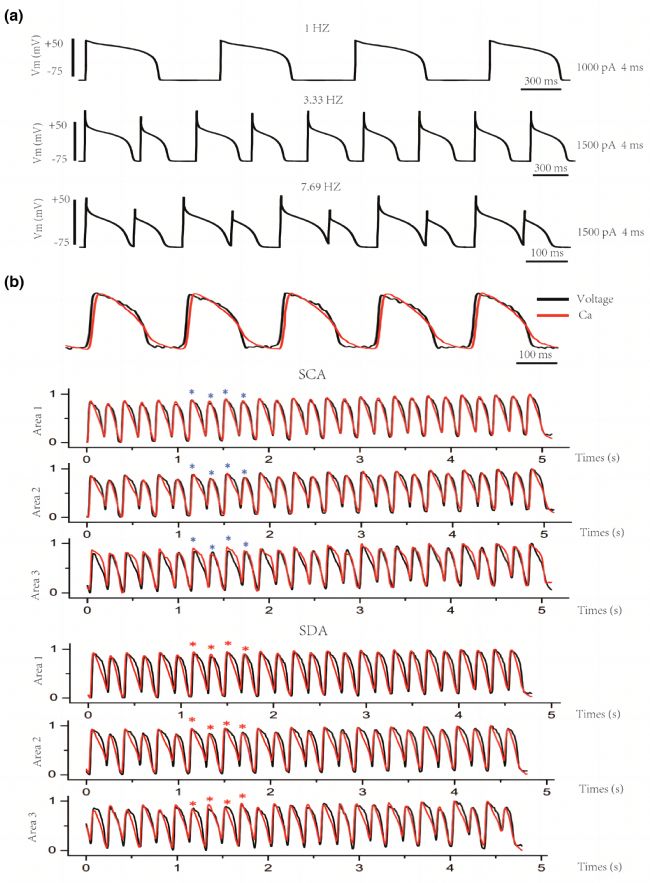
圖2 在細胞和組織水平上,采用膜片鉗和熒光標測技術給予S1S1刺激出現的AP和Ca交替。
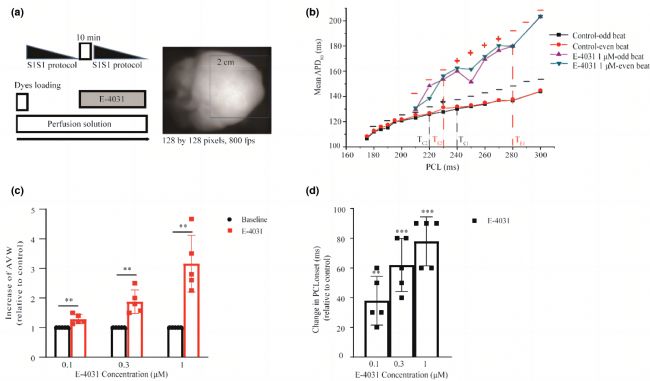
圖3 正常和復極延長組的AP交替。
圖4展示了細胞水平上的動作電位交替在組織水平上表現為傳導交替,這可能會導致折返的發生。正常組中,動作電位在整個組織中傳導的模式是有規律的,但在E-4031條件下,傳導異質性增加,導致局部傳導阻滯。圖4b中進一步展示了傳導阻滯的發生。CV恢復曲線的斜率與SDA和自發性心律失常的發生有關,E-4031條件下CV恢復曲線更陡峭,而最大斜率與動作電位延長程度呈正相關關系。這些結果揭示了陡峭的CV恢復曲線是導致SDA和自發性心律失常的關鍵因素。細胞水平上的動作電位交替會在組織水平上導致傳導交替和傳導阻滯,進而導致VF的發生。
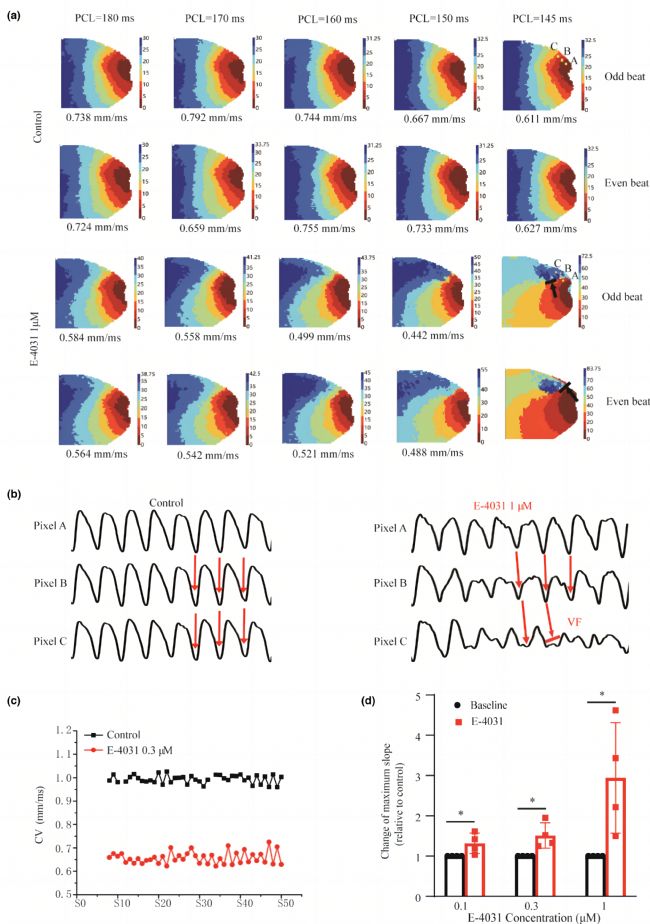
圖4 在組織水平上,正常組和E-4031條件下AP傳導模式及傳導阻滯的標測。
進一步分析了APD和細胞內鈣離子濃度(CaD)在動作電位傳導交替形成時組織水平上的時空異質性。通過在三個不同傳導途徑(左心室邊界、心臟中間和右心室邊界)沿十個記錄點測量APD和CaD數據,結果發現APDsmall(前五個APD的平均值)和APDlarge(后五個APD的平均值)之間存在顯著差異,且時空變化明顯。隨著PCL減小,空間異質性更加明顯,同時給予1μM E-4031處理后,APD變化更為顯著。有趣的是,復極化受損條件下,在右心室邊界基底附近的區域,APD空間異質性更為明顯。較快的刺激頻率(PCL為240ms)下,復極化受損導致右心室邊界基底附近的APD顯著減小,并在PCL為230ms時導致傳導阻滯,進而自發形成心室顫動。
同時,細胞內鈣離子濃度的空間異質性也受復極化受損的影響。在不同PCL條件下,觀察到鈣離子濃度的空間異質性增加。在PCL為230ms時,RV邊界基底附近出現顯著的空間異質性,伴隨心室心律失常的發生。研究結果表明,鈣離子濃度的時空異質性比動作電位更為顯著,這可能在心律失常形成中扮演重要角色。

圖5 在正常組和E-4031條件下,組織水平的APD和CaD空間異質性。
3.5 在復極化受損的過程中,APD和CaD的空間離散度增強
我們進一步分析了在形成空間不一致性動作電位(AP)和細胞內鈣離子(Ca)交替時,是否加重復極化受損AP/Ca的空間異質性。測量并分析了不同刺激周期下最后38次的動作電位持續時間(APD80)和細胞內鈣離子濃度(CaD80)。結果發現,在給予1μM E-4031處理后,出現持續的APD和CaD,且在E-4031條件下,逐拍APD和CaD變化的幅度增加。此外,給予E-4031后,APD和CaD的空間離散度明顯增加,且與APD延長程度呈正相關。隨著刺激頻率的增加,E-4031處理后APD和CaD空間離散度的增加趨勢更明顯,暗示了心律失常易感性的增加。
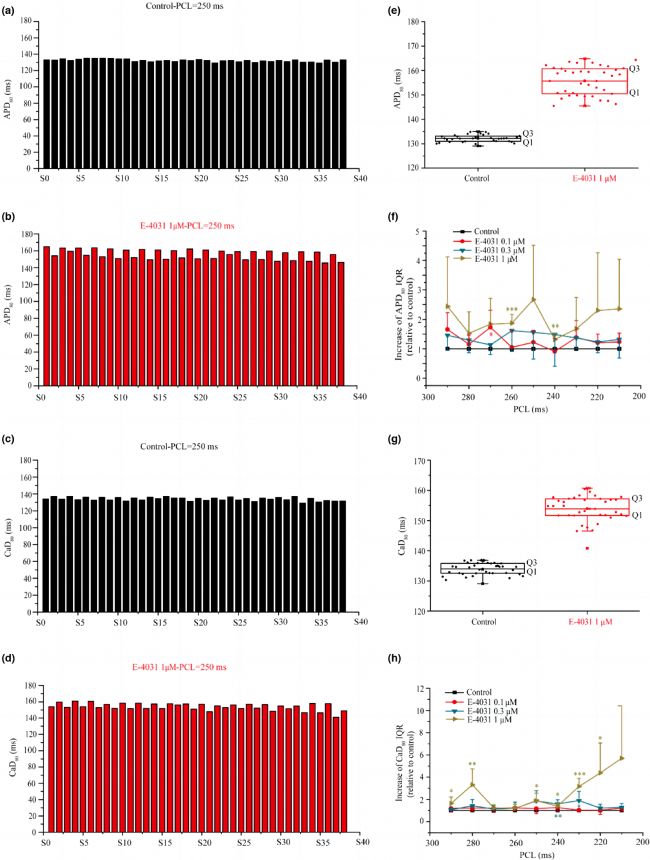
圖6 復極化受損增強了離體心臟中APD和CaD的空間離散度。
3.6 |復極化受損時室性心律失常易感性增加
最后,采用光學標測技術評估復極化受損對心律失常易感性的影響。圖7a展示了在對照組和給予1μM E-4031處理下,不同PCL(160ms、150ms和140ms)時從整個標測組織中記錄的代表性13拍動作電位(AP)。通過兩個連續APD的差異,發現動作電位交替現象在給予1μM E-4031處理后更為明顯。在對照組,AP交替發生在PCL = 232.0±32.7ms,但未觀察到心律失常。給予1μM E-4031后,AP交替發生在PCL = 310.0±28.3ms,表明易感性增加。在PCL = 132.5±16.0ms時,4個心臟出現心室顫動,形成傳導阻滯。圖7b和7c顯示了不同處理條件下連續5拍的AP激活傳導模式,其中給予1μM E-4031處理后傳導明顯受干擾,導致傳導阻滯和激動折返。綜合來看,復極化受損與心律失常易感性增加相關。這些結果揭示了復極化受損對心律失常發生的潛在影響。
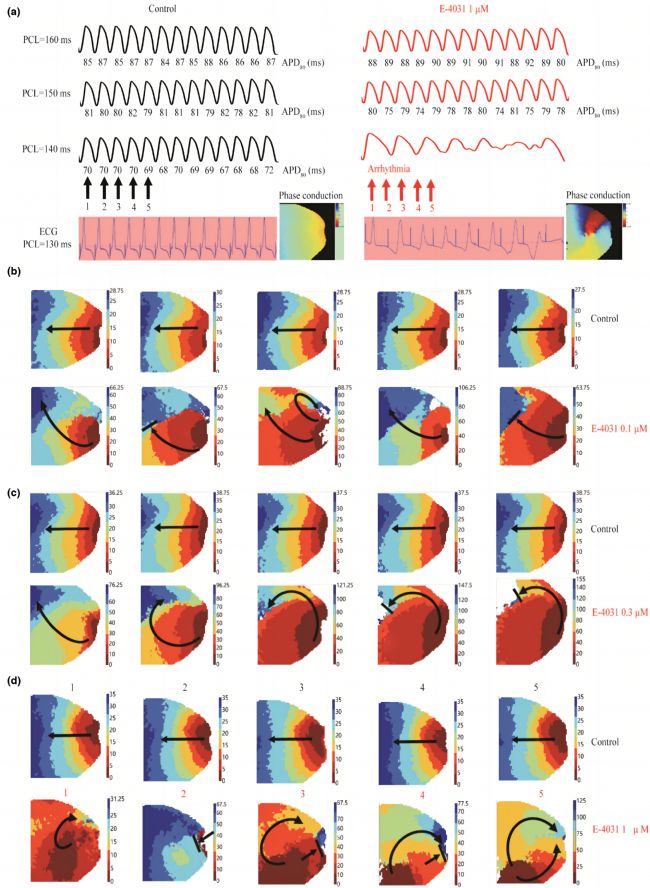
圖7 復極化受損時,室性心律失常易感性增加。





