肝臟模型的3D共培養及其在藥物研究中的應用
肝臟是人體最大的消化腺,負責合成、代謝、分解、解毒等500多種功能。它主要由肝細胞和非實質細胞組成,如肝竇內皮細胞(LSECs)、肝星狀細胞(HSCs)和Kupffer細胞(KCs),它們通過直接或間接的細胞串擾事件共同調節肝功能。
體外肝臟模型,包括2D和3D肝細胞單一培養和共培養模型,在成本、倫理考慮和效率方面比動物模型具有優勢。然而,2D肝細胞模型缺乏生理相關性,而3D肝細胞單一培養模型無法代表實質和非實質細胞之間的復雜相互作用。因此,模擬天然肝組織結構和細胞相互作用的3D共培養肝臟模型的開發為更準確地體外預測人類藥物反應敏感性提供了潛力。以前常用的預測工具往往無法可靠地預測藥物在人體中的療效和毒性,導致藥物開發中的高損耗率。3D細胞共培養肝臟模型可以更好地預測人類藥物反應,并已在許多研究中用于預測候選或上市藥物的體內代謝和清除。
在遵義醫科大學基礎藥理教育部重點實驗室、英國癌癥研究中心曼徹斯特研究所的一項聯合研究中,在討論肝臟原代實質和非實質細胞的獨特結構和功能的基礎上,分析了3D細胞共培養肝臟模型在藥物研究中的潛在優勢;然后介紹了3D細胞共培養肝臟模型中肝細胞的主要來源以及構建3D細胞共培養肝臟模型的常用方法;最后討論了具有不同功能的3D細胞共培養肝臟系統及其應用。

肝臟的主要細胞成分及其功能
具有六邊形結構的肝小葉構成了肝臟的基本結構和功能單位(圖1)。中央靜脈貫穿每個小葉的中心,負責運輸肝內代謝物。小葉周圍是門靜脈三聯體,由肝門靜脈、肝動脈和膽管組成。肝門靜脈將營養豐富的血液輸送到肝臟,而肝動脈則向肝臟供氧。
肝細胞是肝臟中最豐富的細胞類型,它們形成從中央靜脈向外輻射的肝細胞板。相鄰的肝板之間所形成的腔隙,就是肝臟非常重要的生理解剖結構,即肝血竇。膽小管由兩個鄰近的肝細胞之間的間隙所形成,能夠分泌、輸送膽汁。肝小葉的結構和功能是由各種肝細胞之間復雜的相互作用所調節的。

圖1 肝小葉結構示意圖。
3D細胞共培養肝臟模型在藥物評估中的潛在優勢
3D系統可以是自聚集的細胞球體,由天然或合成材料制成的細胞外基質(ECM)樣3D網絡支架,以及使用3D技術構建的器官樣系統,其具有氧氣,營養物質和各種生物因子梯度和3D組織結構,可以發生細胞-細胞和細胞-ECM相互作用。這種培養模式更接近體內復雜的微環境,在很大程度上有助于改善體外肝細胞的功能活性。
然而,人們逐漸意識到,3D肝細胞單一培養模型忽略了肝組織中異型細胞的直接或間接信號交換。因此,整合肝異型細胞相互作用和3D微環境信號傳導的3D共培養肝臟模型脫穎而出,具有許多優點。多項研究表明,在藥物誘導的肝毒性、肝藥物代謝和藥物相互作用研究中,3D 細胞共培養肝臟模型比 2D 和 3D 單培養和 2D 共培養表現出更好的預測能力,因為 3D 細胞共培養中的細胞生長環境和異型細胞之間的信號調控使它們在體內表現出更相關的肝臟環境和表型,如可復制的肝竇結構、肝細胞活性和功能的長期維持、以及與肝臟特異性功能相關的基因表達的增加。Al Hrout等人構建的肝癌細胞和成纖維細胞的3D共培養模型,與肝癌細胞的2D或3D單培養相比,肝癌細胞發展相關的基因和蛋白質的表達增加,預后較差,且更接近肝癌在體內的發育特征,有助于更準確地評估體外抗癌藥物的抗癌作用。總之,3D細胞共培養肝臟模型可有效提高肝細胞體外功能穩定性,保證體外藥物預測結果的可靠性,有望為藥物研究提供可靠的新平臺。
3D細胞共培養肝臟模型的肝細胞來源
1. 原代肝細胞
原代肝細胞(PHs)被廣泛認為是構建體外肝臟模型的金標準,動物和人源肝細胞都被使用。特別是原代人肝細胞(PHHs),由于其分泌特性和代謝酶活性與體內肝細胞相當,能夠可靠地反映體內肝臟特性,因此在藥物相互作用、藥物代謝和藥物毒性研究中受到研究人員的青睞。然而,其功能特性的穩定表達高度依賴于微環境的信號調控,這意味著PHHs在單一的2D環境下會迅速經歷表型變化、細胞活性下降和細胞膜極性喪失。為了增強PHHs的功能活性,有研究分別利用由Matrigel和3D生物打印模型組成的3D培養環境對PHHs的體外培養條件進行了改進。這些研究表明,PHHs可以維持其形態和功能數月,并改善對肝毒性藥物的敏感性。
2. 肝癌細胞系
HepaRG、HepG2、Huh7和Hep3B是用于構建體外肝臟模型的常見肝細胞癌來源細胞系,因為它們易于獲得、易于培養、增殖性高且表型穩定,與PHHs相比,供體間變異性較小。然而,這些細胞系的高增殖潛力通常伴隨著低分化表型,這導致缺乏特定的肝功能,特別是在酶表達水平(特別是參與藥物代謝的I期和II期代謝酶)、蛋白質和尿素合成方面,以及對毒性反應的敏感性遠低于PHHs。
3. 干細胞
人誘導多能干細胞(HiPSCs)、胚胎干細胞(ESCs)和成體干細胞(ASCs),如間充質干細胞、肝臟干細胞和造血干細胞,在體外表現出強大的自我復制和自我更新能力。特別是HiPSCs和ESCs,在某些條件下具有分化成人體中幾乎任何細胞類型的潛力。此外,HiPSCs可以從患者活檢中獲得,用于個性化研究。在全球肝臟供體稀缺的背景下,在特定條件下能夠分化成肝細胞樣細胞的干細胞可以作為肝病治療,再生和體外建模的潛在資源.然而,干細胞在體外很難分化成功能成熟的肝細胞,并且可能存在免疫排斥和資源短缺等挑戰。
3D細胞共培養肝臟模型的常用共培養方法
1. 直接 3D 共培養
直接3D共培養涉及將兩種或多種不同類型的肝細胞混合成自組裝球體,或在模擬天然肝組織結構的3D環境中將它們一起培養(圖2)。直接 3D 共培養允許不同肝細胞之間的密切接觸,從而通過直接細胞-細胞粘附、可溶性細胞因子的旁分泌、細胞-ECM 粘附和其他機制實現它們之間的信號通信。在像肝臟這樣的多細胞器官中,異型細胞之間的直接接觸在肝功能的充分發揮中起著重要作用。然而,在決定直接共培養的合理性時,重要的是要考慮體內肝組織中共培養細胞的實際分布。在體內通常沒有直接接觸的細胞類型的體外直接接觸共培養可能是不必要的。此外,異型細胞之間的緊密連接也會影響細胞分離的難度,這對于需要單細胞類型分析的實驗可能是不利的。因此,使用直接共培養的決定應基于共培養細胞的類型和實驗目的。
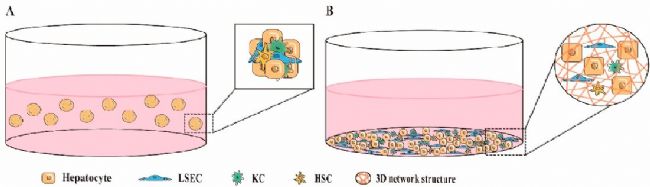
圖2 直接3D細胞共培養肝臟模型的示例。
(A)混合細胞球狀共培養系統。(二)3D支架共培養。
2. 間接 3D 共培養
間接 3D 共培養涉及在具有物理分離系統的3D環境中培養兩種或兩種以上類型的肝細胞(圖3),不允許存在于物理分離系統兩側的細胞之間直接接觸,它們之間的信號通過可溶性細胞因子進行通信。物理分離系統的常見材料是Transwell細胞培養板和各種天然或合成材料。此外,一些研究人員還利用3D生物打印技術實現了HepG2和NIH/3T3成纖維細胞的間接3D共培養。他們證明,與HepG2的單培養相比,HepG2和NIH/3T3成纖維細胞的共培養表現出更好的肝細胞功能。間接共培養系統可以有效避免不必要的細胞接觸,促進共培養異型細胞的分離,并可能成為研究體內非接觸性肝細胞通訊的有前途的工具。
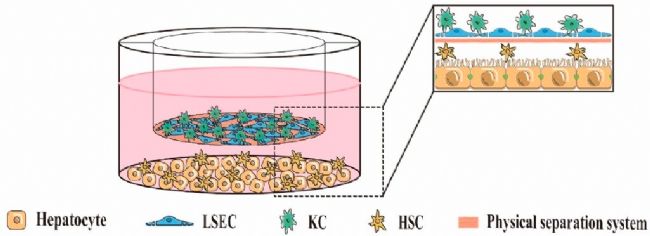
圖3 間接3D細胞共培養肝臟模型的示例。
3D細胞共培養肝臟模型的類型
1. 增強肝細胞功能的3D細胞共培養模型
在肝組織中,肝細胞被LSECs 形成的肝竇網絡包圍,作為肝細胞內物質交換的基礎,對維持肝細胞活性和功能穩態至關重要。LSECs和肝細胞的體外共培養已被證明能夠實現血管化的3D肝組織結構,其中血管樣管狀網絡的存在提供營養和氧氣,以支持體外肝細胞的功能并維持代謝廢物的消除。此外,LSECs可通過Id1通路誘導血管分泌因子Wnt2和肝細胞生長因子(HGF)上調,這兩者都對肝細胞增殖至關重要。總之,在3D環境下,LSECs與肝細胞共培養可以重現體內肝竇的關鍵結構,這對體外增強肝細胞功能的研究具有重要意義。
2. 肝纖維化的3D細胞共培養模型
肝纖維化是一種肝臟疾病,其特征是肝臟中積累過多的細胞外基質蛋白。近年來開發了一系列與體內相關的3D細胞共培養肝纖維模型。體內肝纖維化受多種肝細胞調節,包括HSCs、肝細胞、LSECs 和KCs。然而,目前肝纖維化的共培養模型有限,只有少數研究報告了LSECs與HSCs、肝細胞和/或KCs的共培養,以建立肝纖維化的體外模型。因此,未來的研究必須將不同類型的肝細胞整合到3D環境中進行共培養,以構建更具代表性的肝纖維化體外模型。
3. 藥物性肝損傷的3D細胞共培養模型
肝細胞由于其獨特的功能活性,通常被用作藥物篩選模型的金標準。然而,KCs作為肝臟駐留巨噬細胞群的作用不容忽視,特別是在免疫介導的藥物誘導性肝損傷中,因為它們具有有效的清除和吞噬功能。KCs在肝毒性反應中起著至關重要的作用,包含肝細胞和KCs的3D共培養系統有可能為未來臨床前藥物誘導的肝毒性評估提供更準確和有效的工具。然而,需要更多的研究來確認這些共培養系統在毒性藥物篩選中的一般應用的功能特性。
總之,具有更復雜的細胞通訊和微環境特征的3D細胞共培養肝臟模型將成為未來藥物開發和篩選研究的有力工具,提高體外藥物評價數據的可靠性。解決肝細胞體外培養條件的挑戰并進一步開發肝臟ECM樣細胞培養系統和微流控芯片是朝著這個方向邁出的重要一步。
參考文獻:Ma Y, Hu L, Tang J, Guo W, Feng Y, Liu Y, Tang F. Three-Dimensional Cell Co-Culture Liver Models and Their Applications in Pharmaceutical Research. Int J Mol Sci. 2023 Mar 26;24(7):6248. doi: 10.3390/ijms24076248. PMID: 37047220; PMCID: PMC10094553.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/37047220/
我們的官網:http://www.naturethink.com/
小編旨在分享、學習、交流生物科學等域的研究進展。如有侵權或引文不當請聯系小編修正。
微信搜索公眾號“Naturethink”,了解更多細胞體外仿生培養技術及應用。
血流刺激滋養細胞-內皮細胞共培養裝置
http://www.xhtechnology.cn/show1equip4891727.html
動脈壁面剪切力多細胞共培養裝置
http://www.xhtechnology.cn/show1equip4891724.html
仿動脈血流多細胞共培養裝置
http://www.xhtechnology.cn/show1equip4891719.html





