mRNA 疫苗的優點及在癌癥領域的最新研究進展
2019 年底,新冠病毒席卷全球,疫苗成為全民關注的焦點,各類創新技術紛紛助力疫苗的開發。其中,mRNA 疫苗一鳴驚人,成為新冠疫苗的領跑者,貢獻了舉足輕重的力量。但隨著疫情的全面放開, 人們不禁開始疑惑,mRNA 疫苗會不會從此銷聲匿跡了呢?

核酸疫苗的想法其實早在幾十年前就已提出,新冠病毒極大地推動了 mRNA 疫苗的發展。2021 年,輝瑞向全球提供了 22 億劑 mRNA 新冠疫苗,銷售額達 367.8 億美元,占全年收入的 53.44 %。除了對抗 SARS-CoV-2,mRNA 疫苗還有頗多用處,如預防巨細胞病毒 (CMV)、寨卡病毒、呼吸道合胞病毒 (RSV)、流感病毒、狂犬病毒等病原體感染以及開發預防性和治療性癌癥疫苗等。
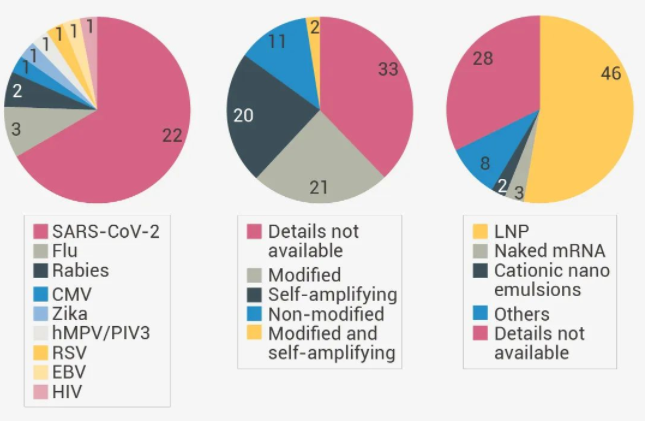 圖 1. mRNA 疫苗開發及臨床靶點
圖 1. mRNA 疫苗開發及臨床靶點 和傳統疫苗相比,RNA 能夠直接與模式識別受體 (PRR) 相互作用 (無需額外的佐劑),驅動體液免疫及細胞免疫雙重作用機制,且不會刺激任何抗因子免疫,安全性更好。

mRNA 疫苗本身不含有完整的病毒,其主要根據病毒的基因序列使用體外轉錄合成,可快速開發出新型候選疫苗。通常來講,mRNA 的體外合成遵循以下幾個步驟:模板生產、體外轉錄、mRNA 加帽、mRNA 加尾、純化/質檢。
其中,體外轉錄可以說是 mRNA 研究中經典的一步,提高加帽 mRNA 得率,減少模板 DNA 的殘留,是體外合成加帽 mRNA 始終追求的。利用含有 T7 啟動子序列的 DNA 為模板在 T7 RNA 聚合酶的條件下,以 NTP 為底物合成與模板 DNA 中一條鏈互補的 mRNA,簡單快速獲得大量的 mRNA 分子,再通過在 5? 端加上帽子結構和 3? 端加 Poly(A) 尾加強 mRNA 的穩定性。

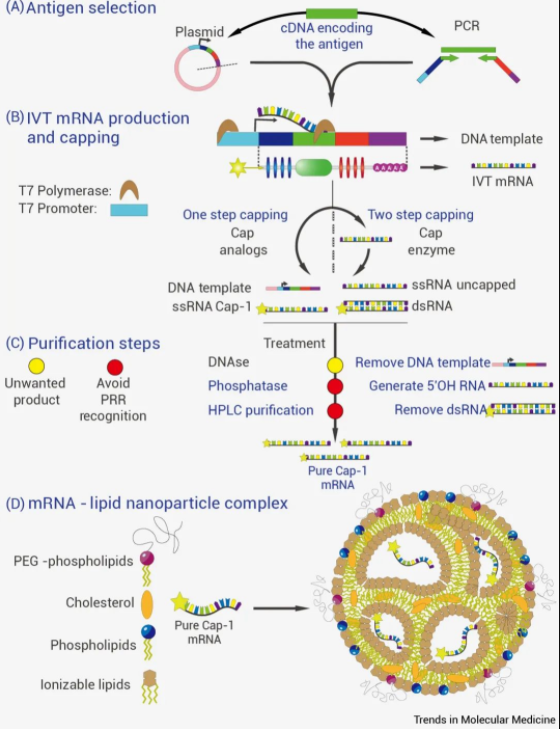 圖 2. 體外轉錄 (IVT) mRNA 生產和裝配過程
圖 2. 體外轉錄 (IVT) mRNA 生產和裝配過程 A) 編碼目標致病抗原:
cDNA 序列用于詳細說明轉錄載體或 PCR 片段,包括完整的 mRNA 信息和上游 T7 RNA 啟動子。
B) IVT mRNA 產生和加帽:
線性化質粒或 PCR 產品使用 T7 RNA 聚合酶進行 IVT-mRNA 生產。在存在 CAP 類似物 (ARCA,Clean-Cap) 的情況下,在轉錄過程中一步實現 mRNA 加帽,或者在 IVT-mRNA 產生后通過酶促加帽反應分兩步實現。
C) 純化步驟:
純化含有 DNA 模板、雙鏈 RNA (dsRNA) 以及加帽和未加帽的單鏈 RNA (ssRNA) 的反應產物。在純化過程中,用 DNase 處理去除 DNA 模板,將 5' ppp 未加帽的 RNA 去磷酸化為 5' OH RNA,通過 HPLC 純化丟棄 dsRNA,以獲得目標 mRNA 的純均質溶液。
D) mRNA 納米復合物形成:
用于高效的細胞遞送和轉錄本的翻譯。其中 mRNA 被包裹在脂質納米顆粒核心的內部液滴中,既能防止 RNase,又能有效輸送到胞質溶膠。

編碼腫瘤相關或腫瘤特異性抗原的合成 mRNA 可通過體外 mRNA 改造的自體樹突細胞、或通過配制或非配制的 mRNA 進行注射遞送。一些基于 mRNA 的癌癥疫苗治療研究正在進行。
2023 年 4 月,發表在 Cancer Discov 一篇題為“mRNA Vaccine Slows Melanoma Recurrence”的文章揭示了黑色素瘤疫苗——mRNA-4157 的重磅研究進展。mRNA-4157 的臨床 2b 期試驗 (KEYNOTE-942) 發現聯合治療可將黑色素瘤患者在腫瘤完全切除后的復發或死亡風險顯著降低 (44%)。該疫苗已經于 2023 年 2 月被美國食品藥品管理局 (FDA) 授予突破性療法認定,用于完全切除后的高危黑色素瘤患者的輔助治療。
同年 5 月 ,發表在 Nature 雜志上的一項研究表明,個性化 mRNA 疫苗 Cevumeran 與其他療法 (Atezolizumab 和 mFOLFIRINOX (化療藥物)) 聯合使用時,可顯著誘導免疫響應,并可能延遲胰腺癌患者的復發。
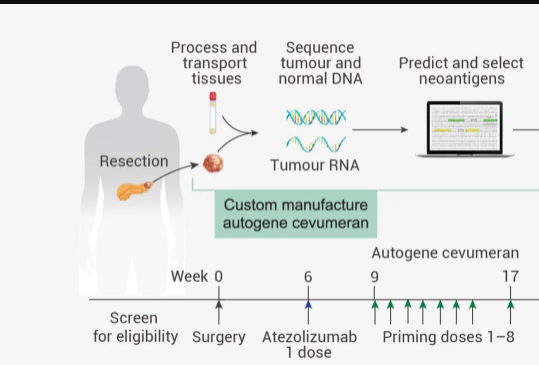
圖 3. 個體化 mRNA 新抗原疫苗的試驗設計圖
此外,Huang 等人的研究發現了開發抗胰腺癌 (PAAD) mRNA 疫苗中的 6 種有效抗原WNT7A、ADAM9、MET、EFNB2、TPX2 和 TMOD3。同時,CV9201,一種基于 RNActive? 的癌癥免疫療法,編碼 5 種 NSCLC 抗原。其在臨床 I/IIa 期劑量遞增實驗中對局部晚期或轉移性 NSCLC 患者表現耐受性良好,治療后可觀察到免疫應答。

本文給大家簡要介紹了 mRNA 疫苗的優點、mRNA 體外合成技術以及 mRNA 疫苗在癌癥領域的最新研究進展。MCE 可提供 mRNA 體外合成所需的一系列底物和酶產品,助力 mRNA 研究,更多詳情可查看官網~
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





