爪蟾卵母細胞中電壓鉗技術檢測通道蛋白和受體蛋白

電壓鉗(voltageclamp)又叫電壓鉗制或電壓固定,該技術由Cole和Marment設計,后經Hodgkin和Huxley改進并成功地應用于神經纖維動作電位的研究。
其設計原理是根據離子作跨膜移動時形成了跨膜離子電流(I),而通透性即離子通過膜的難易程度,其膜電阻(R)的倒數,也就是膜電導(G)。因此,膜對某種離子通透性增大時,實際上時膜電阻變小,即膜對該離子的電導加大。根據歐姆定律V=IR,即I=V/R=VG,所以,只要固定膜兩側電位差(V)時,測出的跨膜電流(I)的變化,就可作為膜電導變化的度量,即可了解膜通透性的改變情況。
目前電壓鉗技術在爪蟾卵母細胞中應該得非常成熟,成為研究各種離子通道蛋白或者轉運體蛋白的重要技術,其中水通道蛋白、K離子通道蛋白、Na離子通道蛋白、糖轉運蛋白、氨基酸轉運蛋白以及一些氣味受體均可用此技術進行機制研究。
卵母細胞表達體系優點:
(1)異源表達其他物種通道蛋白,不受其他物種另外蛋白以及電源的影響,利于單獨研究此蛋白功能;
(2)爪蟾卵母細胞量多且獲得率高,爪蟾也不需處死,可以反復使用;
(3)卵母細胞體外培養方法簡單,且可以異源表達其他各類物種的基因;
(4)表達簡單,不用像其他動物、植物物種需要進行載體轉化,直接注射RNA進入卵母細胞的細胞質中即可表達;
(5)卵母細胞體積大,本身離子通道較少,對研究影響較小;
下列給大家介紹我們做過的2種電壓鉗實驗:離子通道研究以及受體研究。
1.載體構建
注入爪蟾卵母細胞中的是目標基因的RNA,因此需要我們在體外合成RNA。我們需要構建載體,進行體外cRNA合成實驗,載體有多種,常見的有pGEMHE等,此類載體通常會融合表達GFP、mCherry等熒光蛋白,用于后續實驗中。
2.體外轉錄cRNA
- 大提擴繁的A-pGEMHE-mCherry質粒先進行酶切線性化;
- 線性化后的質粒純化后,使用T7體外轉錄試劑盒(mMESSAGE,Invitrogen),轉錄獲取cRNA;
- 利用試劑盒配套的DNaseI 消化DNA模板,并用LiCl法純化cRNA,除鹽;
3.顯微注射cRNA
(1)獲取非洲爪蟾的卵細胞,利用30 mg/ml collagenase D (Roche) 酶解(22℃,1-1.5h)去除卵細胞表面的囊膜;
(2)挑選IV-VI期,即成熟卵細胞,使用顯微注射系統,注入cRNA:
Control:30nl H2O (Nuclease-free) / cell A: 30nl / cell
(3)注射后卵細胞在Ringer 溶液中孵育36h,16℃,及時剔除死卵,更換新鮮溶液
4.熒光表達檢測
利用熒光共聚焦顯微鏡(Leica SP8 Laser confocal microscope (Leica, GER))檢測蛋白表達情況。GFP熒光使用512 nm激光激發,mCherry 熒光使用546 nm激光激發。
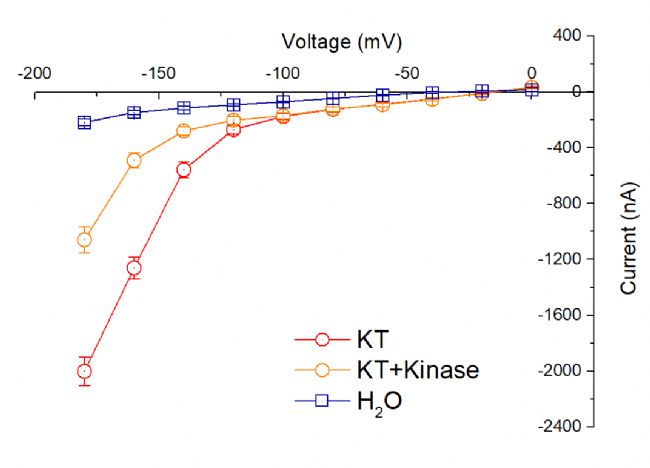
5.電壓鉗檢測Kinase激酶影響離子通道,數據統計
- Control
- KT組
- KT+Kinase組
6.電壓鉗檢測各種溶液對A受體蛋白的影響,數據統計
(1)空白組
(2)A組
針對上述2組卵母細胞進行溶液的灌流,統計電流。[1]
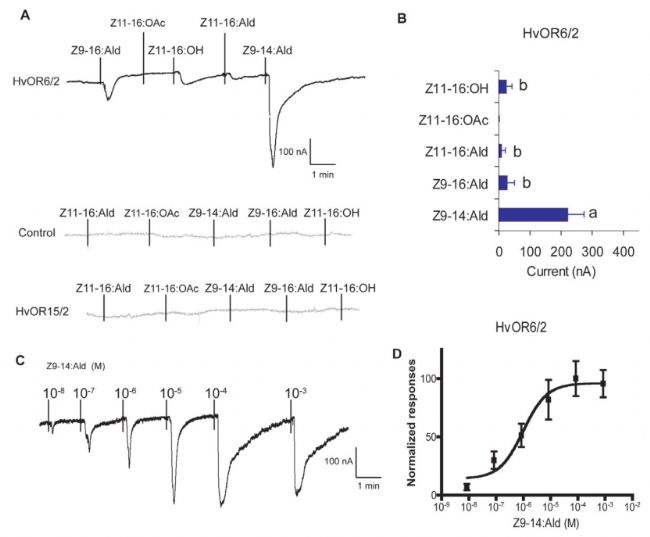
結論:Z9-14:Ald溶液明顯有電流產生,表示A蛋白可能是Z9-14:Ald溶液的受體蛋白。
參考文獻:
Wang G , GM Vásquez, Schal C , et al. Functional characterization of pheromone receptors in the tobacco budworm Heliothis virescens[J]. Insect Molecular Biology, 2011, 20(1):125-133.
電壓鉗技術還可以檢測更多其他蛋白和蛋白之間的作用,我們也做了很多種類,此處就不再一一列舉,希望大家有所了解后,可以在研究中充分利用此技術,結合其他蛋白互作、蛋白磷酸化等技術,更加充分的闡述相關作用機制。
標簽:
電壓鉗檢測
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





