電轉化儀難轉染細胞電轉染方案的系統優化方法操作詳解
電穿孔是用于轉移非病毒載體以及將其他分子(DNA、藥物、RNA 或蛋白質)引入靶細胞的技術之一。這種方法通過對細胞施加短持續時間和高電壓的電場,當電脈沖超過膜電容時,其穩定性會受到影響并形成瞬時的可逆孔隙,分子可以通過這些孔隙進入細胞。利用電穿孔技術進行對細胞或活體的電轉染是一種現今常用的將DNA、siRNA 等分子輸送到細胞中的簡單有效的方法。利用電穿孔進行的轉染對比其他方法,不僅操作簡單快速、無需添加專用試劑、適用性廣,而且其轉染率高、無需考慮安全因素,在瞬時完成轉染過程的同時達到穩定轉染的目的。
每種細胞類型需要的電轉條件略有不同,需要更優的轉染效果必須通過實驗確定電轉條件。有的細胞如原代細胞、免疫細胞、干細胞等會出現較難轉染的情況。而對于難轉染懸浮細胞,電穿孔是唯一成功用于將各種分子高效轉移到非貼壁細胞系中的技術。由于大多數轉染方法對非貼壁細胞難以進行,所以對靶基因的電轉成為將目的基因引入懸浮細胞的常見策略。在電轉難轉染細胞前,通過預實驗快速有效的優化電轉條件,可以高效且一致地將核酸遞送到細胞中,同時保持細胞活力。
《Systemic Optimization of Gene Electrotransfer Protocol Using Hard-to-Transfect UT-7 Cell Line as a Model》是立陶宛健康科學大學腫瘤研究所腫瘤研究實驗室在2022年11月發表于Biomedicines的文章。該實驗以UT-7這種轉染效率很低的懸浮細胞為例,討論對于難轉染的細胞系進行電轉染實驗方案的條件優化,以平衡盡可能高的轉染效率與電轉后的細胞活力和細胞生長狀態。其中關于電轉染過程的系統優化可以為我們在電轉染實驗中探索難轉染細胞的轉染條件提供參考方法與改進方向。

實驗對UT-7 細胞系進行質粒的電轉,將編碼綠色熒光蛋白的質粒pEGFP用作評估轉染效率的指標。通過進行不同的電穿孔參數的多組實驗,包括電脈沖方案的配置(振幅、持續時間、電壓和脈沖數)、DNase抑制劑、DNA/RNA濃度等,系統分析實驗結果,以實現高轉染率且高細胞活性的電轉移。
結果分析
評估電轉染結果的方法
01
在不同脈沖強度和持續時間條件下 pEGFP 基因電轉后 UT-7 細胞的活力,通過流式細胞術計數、MTS 測定和 PI 染色進行評估。
實驗建立了一種門控策略,用于正確評估與 PI 共染色的轉染細胞,以區分樣品中四種不同的細胞亞群:轉染/活 (pEGFP+/PI-)、 未轉染/活 (pEGFP-/PI-)、 轉染/死亡 (pEGFP + /PI+) 和未轉染/死亡 (pEGFP-/PI+)。門控策略首先通過根據前向散射面積 (FSC-A) 與前向散射高度 (FSC-H) 的光學特性繪制細胞的流式散點圖,如圖1A。然后從未轉染的細胞(GFP-)中分離轉染細胞 (GFP+),如圖1B。從死細胞 (PI+)中分離活細胞 (PI-),如圖1C。由于無補償情況下GFP熒光會溢出到PI通道,如圖1E。所以在GFP通道中使用了6%的補償,如圖1F。
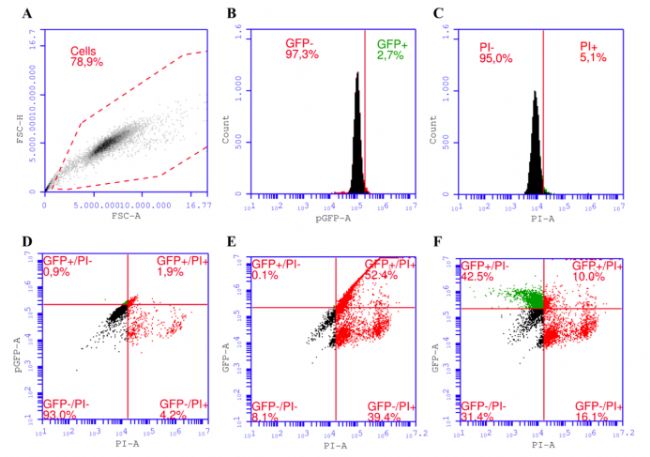
通過流式細胞術計數、MTS 測定和 PI 染色以區分活細胞和死細胞,從而對轉染后的細胞活率進行評估,利用三種不同的測定法來確定 UT-7 細胞的活力。因為無法在不丟失活細胞的情況下從樣品中洗掉死懸浮細胞,所以使用碘化丙啶 (PI) 來染色,然后通過流式細胞術對樣品中的所有細胞進行計數來獲得總細胞數,并將 PI 陽性(死)細胞排除在外。同時實驗嘗試了不同的電轉參數,并將PI染色 結果、MTS 測定結果與總細胞數進行了比較,如圖2。

根據圖2統計結果,細胞死亡率隨著電脈沖電壓和持續時間的增加而增加。代表細胞代謝活動的 MTS 結果僅在 1.4 kV/cm 250 µs 至 1.4 kV/cm 500 µs 不包括 1.2 kV/cm 500 µs 的電轉后明顯更高。且與 PI 陰性(活細胞)量相比,僅在1.4 kV/cm 500 µs使用 MTS 測定法確定的細胞活力顯著更高。根據統計結果可見PI 染色和代謝活動顯示出相似的結果,相比而言使用 PI 染色可以同時測量細胞活力和轉染效率,所以對于本實驗PI 方法被優于 MTS 方法,在本實驗中以PI染色結果作為細胞活性的判斷標準。
不同電場強度與脈沖時間的條件下評估細胞活力與轉染效率
02
根據轉染效率與細胞活率,通過實驗數據分析不同脈沖強度和持續時間對轉染結果的影響趨勢。實驗測試了不同的電穿孔條件,包括電場強度(1.2、1.4、1.6、1.8 kV/cm)和脈沖持續時間(100、250、500、750 μs)的變化。在每個實驗中,施加單個高壓脈沖,并使用 20 μg/mL 的質粒,轉染結果如圖3。每組條件轉染后的 UT-7 細胞可分為四個亞群,轉染/活細胞(GFP + /Viable)、轉染/死細胞 (GFP + /Dead)、未轉染/活細胞 (GFP- /Viable) 和未轉染/死為 (GFP- /Dead),它們的總數為樣本中的總細胞數,如圖3A。轉染/活細胞亞群中的pEGFP平均熒光強度如圖3B。
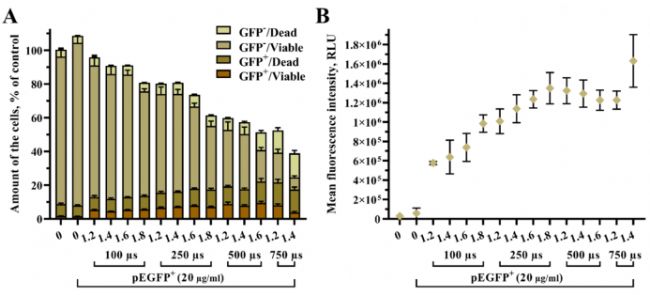
圖3A的數據表明,增加脈沖強度和持續時間是轉染/死亡細胞數量增加的重要原因,由于一些細胞被成功轉染并且可以產生足夠被檢測到的EGFP蛋白但已經死亡。此外,增加脈沖持續時間與轉染/活細胞比例增加直接相關。相比之下,脈沖強度對轉染/活細胞比例的作用不那么明顯。同時,死細胞亞群的細胞數量也是隨脈沖持續時間而非脈沖強度增加。對于未轉染/存活的亞群細胞數量和總細胞數量而言,都是隨著脈沖強度和持續時間的增加而顯著減少。該數據表現了了電轉參數選擇的復雜性。
與此同時,通過圖3B可知,轉染/活細胞亞群中平均熒光強度比轉染/活細胞數的增加更明顯,結果表明增加脈沖強度和持續時間有助于更多質粒分子進入細胞。
DNase抑制劑對電穿孔過程的影響
03
使用DNase抑制劑ZnSO4,在之前證明轉染效率最高的實驗條件下評估ZnSO4對轉染效率GET的影響。用 1.4 kV/cm 250 µs、1.6 kV/cm 250 µs、1.8 kV/cm 250 µs、1.2 kV/cm 500 µs、1.4 kV/cm 500 µs 和 1.2 kV/cm 750 對UT-7 細胞進行電穿孔,之后分別加入80 µM和100 µM ZnSO4孵育48小時后分析轉染結果,如圖4。每組條件轉染后的 UT-7 細胞可分為四個亞群,轉染/活細胞(GFP + /Viable)、轉染/死細胞 (GFP + /Dead)、未轉染/活細胞 (GFP- /Viable) 和未轉染/死為 (GFP- /Dead),它們的總數為樣本中的總細胞數,如圖4A。轉染/活細胞亞群中的pEGFP平均熒光強度如圖4B。
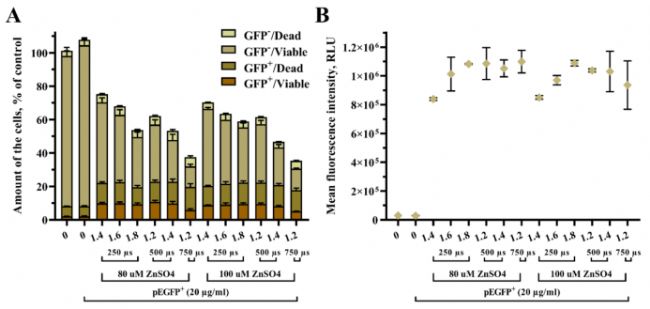
ZnSO4充當細胞內核酸酶的抑制劑,可以在質粒 DNA 進入細胞后防止質粒降解。然而,通過數據可知ZnSO4對UT-7 細胞的 pEGFP 轉染效率沒有作用。如圖 4A所示,同一的電轉參數和不同的ZnSO4濃度,轉染/活細胞的亞群數量保持不變。且如圖 4B所示,對于不同的ZnSO4濃度時,平均熒光強度沒有顯著變化。通過實驗數據分析得知,DNase抑制劑ZnSO4并未對轉染產生影響。
質粒濃度對轉染效率的影響
04
為探索在電轉溶液中質粒pEGFP濃度對 UT-7 細胞轉染效率的影響,測試了多種質粒濃度,包括20µg/mL、50µg/mL、100µg/mL 和 200 µg/mL。使用電壓強度為1.2kV/cm和1.4kV/cm,持續時間為 250 µs 的單個高壓脈沖。根據轉染效率與細胞活率,通過實驗數據分析不同質粒濃度對轉染效率與細胞活性的影響趨勢。轉染結果如圖5。每組條件轉染后的 UT-7 細胞可分為四個亞群,轉染/活細胞(GFP + /Viable)、轉染/死細胞 (GFP + /Dead)、未轉染/活細胞 (GFP- /Viable) 和未轉染/死為 (GFP- /Dead),它們的總數為樣本中的總細胞數,如圖5A。轉染/活細胞亞群中的pEGFP平均熒光強度如圖5B。
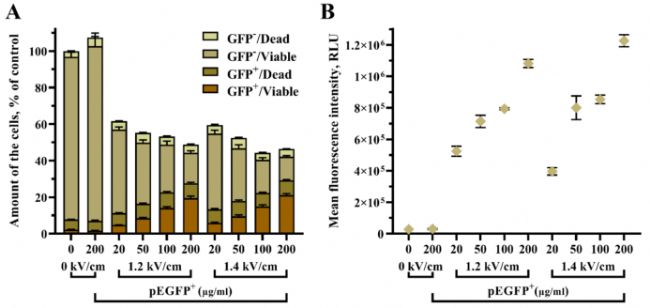
根據統計學分析可知pEGFP 質粒濃度是提高 UT-7 細胞轉染效率的關鍵因素。結果表明,將 pEGFP 質粒從 20 µM 增加到 200 µM 對細胞活力的影響很小,因此較高濃度質粒的使用可以獲得更多轉染/存活的細胞。
結論
本實驗對電轉pEGFP 質粒 DNA 到懸浮 UT-7 細胞系的方案進行了優化。結果發現,UT-7 細胞的轉染細胞率和細胞活力依賴于所選的方波脈沖持續時間,并且關鍵依賴于使用的質粒 DNA 濃度,如圖6所示。

實驗分析可知,提高基因電轉到UT-7 細胞中效率的是電脈沖持續時間而不是電壓強度。但是脈沖強度和持續時間的增加大大降低了細胞活力,且轉染/活細胞數量沒有顯著增加。另一方面,質粒濃度的增加大大提高了轉染效率,對細胞活力影響輕微。
在本次電轉優化過程中可以得到結論:1、與脈沖強度相比,高壓脈沖持續時間的增加可以更有效的將基因電轉到UT-7 細胞中;2、一味地增加高壓脈沖強度和持續時間會導致更高的細胞傷害,而轉染/活細胞數量并不會增加;3、與脈沖持續時間和強度相比,pDNA 濃度的增加對轉染/活細胞亞群增加的影響更為顯著;4、DNAase 抑制劑 ZnSO4 對 pDNA 電轉到UT-7 細胞沒有影響,也不影響細胞活力。
討論
1.對于難轉染的細胞,進行不同電轉參數下電轉結果的測定方法與統計方法,有利于對電轉細胞條件的討論,推薦使用pDNA熒光與PI結果分析細胞活率和轉染效率。可多組進行預實驗,對電轉條件進行優化。對于難轉染細胞不推薦使用程序型的電轉染或核轉染設備,由于其具體電脈沖參數用戶無法得知且不允許用戶控制電轉染參數,客戶無法根據需要對電穿孔過程的具體參數進行調整達到最優電轉效果。
2.對于難轉細胞優化電轉效率的方向,首先考慮提高質粒的濃度,其次考慮適當增加高壓脈沖的持續時間和電壓強度,根據細胞轉染實際情況調整電轉條件。

日本BEX公司新款CUY21EDITIl電轉化儀,采用先進的脈沖技術,是一款無需專用試劑的全功能多模式活體細胞轉染儀器,目前已廣泛應用于全球實驗室。CUY21可應用于細胞的高效轉染,尤其適合于原代細胞、免疫細胞、干細胞等難轉染細胞的高轉化率和高存活率轉化。同時CUY21還可應用于貼壁細胞、離體受精卵及活體的基因轉染,根據不同實驗需求選擇相應電極進行體內體外的轉染。
參考文獻
[1] Vadeikienė R, Jakštys B, Ugenskienė R, Šatkauskas S, Juozaitytė E. Systemic Optimization of Gene Electrotransfer Protocol Using Hard-to-Transfect UT-7 Cell Line as a Model. Biomedicines. 2022 Oct 24;10(11):2687. doi: 10.3390/biomedicines10112687. PMID: 36359207; PMCID: PMC9687892.
[2] Jordan ET, Collins M, Terefe J, Ugozzoli L, Rubio T. Optimizing electroporation conditions in primary and other difficult-to-transfect cells. J Biomol Tech. 2008 Dec;19(5):328-34. PMID: 19183796; PMCID: PMC2628074.
[3] Delgado-Cañedo A, Santos DG, Chies JA, Kvitko K, Nardi NB. Optimization of an electroporation protocol using the K562 cell line as a model: role of cell cycle phase and cytoplasmic DNAses. Cytotechnology. 2006 Jul;51(3):141-8. doi: 10.1007/s10616-006-9028-1. Epub 2006 Nov 14. PMID: 19002884; PMCID: PMC3449805.





