結合單細胞和空間轉錄組揭示乳腺癌傳播過程中的代謝演變

期刊:ADVANCED SCIENCE
影響因子:17.521
導語
乳腺癌已成為全球范圍內最常見的惡性腫瘤,占女性癌癥的近30%。由于治療手段的快速發展,大多數非轉移性乳腺癌患者是可以治愈的。腋窩淋巴結狀態是決定治療策略的重要臨床因素,在風險評估和預后評估中也具有重要意義。
單細胞RNA測序(scRNA-seq)是一個強大的工具,可以在單個細胞的分辨率下提供人類癌癥的表達譜。空間轉錄組學(ST)是一種新型的生物技術,可以在組織切片中以空間分辨率進行可視化和定量分析,彌補scRNA-seq中空間信息的不足。ST結合scRNA-seq有助于克服scRNA-seq(缺乏空間信息)和ST(不是單個細胞分辨率)的局限性。
研究技術
單細胞轉錄組測序,空間轉錄組測序
研究內容
本研究利用單細胞RNA測序( scRNA-seq )和空間轉錄組學技術對4例乳腺癌患者及其配對的腋窩轉移淋巴結的65,968個細胞進行了分析。鑒定了一個具有高水平氧化磷酸化(OXPHOS)的播散性癌細胞簇。研究發現,當擴散啟動時,糖酵解和OXPHOS之間會發生轉變。此外,這種獨特的細胞簇沿腫瘤前緣分布,后續對發現進行了驗證。
研究路線圖
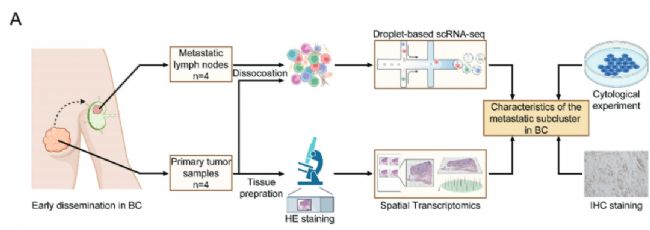
研究結果
1. 乳腺癌原發灶和淋巴結轉移灶單細胞圖譜
為了全面鑒定原發腫瘤和淋巴結轉移腫瘤中的細胞組成和結構,本研究對4例患者手術切除的4對原發浸潤性乳腺腫瘤和轉移腋窩淋巴結進行了scRNA-seq(10x Genomics)。通過嚴格的質量過濾,對剩余的65,968個細胞進行了單細胞圖譜的構建。通過聚類,所有的細胞被分為了0-15個cluster(圖1B),通過marker基因將所有細胞分為8種細胞類型,包括上皮細胞(ECAM1、KRT19、PROM1)、漿細胞(IGHG1、MZB1、SDC1)、髓系細胞(CD68、CD163、CSF1R、MRC1、TPSAB1、MS4A2、CD1C)、 NK細胞(NCR1、GLNY、NKG7)、B細胞(CD79A、CD79B、MS4A1)、T細胞(CD3D、CD3E、CD8A、CD4)、成纖維細胞(COL1A1、COL1A2、DCN)、內皮細胞(PCAM1、VWF)(圖1C、D)。

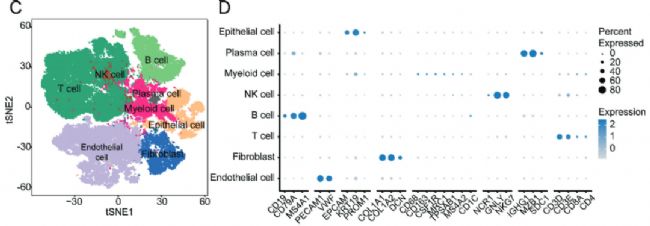
Fig 1. 乳腺癌原發灶和轉移灶的單細胞圖譜
2. 通過scRNA-seq鑒定上皮細胞特征
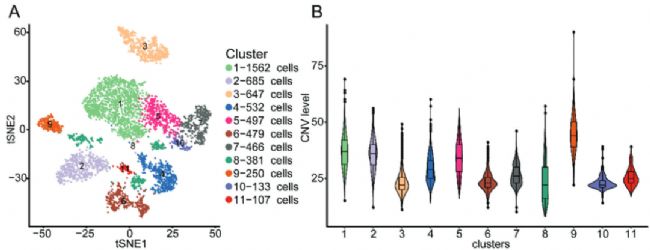
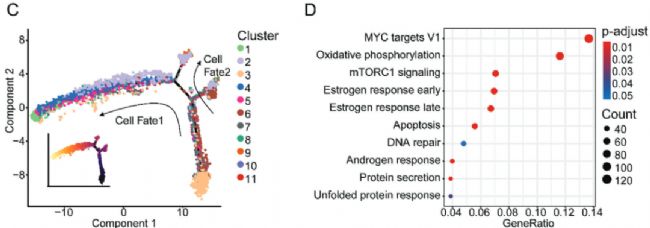
由于癌細胞來源于上皮細胞,本研究對上皮細胞細分為了11個亞群。為了區分惡性細胞和非惡性細胞,本研究對于上皮細胞和上皮細胞亞群進行了CNV水平的評估。在所有上皮細胞簇中,C3的CNV水平明顯低于其他細胞簇,表明C3是一組正常的乳腺導管上皮細胞,而其他細胞簇是惡性上皮細胞(圖2B)。為了解析乳腺癌上皮細胞的進化動態,對上皮細胞的11個cluster進行了擬時序分析。因為C3為非惡行細胞,且在軌跡曲線的右下角,證明擬時序分析的右下角為起點。因此,C2、4和9被鑒定為早期擴散的癌細胞(EDC)簇,因為它們位于軌跡曲線的末端,具有相對較高的CNV水平(圖2B、C)。更重要的是這三群在原發腫瘤和淋巴結樣本中均有出現。盡管C8的CNV水平較低,但因為其在原發腫瘤和淋巴結樣本中均有出現,也被定義為EDC簇。總之,研究確定了C3代表正常乳腺導管上皮細胞,而C2、4、8和9是乳腺癌的EDC簇。
為了研究EDC簇(C2 , 4 , 8 , 9)的基因表達變化,基于分子特征數據庫(Molecular Signatures Database,MsigDB)的Hallmarker基因集進行富集分析,以識別癌細胞在傳播過程中的變化途徑。富集程度最高的通路包括與細胞增殖相關的通路(mTORC1 signaling、MYC targets V1)和乳腺癌治療反應相關的通路(estrogen response early, estrogen response late),這些通路與患者的臨床病理特征和EDC簇更多的惡性特征相符。另外,EDC簇顯示OXPHOS途徑的顯著富集,暗示擴散細胞的新的代謝特征(圖2D)。
熱圖(圖2E)顯示了細胞分化過程中基因表達變化。其中在惡性上皮細胞早期播散過程中,OXPHOS (COX6C、DHRS2、ATP5MC2和NDUFB4)中的標記基因呈現先上調后下調的表達模式,而糖酵解途徑中的標記基因(GAPDH、LDHA、PKM和PGK1)呈現先下調后上調的表達模式。同時,與細胞粘附和遷移相關的基因(CLDN3, F11R)的表達也呈現先下降后上升的模式,這表明了癌細胞在擴散過程中細胞行為的動態變化。乳腺癌細胞的這種代謝轉換類似于轉移過程中上皮間質轉化(EMT)的變化,即從原發腫瘤脫離后,EDCs的代謝輪廓從糖酵解轉變為OXPHOS。一旦轉移細胞形成,代謝偏好又恢復為促進細胞增殖。總之,我們的研究結果揭示了乳腺癌早期轉移過程中OXPHOS和糖酵解之間的轉變,表明OXPHOS可能在轉移過程中發揮重要作用。
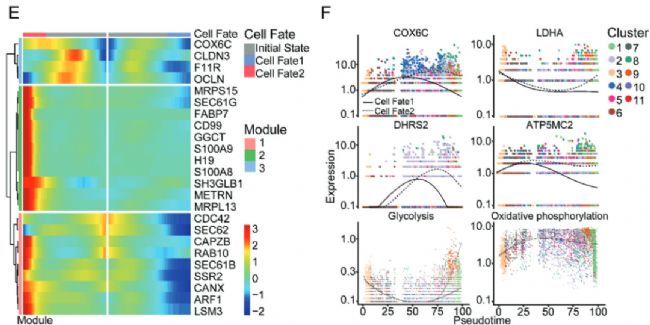
3. 細胞通訊分析揭示EDCs與免疫細胞之間的細胞間配體-受體對
為了鑒定EDC與免疫細胞之間的相互作用關系,本研究對EDC和免疫細胞做了cellchat分析。雖然在原發腫瘤中主要細胞類型之間的相互作用數量較高,但兩組之間的相互作用強度非常接近(圖3A)。EDC簇在原發腫瘤中表現出與免疫細胞更多的相互作用,而在淋巴結中表現出與免疫細胞更強的相互作用(圖3B-E)。
接下來研究了不同細胞簇之間的特異性配體-受體相互作用。免疫細胞之間的配體-受體對(CD22 - PTPRC、PTPRC - CD22和ADGRE5 - CD55)在淋巴結相比于原發腫瘤中顯著上調,表明這些途徑對于腫瘤的免疫反應至關重要。巨噬細胞移動抑制因子(macrophage migration inhibitory factor,MIF)通路在EDCs和免疫細胞之間的淋巴結和原發腫瘤中都很活躍,表明它在這兩個部位都是必不可少的,并且可能有助于乳腺癌的傳播(圖3F-H)。20條通路中,有4條通路在原發和轉移中都活躍,其他的一些通路分別存在淋巴結或者原發腫瘤中(圖3I)。
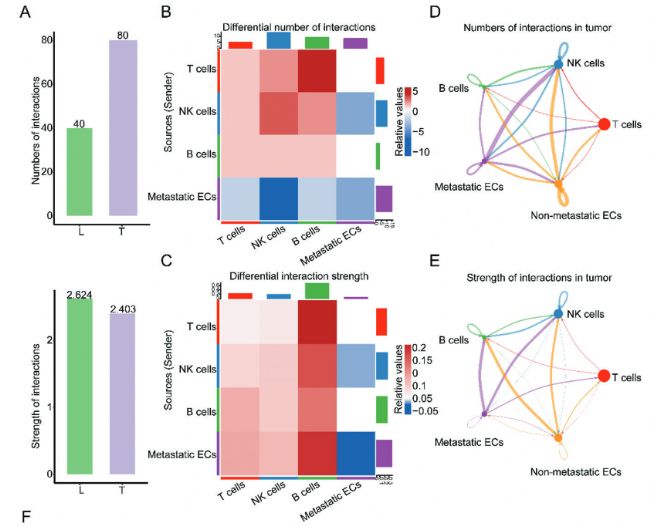
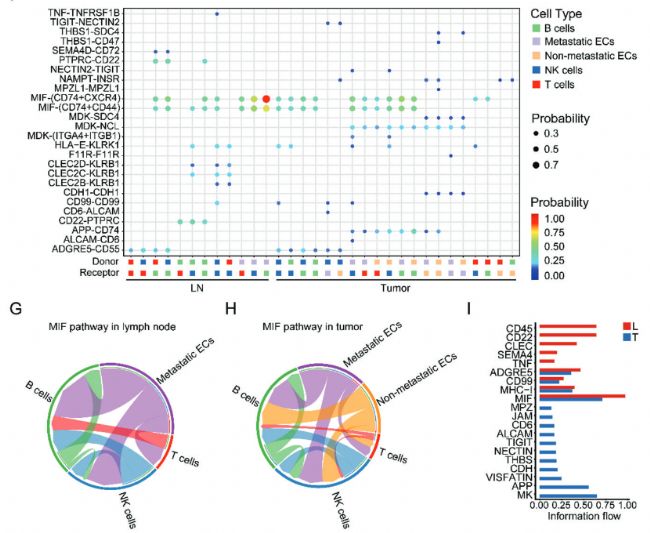
Fig 3. EDCs細胞通訊
4. 空間轉錄組測序聯合單細胞測序解釋EDC的空間特征
為了進一步評估上皮細胞的空間組織,從4例患者的原發新鮮腫瘤樣本中進行乳腺癌組織冰凍切片。經蘇木精-伊紅(H & E)染色和明場成像后,將玻片注釋為3個主要區域,包括腫瘤區域、導管上皮和基質區域(圖4A左)。為了詳細探究EDC簇的空間特征,利用t - SNE分析對ST數據進行處理,將所有spot劃分為15個Cluster(圖4B)。通過將所有ST簇投射到冰凍切片上,研究發現了一個明顯的分布模式,這與H & E染色(圖4A ,右)下的組織學注釋一致。對于每個樣本,腫瘤區域由不同的簇組成,包括來自T1的CII,來自T2的CX和CXIV,來自T3的CIX和CXIII,來自T4的CVIII和CXV。這些結果暗示了4例患者之間的腫瘤異質性。為了精確定位樣本中的上皮細胞,應用MIA生成上皮簇和ST簇的對應關系。我們發現EDC簇(C2,C4,C8,C9)在腫瘤區域富集。有趣的是,我們注意到在T3和T4中,EDC簇C2和C8主要位于腫瘤區域的前沿,而在T3中,另一個惡性細胞(C6)被C8包圍。結合偽時間分析的結果,推測從惡性階段(C6)到播散階段(C8)的演變與從腫瘤內部到前緣最后到轉移部位的路線平行。為了驗證這一假設,手動選取了每個樣本腫瘤前緣的斑點。對不同樣本進行了BMS、OXPHOS、EMT評分,盡管在四個樣本中三個評分有差異,但在每個樣本中,三個評分在腫瘤前緣顯示出明顯高于腫瘤內部區域(圖4D、E)。這些結果表明EDC簇的分布遵循腫瘤前沿,這與MIA產生的結果以及scRNA-seq鑒定的EDC簇代謝特征一致。
為了進一步研究腫瘤前沿的EDCs,我們對T3和T4的ST數據進行了t - SNE分析,將每個樣本的spot點重新聚類為9個簇和5個簇 (圖4F,左)。BMS評分最高的兩個簇(C2在T3,C4在T4)在兩個樣本中均沿腫瘤前緣分布(圖4F中、4G)。根據scRNA - seq的結果,COX6C和DHRS2在EDC簇和其他上皮簇之間的前25個差異基因中,均參與OXPHOS途徑。正如預期的那樣,在兩個樣本中,COX6C和DHRS2水平最高的兩個簇沿腫瘤前緣分布,這與MIA產生的結果一致。
GSVA 分析腫瘤前沿spot與腫瘤區域其他spot之間的差異通路。GSVA結果顯示OXPHOS通路在腫瘤前沿的spot中顯著上調。此外,其他富集通路如DNA修復通路、MYC靶點V1通路和mTORC1信號通路在EDC簇中也顯著上調。綜上所述,研究發現EDC簇趨向于沿腫瘤前緣分布,并表現出OXPHOS上調的代謝特征。OXPHOS可能在EDC簇的代謝轉化中發揮重要作用。
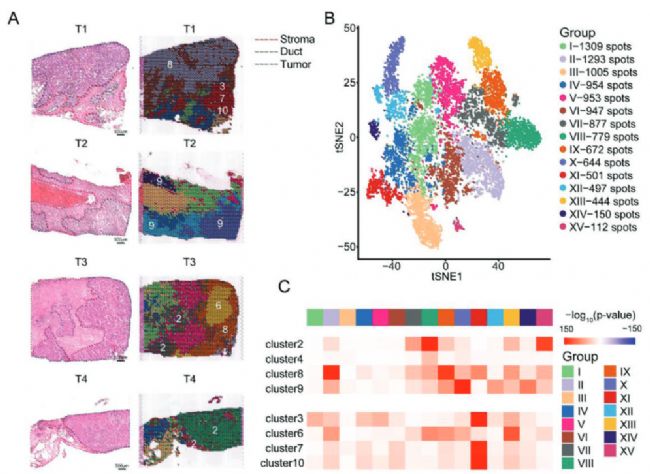
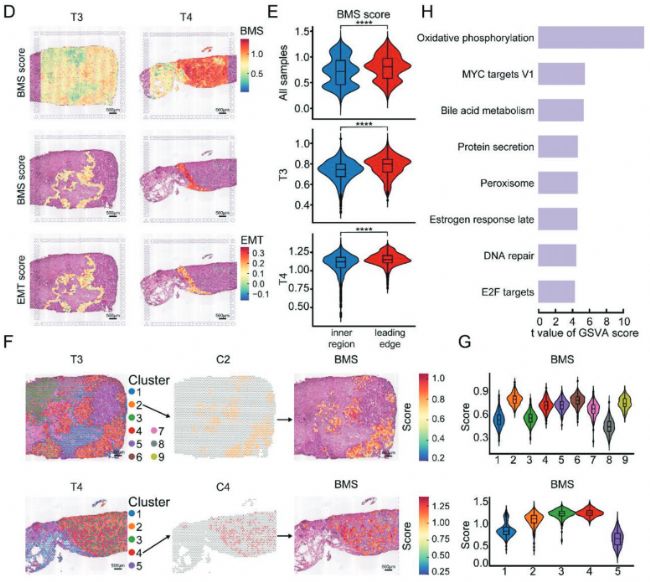
Fig 4. EDC的空間特征
5. 敲除COX6C和DHRS2可以抑制乳腺癌細胞的增殖、遷移和EMT評分
使用不同的人乳腺癌細胞系敲除了氧化磷酸化通路中的關鍵基因COX6C和DHRS2基因,并結合transwell細胞遷移實驗、免疫組化(IHC)、WB實驗等,發現敲除COX6C和DHRS2可以抑制乳腺癌細胞的增殖、遷移和EMT評分。
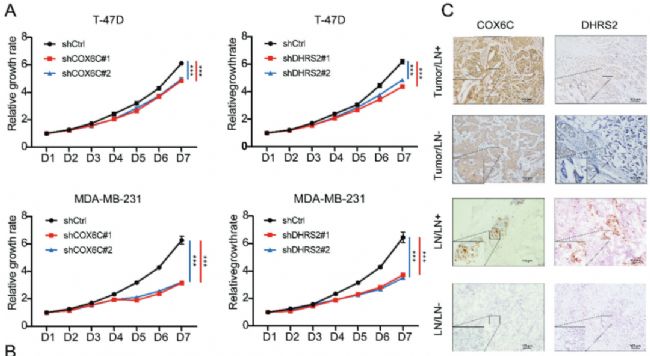
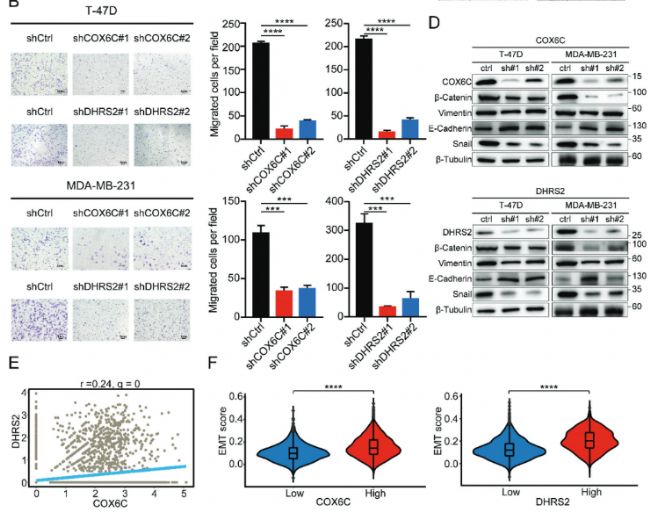
Fig 5. 敲除COX6C和DHRS2抑制乳腺癌細胞增殖
6. Oxphos的上調與乳腺癌患者的淋巴結狀態和預后相關
作者接下來用自己的FUSCC隊列數據和TCGA數據庫相結合分析,發現淋巴結轉移陽性樣本在OXPHOS通路上得分更高,在糖酵解途徑得分更低。scRNA-seq公共數據集分析驗證發現OXPHOS通路、雌激素信號通路和tight junction通路在EDC細胞中富集。TCGA生存分析發現,在HER2陽性乳腺癌中和基底樣乳腺癌中,COX6C和DHRS2與較差的OS(overall survival)和DMFS(distant metastasis-free survival)相關。
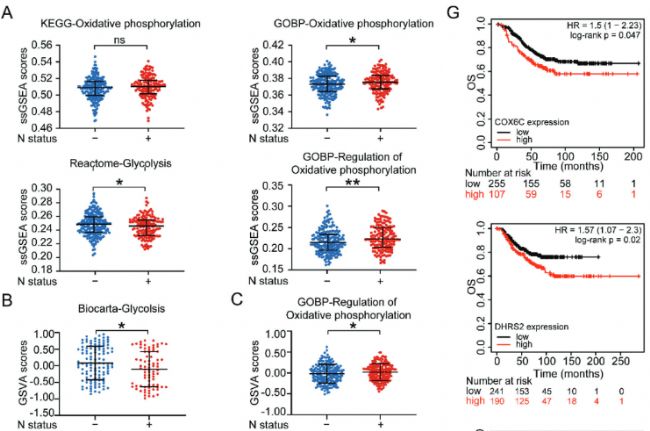
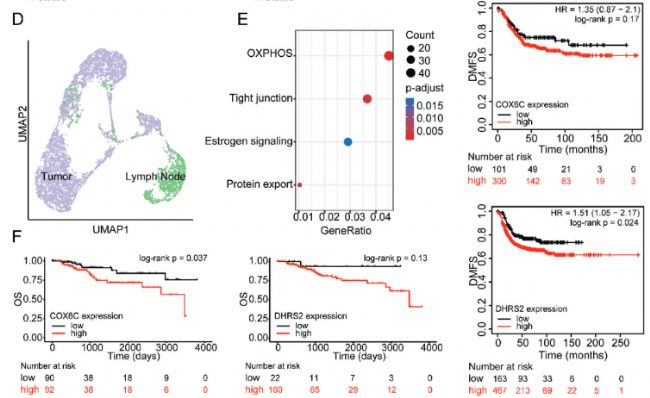
Fig 6. 氧化磷酸化與乳腺癌患者淋巴結轉移和預后呈正相關
參考文獻:
Liu Y M, Ge J Y, Chen Y F, et al. Combined Single-Cell and Spatial Transcriptomics Reveal the Metabolic Evolvement of Breast Cancer during Early Dissemination[J]. Advanced science (Weinheim, Baden-Wurttemberg, Germany), e2205395.





