RT-PCR基本原理與實驗步驟及常見問題的處理方案
1概述
反轉錄-聚合酶鏈式反應(Reverse Transcription-Polymerase Chain Reaction, RT-PCR),也稱逆轉錄PCR,是聚合酶鏈式反應(PCR)的一種廣泛應用的變形。其靈敏度比傳統的RNA印跡法高1000〜10000倍,而所需時間縮短了幾倍。迄今為止,RT-PCR的方法已經廣泛應用于RNA的構造解析、cDNA的克隆及RNA水平上的表達解析等多種領域。
2 RT-PCR原理
RT-PCR是一種從細胞RNA (mRNA)中高效靈敏地擴增cDNA序列的方法,它由兩大步驟組成:一步是反轉錄(RT),另一步是PCR。獲得總RNA或mRNA后,即可進行RT-PCR。首先,在反轉錄酶作用下將RNA(mRNA)反轉錄成cDNA,以該cDNA第一鏈為模板進行PCR擴增,根據靶基因設計用于PCR擴增的基因特異的上下游引物,基因特異的上游引物與cDNA第一鏈退火,在Taq DNA聚合酶作用下合成cDNA第二鏈。再以cDNA第一鏈和第二鏈為模板,用基因特異的上下游引物PCR擴增獲得大量的cDNA。反應原理圖如下。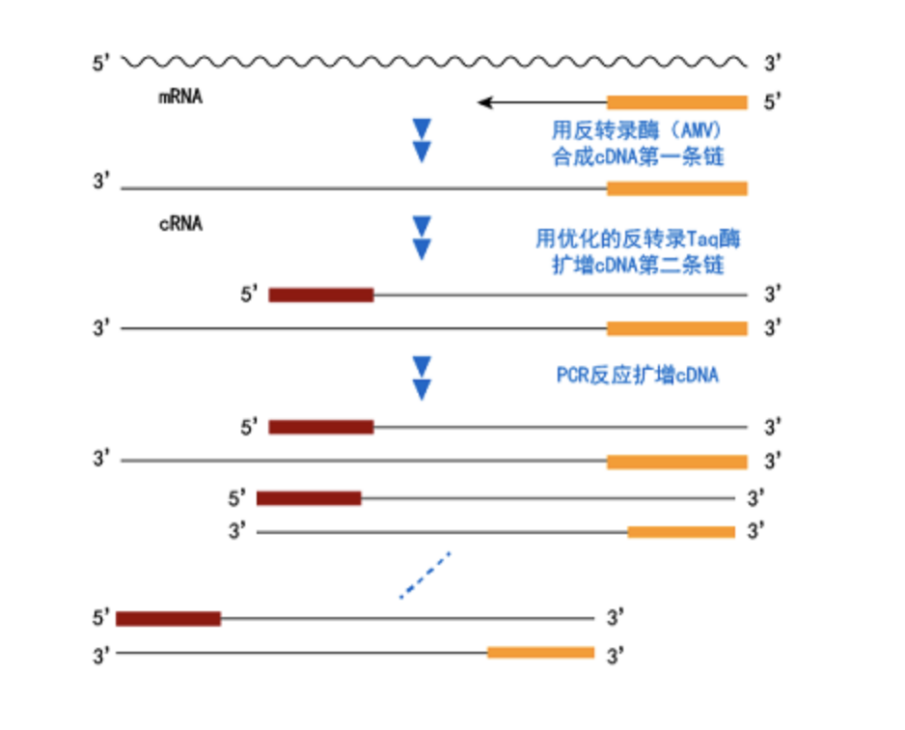

4 RT-PCR實驗步驟
4.1 RNA的提取
(1) 50-100mg組織或(5~10)×106個細胞,加入1mL Trizol試劑。對組織來說,需要在勻漿器中勻漿幾分鐘,至組織完全破碎。對培養細胞來說,可用移液器上下吹打或勻漿機破碎細胞。
(2) 4 ℃、12 000g離心10 min,轉移上清。
(3) 上清室溫放置5min,加0.2mL氯-仿,用手或Votex劇振15 s,室溫放置2~3min。
(4) 4℃、11 000 g離心15 min,轉移水相。
(5) 水相中加入0.25 mL異丙醇及0.25 mL高鹽沉淀液(0.8mol/L的檸檬酸鈉,1.2mol/L的 NaCl)混勻,室溫放置10min。
(6) 4℃、11000 g離心10 min去上清。
(7) 加1 mL75%乙醇,Votex混勻,4℃、7000g離心5min,去上清。
(8) 沉淀在空氣中干燥5~10 min,用100 μL DEPC水溶解,槍頭吸打幾次,放于 55℃水浴中10min促溶。
(9) 電泳及檢測OD值,檢定RNA的量及完整性。
(10) RNA放入-70℃保存。
4.2 mRNA的分離
(1) 檢測起始RNA的量(起始RNA的量應小于或等于0.25mg)。將總RNA加入一個無RNase的1.5 mL Eppendorf管中,加入不含RNase的水至總體積為250 μL。
(2) 加入250μL的Buffer OBB和15μL的Oligotex懸浮液,完全混合溶液。
(3) 樣品溶液放入70℃水浴中保溫3 min。
(4) 從水浴中取出樣品溶液,室溫下放置10min。(這一步允許Oligotex粒子中的Oligo-dT30 和mRNA的poly-A尾巴雜交)
(5) 將樣品溶液以最大速度(14000~18000 g)離心2min以沉淀Oligotex-mRNA 復合物,用移液器小心除去上清液。
(6) 用渦旋振蕩器(Votex)或移液器將Oligotex-mRNA復合物沉淀重懸于400 μL或600 μL Buffer OW2中,然后將這些懸液加入到一個置于1. 5 mL微量離心管中的小離心柱(用于400 μL懸液)或大離心柱(用于600 μL懸液)中,以最大速度離心1 min。
(7) 轉移離心柱到一個新的不含RNA酶的1.5 mL微量離心管中,然后加入400 μL或600 μL Buffer OW2到離心柱中,以最大速度離心1 min,并且棄掉離心液。
(8) 轉移離心柱到一個新的不含RNA酶的1.5mL微量離心管中,加入 20-100 μL Buffer OEB (70℃預熱)到柱子中,用移液器洗打溶液3~4次以重懸柱子上的Oligotex-mRNA復合物,以最大速度離心1 min。
(9) 為了獲得最大的產量,再加入20-100 μL Bulfer OEB (70℃預熱)到柱子中,然后用同樣的方法重懸柱子中的Oligotex-mRNA復合物,以最大速度離心1min。為了減少洗脫體積,可以將第一次洗脫液重新加熱到70℃后再用來進行另一次洗脫。但是如果要獲得最大量的mRNA,則建議還是用新的Buffer OEB來洗脫。
4.3 RT-PCR
(1) 按下列組成配制RT-PCR反應液。

(2)以下條件進行RT-PCR反應。

反轉錄-聚合酶鏈式反應(Reverse Transcription-Polymerase Chain Reaction, RT-PCR),也稱逆轉錄PCR,是聚合酶鏈式反應(PCR)的一種廣泛應用的變形。其靈敏度比傳統的RNA印跡法高1000〜10000倍,而所需時間縮短了幾倍。迄今為止,RT-PCR的方法已經廣泛應用于RNA的構造解析、cDNA的克隆及RNA水平上的表達解析等多種領域。
2 RT-PCR原理
RT-PCR是一種從細胞RNA (mRNA)中高效靈敏地擴增cDNA序列的方法,它由兩大步驟組成:一步是反轉錄(RT),另一步是PCR。獲得總RNA或mRNA后,即可進行RT-PCR。首先,在反轉錄酶作用下將RNA(mRNA)反轉錄成cDNA,以該cDNA第一鏈為模板進行PCR擴增,根據靶基因設計用于PCR擴增的基因特異的上下游引物,基因特異的上游引物與cDNA第一鏈退火,在Taq DNA聚合酶作用下合成cDNA第二鏈。再以cDNA第一鏈和第二鏈為模板,用基因特異的上下游引物PCR擴增獲得大量的cDNA。反應原理圖如下。

3 一步法與兩步法RT-PCR
常用的反轉錄PCR方法有兩步法(Two-step RT-PCR)和一步法(One-step RT-PCR)兩種。兩者的區別與特點如下表所示。
常用的反轉錄PCR方法有兩步法(Two-step RT-PCR)和一步法(One-step RT-PCR)兩種。兩者的區別與特點如下表所示。

4 RT-PCR實驗步驟
4.1 RNA的提取
(1) 50-100mg組織或(5~10)×106個細胞,加入1mL Trizol試劑。對組織來說,需要在勻漿器中勻漿幾分鐘,至組織完全破碎。對培養細胞來說,可用移液器上下吹打或勻漿機破碎細胞。
(2) 4 ℃、12 000g離心10 min,轉移上清。
(3) 上清室溫放置5min,加0.2mL氯-仿,用手或Votex劇振15 s,室溫放置2~3min。
(4) 4℃、11 000 g離心15 min,轉移水相。
(5) 水相中加入0.25 mL異丙醇及0.25 mL高鹽沉淀液(0.8mol/L的檸檬酸鈉,1.2mol/L的 NaCl)混勻,室溫放置10min。
(6) 4℃、11000 g離心10 min去上清。
(7) 加1 mL75%乙醇,Votex混勻,4℃、7000g離心5min,去上清。
(8) 沉淀在空氣中干燥5~10 min,用100 μL DEPC水溶解,槍頭吸打幾次,放于 55℃水浴中10min促溶。
(9) 電泳及檢測OD值,檢定RNA的量及完整性。
(10) RNA放入-70℃保存。
4.2 mRNA的分離
(1) 檢測起始RNA的量(起始RNA的量應小于或等于0.25mg)。將總RNA加入一個無RNase的1.5 mL Eppendorf管中,加入不含RNase的水至總體積為250 μL。
(2) 加入250μL的Buffer OBB和15μL的Oligotex懸浮液,完全混合溶液。
(3) 樣品溶液放入70℃水浴中保溫3 min。
(4) 從水浴中取出樣品溶液,室溫下放置10min。(這一步允許Oligotex粒子中的Oligo-dT30 和mRNA的poly-A尾巴雜交)
(5) 將樣品溶液以最大速度(14000~18000 g)離心2min以沉淀Oligotex-mRNA 復合物,用移液器小心除去上清液。
(6) 用渦旋振蕩器(Votex)或移液器將Oligotex-mRNA復合物沉淀重懸于400 μL或600 μL Buffer OW2中,然后將這些懸液加入到一個置于1. 5 mL微量離心管中的小離心柱(用于400 μL懸液)或大離心柱(用于600 μL懸液)中,以最大速度離心1 min。
(7) 轉移離心柱到一個新的不含RNA酶的1.5 mL微量離心管中,然后加入400 μL或600 μL Buffer OW2到離心柱中,以最大速度離心1 min,并且棄掉離心液。
(8) 轉移離心柱到一個新的不含RNA酶的1.5mL微量離心管中,加入 20-100 μL Buffer OEB (70℃預熱)到柱子中,用移液器洗打溶液3~4次以重懸柱子上的Oligotex-mRNA復合物,以最大速度離心1 min。
(9) 為了獲得最大的產量,再加入20-100 μL Bulfer OEB (70℃預熱)到柱子中,然后用同樣的方法重懸柱子中的Oligotex-mRNA復合物,以最大速度離心1min。為了減少洗脫體積,可以將第一次洗脫液重新加熱到70℃后再用來進行另一次洗脫。但是如果要獲得最大量的mRNA,則建議還是用新的Buffer OEB來洗脫。
4.3 RT-PCR
(1) 按下列組成配制RT-PCR反應液。

(2)以下條件進行RT-PCR反應。

(3)反應結束后,取PCR反應液(5-10μL)進行瓊脂糖凝膠電泳,確認RT-PCR反應產物。如果此PCR產物需要用于以后實驗,必將PCR產物放于-20℃冷凍保存。
5 RT-PCR常見問題解析
一步RT-PCR和兩步RT-PCR方法哪個更好?應該怎么選擇?
一步RT-PCR的最大優點是操作簡單,因此可避免樣品間的交叉污染。但我們的實踐經驗表明,在大多數情況下,應首先考慮兩步RT-PCR法,而不是一步RT-PCR法,因為兩步RT-PCR法產物的產量一般高于一步RT-PCR法;此外兩步法具有更大的靈活性,可以分別優化RT和PCR兩步反應,而無需考慮它們之間的干擾。
RT-PCR以總RNA作為模板還是以mRNA作為模板好?
提取總RNA還是mRNA取決于實驗目的。一般情況下(如克隆基因或比較不同樣品間基因表達水平時),提取總RNA即可作為RT-PCR的模板。這樣可以減少獲得cDNA的實驗步驟,從而減少實驗誤差。另外,分離總RNA要比分離mRNA少用一些試劑,因此更經濟。但是若要構建cDNA文庫,則需要分離mRNA作為模板,以便提高cDNA文庫的質量。
如何保證作為RT-PCR實驗模板的總RNA的數量和質量?
RT-PCR能否成功的關鍵之一是提取的總RNA的數量和質量。要想保證獲得高質量的總RNA,有兩點需要特別注意:
(1) Trizol試劑的選擇。盡管有很多國內公司都提供廉價的Trizol試劑出售,但還是強烈推薦購買質量更可靠的Invitrogen等公司的Trizol試劑。
(2) 提取RNA過程,必須特別小心,嚴格按照要求操作,以防止RNA的降解。
如何防止提取RNA過程中RNA的降解?
主要注意以下幾點:
(1) 實驗過程中使用的玻璃器皿使用前可于180 ℃干烤8h以上,塑料制品要用氯-仿沖洗。焦磷酸二乙酯(DEPC)是RNase酶的強烈抑制劑,RNA提取過程和反轉錄過程中所用的水要用DEPC處理。
(2) 操作人員的手是RNase的重要污染源,進行RNA實驗時應始終戴手套,并應勤換手套。
(3) 提取的樣品材料應盡可能新鮮,如果不能及時提取RNA,取樣后應保存于液氮中。
如何選擇反轉錄引物?
兩步法中反轉錄引物有Oligo(dT)(12-18個核苷酸組成)、隨機六聚寡核苷酸和基因特異引物,可根據不同的目的選擇不同的引物。Oligo(dT)引物能與哺乳動物mRNA的3'端poly(A)尾巴互補,作為一種通用引物用于cDNA第一鏈的合成。隨機六聚寡核苷酸引物能與RNA模板的許多位點互補,因此,當RNA序列很長(>3kb)或其中包含很多二級結構使Oligo (dT)或基因特異引物很難與mRNA互補時,選擇隨機六聚寡核苷酸引物不失為一種良策。
基因特異引物能與靶mRNA的某一區域互補,該引物可用作 PCR反應中的下游引物。基因特異引物在細胞內靶mRNA含量較低時較為有用。
當用基因特異引物進行反轉錄時,需注意引物的濃度和退火溫度。一般而言,用Oligo (dT)獲得的RT-PCR產物特異性比隨機六寡核苷酸獲得的RT-PCR產物的特異性高。一步法中所用引物為基因特異引物,因此選擇余地比兩步法少。一步RT-PCR中兩條引物的其中一條既應在RT中發揮作用,又應在PCR中發揮作用。為兼顧RT和PCR,引物的退火溫度一般在45~65℃之間。為增加一步RT-PCR產物的量,引物濃度可增加到0.6 μmol/L。引物最好設計在離mRNA 3'末端4 kb區域以內,擴增長度小于1.5 kb。
RT-PCR的產物產率很低是什么原因?
可能是因為反轉錄cDNA合成效率低,但更多情況下是因為cDNA擴增效率低。為了驗證后者的可能性,可建立一系列PCR反應,這些PCR反應中加入了不同數量的模板。 假如染色后的凝膠上呈現不清晰的成片狀的非特異性條帶,這種實驗結果往往是在PCR中加入過量的cDNA模板所致。因此,在許多PCR實驗中用反轉錄反應產生的cDNA的10%作為模板。在這種情況下,PCR擴增階段需要另加模板。具體最適合的模板量,要靠預實驗確定。一旦建立了模板的最佳濃度,其他的PCR參數可用系統的方式如改變 Mg2+濃度和復性條件來進一步優化。
上述調整后RT-PCR的產物產率依然很低,怎么辦?
可依次采取以下步驟:
(1) 通過含有甲醛的瓊脂糖凝膠電泳來檢査RNA的完整性。
(2) 建立含有對照mRNA、Oligo (dT)引物和放射性元素標記示蹤物的檢測反應來檢測cDNA的合成效率。
(3) 將不同比例的RNA樣品和對照樣品混合,通過比較cDNA的產量來檢測RNA樣品中是否存在抑制劑。
(4) 在繼續進行PCR之前,純化cDNA第一鏈的樣品。
RT-PCR反應后,無PCR產物,怎么辦?
首先應嚴格按照說明書要求,進行Control反應。如果對照正常,說明實驗操作方面沒有問題。應從RNA樣品的純度和添加量、引物的設計情況、參考文獻的可信度以及RT-PCR條件的設定等方面加以考慮;如對照反應不正常,應從實驗操作的準確性、實驗器具的處理、PCR儀的條件設定等方面加以考慮。
有些RT反應體系中,不加dNTP混合物,為什么?
由于在這些RT反應體系中已經加了足夠量的dNTP Mixture,因此在PCR反應中,不須再添加dNTP。如果在PCR反應時繼續添加,雖然PCR反應仍可進行,但可能會降低DNA的擴增效率。
5 RT-PCR常見問題解析
一步RT-PCR和兩步RT-PCR方法哪個更好?應該怎么選擇?
RT-PCR以總RNA作為模板還是以mRNA作為模板好?
如何保證作為RT-PCR實驗模板的總RNA的數量和質量?
(1) Trizol試劑的選擇。盡管有很多國內公司都提供廉價的Trizol試劑出售,但還是強烈推薦購買質量更可靠的Invitrogen等公司的Trizol試劑。
(2) 提取RNA過程,必須特別小心,嚴格按照要求操作,以防止RNA的降解。
如何防止提取RNA過程中RNA的降解?
(1) 實驗過程中使用的玻璃器皿使用前可于180 ℃干烤8h以上,塑料制品要用氯-仿沖洗。焦磷酸二乙酯(DEPC)是RNase酶的強烈抑制劑,RNA提取過程和反轉錄過程中所用的水要用DEPC處理。
(2) 操作人員的手是RNase的重要污染源,進行RNA實驗時應始終戴手套,并應勤換手套。
(3) 提取的樣品材料應盡可能新鮮,如果不能及時提取RNA,取樣后應保存于液氮中。
如何選擇反轉錄引物?
基因特異引物能與靶mRNA的某一區域互補,該引物可用作 PCR反應中的下游引物。基因特異引物在細胞內靶mRNA含量較低時較為有用。
當用基因特異引物進行反轉錄時,需注意引物的濃度和退火溫度。一般而言,用Oligo (dT)獲得的RT-PCR產物特異性比隨機六寡核苷酸獲得的RT-PCR產物的特異性高。一步法中所用引物為基因特異引物,因此選擇余地比兩步法少。一步RT-PCR中兩條引物的其中一條既應在RT中發揮作用,又應在PCR中發揮作用。為兼顧RT和PCR,引物的退火溫度一般在45~65℃之間。為增加一步RT-PCR產物的量,引物濃度可增加到0.6 μmol/L。引物最好設計在離mRNA 3'末端4 kb區域以內,擴增長度小于1.5 kb。
RT-PCR的產物產率很低是什么原因?
上述調整后RT-PCR的產物產率依然很低,怎么辦?
(1) 通過含有甲醛的瓊脂糖凝膠電泳來檢査RNA的完整性。
(2) 建立含有對照mRNA、Oligo (dT)引物和放射性元素標記示蹤物的檢測反應來檢測cDNA的合成效率。
(3) 將不同比例的RNA樣品和對照樣品混合,通過比較cDNA的產量來檢測RNA樣品中是否存在抑制劑。
(4) 在繼續進行PCR之前,純化cDNA第一鏈的樣品。
RT-PCR反應后,無PCR產物,怎么辦?
有些RT反應體系中,不加dNTP混合物,為什么?
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com