Cell Stem Cell:下丘腦調控成年海馬新生神經元改善AD認知情感障礙
阿爾茲海默病(AD)是一類以認知情感損害為主要行為表現的嚴重神經退行性疾病。通過調控成年海馬神經發生(AHN)以改善AD認知情感損害的有效性存在爭議。近日,北卡羅來納大學教堂山分校(UNC)宋娟課題組博士后李亞東(現為上海交通大學醫學院松江研究院研究員)、羅艷佳(共同第一作者,現為上海交通大學醫學院第九人民醫院研究員)等在調控成年海馬新生神經元改善AD認知情感障礙方向取得重要研究進展,相關成果于4月6日以‘Activation of hypothalamic-enhanced adult-born neurons restores cognitive and affective function in Alzheimer's disease’為題在《Cell Stem Cell》以Article形式發表。
近年來,通過調控海馬神經發生改善AD認知情感損害一直是研究熱點。已有研究使用基因調控策略,干預AHN的不同基因在拯救海馬新生神經元改善記憶的效果上存在明顯差異,且對于神經發育的動態過程描述不清。不同于基因操控,靶向神經環路可以實現對AHN不同階段的精準調控。李亞東博士等前期報道已證實刺激下丘腦覺醒核團SuM促進空間記憶,增加海馬新生神經元數量及成熟度并對抗焦慮樣行為。那么操控SuM環路能否改善AD小鼠的神經發生正是本篇文章的研究重點。
01
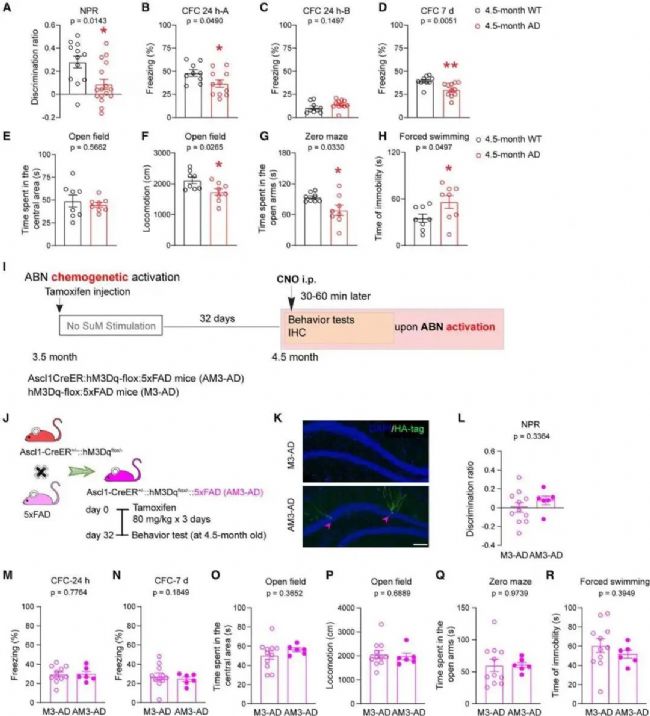
5×FAD小鼠的海馬神經發生受損早于行為缺陷發生
通過染色及譜系追蹤方法證實AHN損傷始于3.5月齡5×FAD小鼠,此時僅神經前體細胞的增殖受到影響,但并未導致ABN生成減少。使用行為學(新位置識別,條件恐懼,曠場,O迷宮,強迫游泳)測試3.5月齡和4.5月齡的5×FAD小鼠的海馬依賴性記憶表現和情緒狀態,以確定這些行為發生受損的時間。結果表明4.5月齡(而非3.5月齡)5×FAD小鼠的記憶受損,焦慮和抑郁樣行為增加。但是使用化學遺傳學激活ABN并不能挽救5×FAD小鼠的行為缺陷。
02
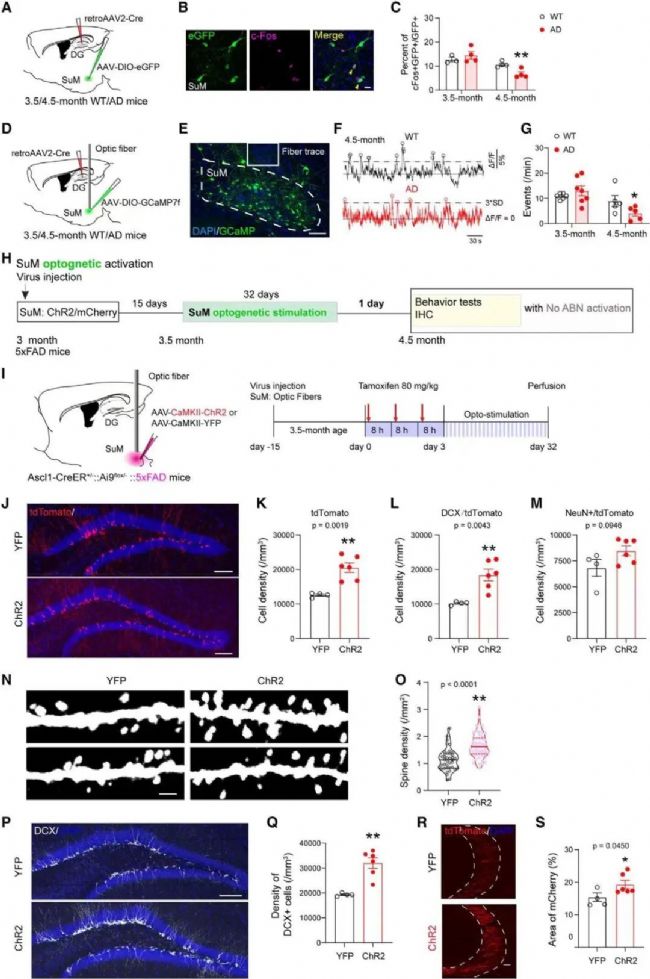
模式光遺傳刺激SuM可促進5×FAD小鼠海馬神經發生,并不改善記憶情感功能
針對化學遺傳學并未改善AD小鼠行為缺陷可能是因為AD小鼠的ABN數量降低且功能受損。因此,研究人員采用的第二項方案便是增加ABN的數量。研究團隊使用光遺傳學法(optogenetics)刺激3.5-5個月大AD小鼠的SuM,成功促進了AHN,ABN的數量和突觸連接均得到改善。但遺憾的是,AD小鼠的記憶情感功能并未明顯提高。
使用c-fos染色及光纖記錄方法(RWD光纖記錄系統)檢測5×FAD小鼠中DG投射SuM神經元的活性,課題組發現在4.5月齡(而非3.5月齡)5×FAD小鼠中DG投射SuM神經元的c- Fos表達和Ca2+活性顯著降低。在4.5月齡的ChR2-AD小鼠中,慢性模式光遺傳刺激SuM導致細胞密度顯著增加,同時樹突棘密度顯著增加。在ChR2-AD小鼠的CA3亞區中,ABN的苔蘚纖維軸突顯著增加,表明SuM增強了ABN與CA3神經元之間的連接。但行為學測試中,AD小鼠的記憶情感功能并未明顯提高。
03
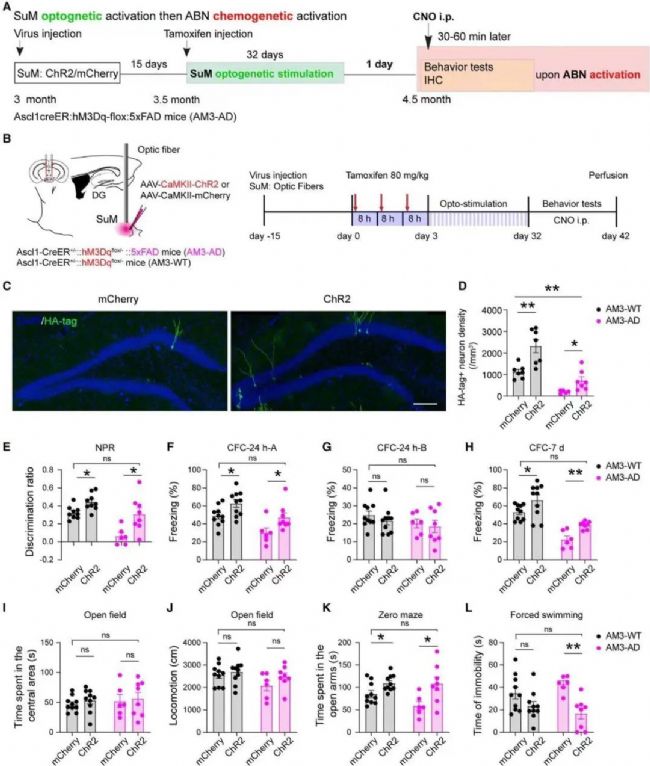
激活SuM增強的ABN可改善5×FAD小鼠的行為缺陷
既然激活受損的ABN或者單純增加ABN數量,均不足以改善AD小鼠記憶情感功能。于是研究人員將二者綜合,綜合調控ABN數量、成熟度和活性,以最.大程度實現對記憶情感功能的調控。研究團隊首先通過光遺傳學刺激4.5個月AD小鼠的SuM,增加ABN數量和成熟度;而后使用化學遺傳學激活SuM環路修飾的ABN,增加其活性。結果顯示,小鼠的空間記憶損害和抑郁樣行為均得到改善,并恢復至健康小鼠的水平。
04
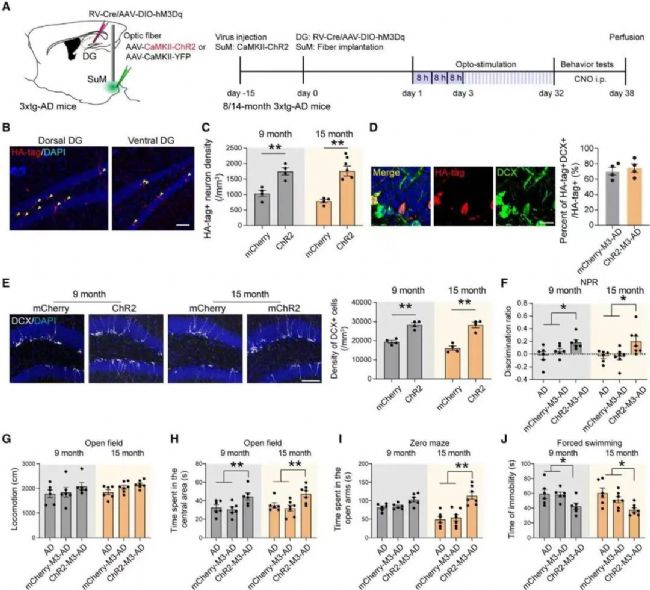
激活SuM增強的ABN可逆轉老齡3×Tg-AD小鼠的行為缺陷
鑒于5×FAD小鼠出現Aβ沉積的時間較早,此類小鼠模型中缺乏對AD至關重要的衰老因子。為了解決這一問題,課題組使用了另外一種AD小鼠模型3× Tg-AD,該模型的AD病理進程比5×FAD小鼠慢得多。同樣發現光遺傳學刺激可增加ABN數量和成熟度,化學遺傳學激活SuM環路修飾的ABN改善了小鼠的空間記憶損害和抑郁樣行為,并且不影響運動。
05
5×FAD小鼠中SuM增強ABN激活介導的信號機制
為了探究激活SuM環路修飾的ABN改善記憶和情感的神經環路和分子機制。作者采用磷酸化蛋白質組學發現SuM刺激的ChR2-AM3-AD小鼠的磷酸化水平發生了改變,但總體蛋白水平沒有顯著改變。對SuM增強的ABN進行急性刺激后,與突觸可塑性相關的通路顯著激活,例如長時程增強(long-term potentiation, LTP)、CREB信號傳導和突觸發生,此外小膠質細胞吞噬斑塊相關的通路也顯著激活。
在海馬的各個亞區中,上述通路中幾種關鍵蛋白的磷酸化水平會在其中的齒狀回、CA3和CA1區發生不同程度的改變。進一步的功能檢驗指出,激活SuM環路修飾的ABN可能通過改變海馬突觸可塑性、神經元活性改善AD認知情感功能,同時促進小膠質細胞吞噬淀粉樣斑塊的作用。
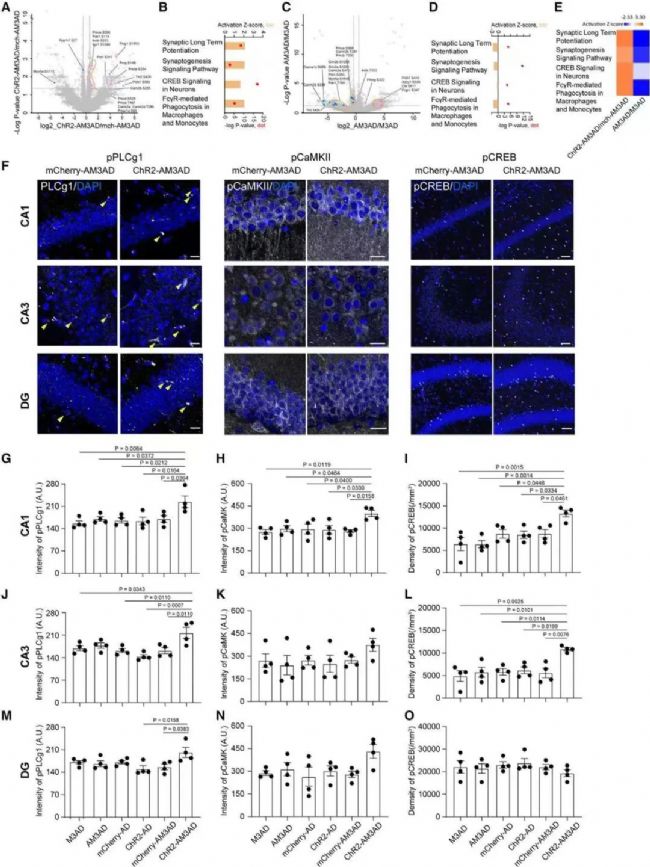
06
SuM增強的ABN的激活增加了AD小鼠CA3和CA1活性
為了對CA1的突觸可塑性進行功能驗證。通過膜片鉗技術記錄海馬LTP,在ChR2-AM3-AD小鼠中,通過CNO處理的ABN的急性化學遺傳激活導致了CA1 LTP的顯著增加。結合蛋白組學的數據,神經元中CREB信號的激活,促使作者思考激活SuM增強的ABN是否會改變局部海馬環路的活動。通過c-Fos染色及光纖記錄(研究使用到RWD光纖記錄系統)證實SuM增強的ABN激活增加了海馬CA3和CA1(而不是DG)的活性。
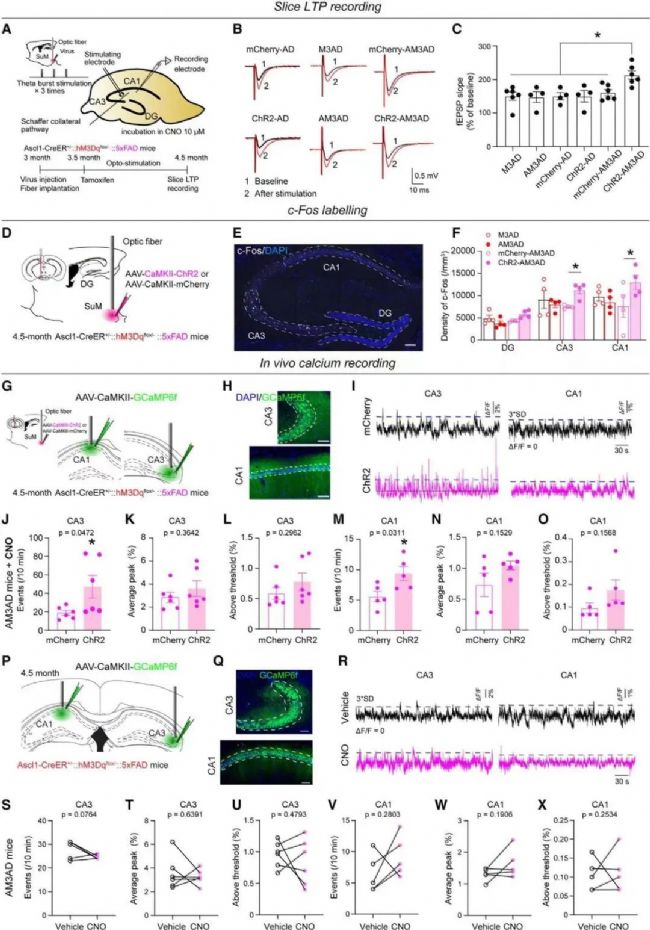
07
在5×FAD小鼠中,SuM增強的ABN的激活增加了小膠質細胞對斑塊的吞噬
通過Imaris成像分析,SuM增強ABN的急性化學遺傳激活后提高了小膠質細胞對斑塊的吞噬作用,SuM增強的ABN的急性激活顯著降低了小膠質細胞的體細胞面積,增加了突起的分支,并降低了形態學指數。這些結果表明,在AD小鼠中,SuM增強的ABNs的激活促進了小膠質細胞對斑塊的吞噬并改善了小膠質細胞的形態。
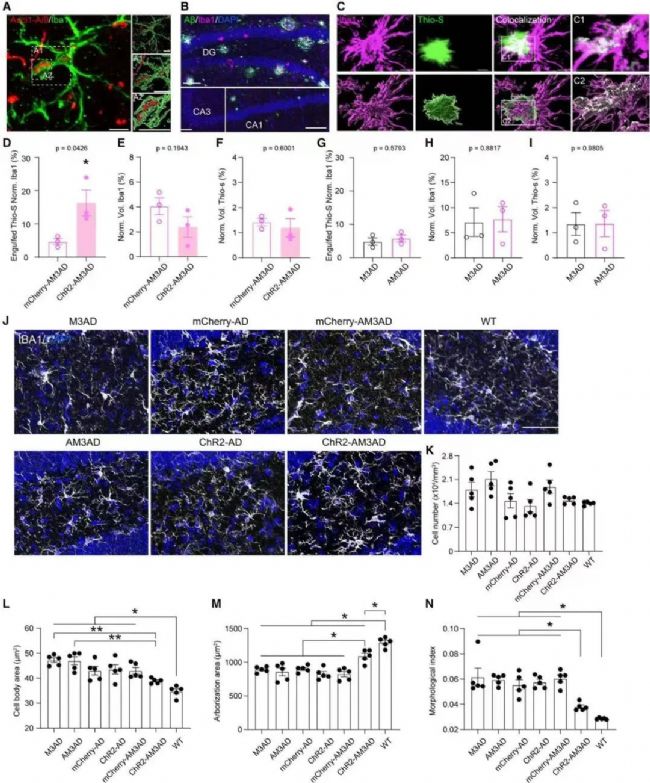
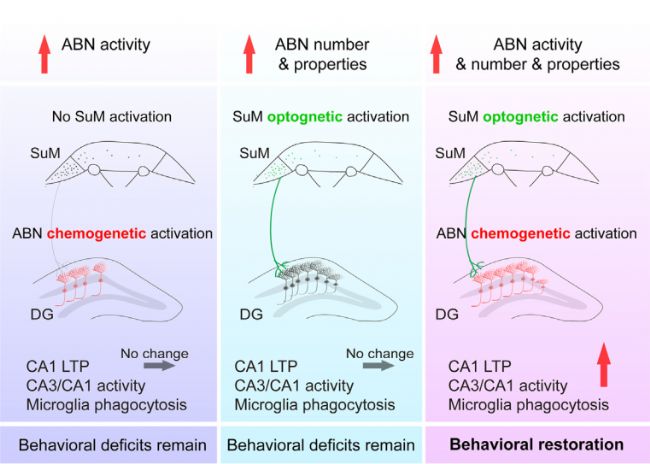
在本研究中,研究人員發現在AD小鼠模型中,模式性光遺傳刺激SuM可增強AHN。SuM環路修飾的ABN的化學遺傳激活可改善AD小鼠的記憶和情緒缺陷。而單獨的SuM刺激或激活非SuM環路修飾的ABN不能恢復AD小鼠的行為缺陷。此外,定量磷酸化蛋白質組學分析揭示了與之產生變化的突觸可塑性和小膠質細胞吞噬相關的經典通路。此項研究證實了SuM增強的ABN在調節AD相關缺陷中的貢獻,僅激活一小部分新生神經元(ABN) 活性,就足以恢復AD相關的認知和情感缺陷;并揭示了由SuM增強的ABN激活介導的信號機制,在AD治療的分子機制上提供了潛在的蛋白靶點,為臨床轉化和藥物開發提供方向。
【人才招聘】上海交通大學松江研究院李亞東課題組誠聘神經科學方向副研究員、博士后和研究助理,具體聯系方式:yadlee@126.com

課題組長介紹:李亞東,獨立PI,研究員,博士生導師。2018年畢業于復旦大學藥理學系,獲理學博士學位。2018-2023年在美國北卡羅來納大學教堂山分校進行博士后訓練。2023年入職上海交通大學松江研究院。李亞東博士長期從事調控睡眠覺醒和學習記憶的神經環路和分子機制研究,相關成果以第一作者發表在Cell Stem Cell, Nature Neuroscience, Molecular Psychiatry, Nature Communications和eLife等期刊,博士后期間獲得美國NARSAD青年科學家獎資助。





