非靶代謝組及脂質組檢測分析在三陰性乳腺癌鐵死亡異質性揭示中的應用
文章標題:Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy
發(fā)表期刊:Cell Metabolism
影響因子:31.373
作者單位:復旦大學附屬腫瘤醫(yī)院
發(fā)表時間:2022年10月
百趣生物提供服務:非靶代謝組+脂質組檢測分析
項目背景介紹
三陰性乳腺癌(Triple-negative breast cancer ,TNBC)是臨床上一種異質性疾病,約占確診乳腺癌的15%。因異質性高、預后差、復發(fā)轉移風險高等特點,成為乳腺癌研究中亟需攻克的頑固“堡壘”。2019年邵志敏/江一舟團隊根據(jù)分子特征、代謝重編程和腫瘤微環(huán)境方面的異質性提出三陰乳腺癌的“復旦分型”,隨后又針對不同亞型進行了系列精準治療臨床試驗。與傳統(tǒng)化療相比,新的療法治療效果水平呈上升趨勢,但是低于預期。
鐵死亡(Ferroptosis)是一種非凋亡性和鐵依賴性細胞死亡方式,近年來在腫瘤研究領域表現(xiàn)活躍。在Fe2+或酯氧合酶的作用下,含多不飽和脂肪酸鏈的磷脂(PE-PUFAs)發(fā)生脂質過氧化,誘導細胞鐵死亡,這一過程受多種代謝途徑的調控,然而TNBC鐵死亡的特性仍未揭示。因此TNBC“復旦分型”仍需進一步的研究,探尋新的治療靶點,以發(fā)現(xiàn)TNBC新的治療突破口。
技術路線
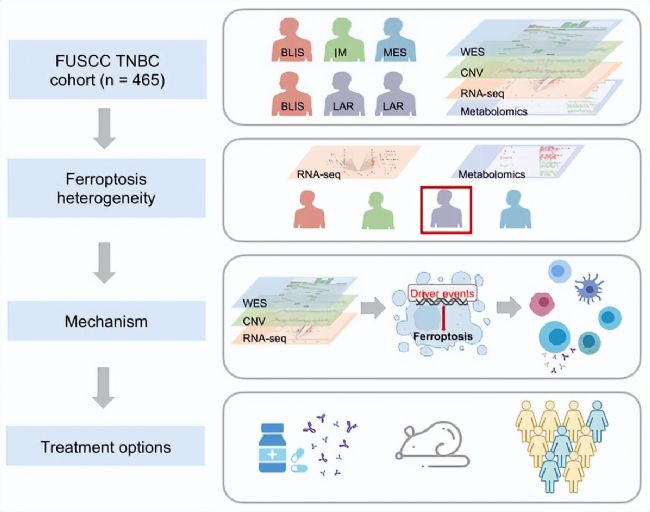
研究結果
1.TNBC“復旦分型”各亞型鐵死亡具有異質性
本研究通過對TNBC轉錄組、非靶代謝組及脂質組數(shù)據(jù)集分析和驗證實驗證實“復旦分型”中各亞型鐵死亡存在異質性。代謝組學分享,間質樣亞型(Mesenchymal-like, MES)呈現(xiàn)HAMP(鐵穩(wěn)態(tài)調節(jié)因子,圖1C)低表達和鐵代謝的失調(圖1E);腔面雄激素受體亞型(luminal androgen receptor, LAR)與鐵死亡相關的代謝途徑被激活(圖1A),鐵死亡相關基因、蛋白及代謝物出現(xiàn)高度活躍(圖1B-F);與LAR亞型相比,免疫調節(jié)亞型(immunomodulatory, IM)和基底樣免疫抑制亞型(basal-like and immune-suppressed, BLIS)鐵死亡相關通路變化水平較低,未出現(xiàn)顯著鐵死亡相關特性(圖1A)。這一結果表明LAR亞型是TNBC中鐵死亡敏感性最高的亞型。
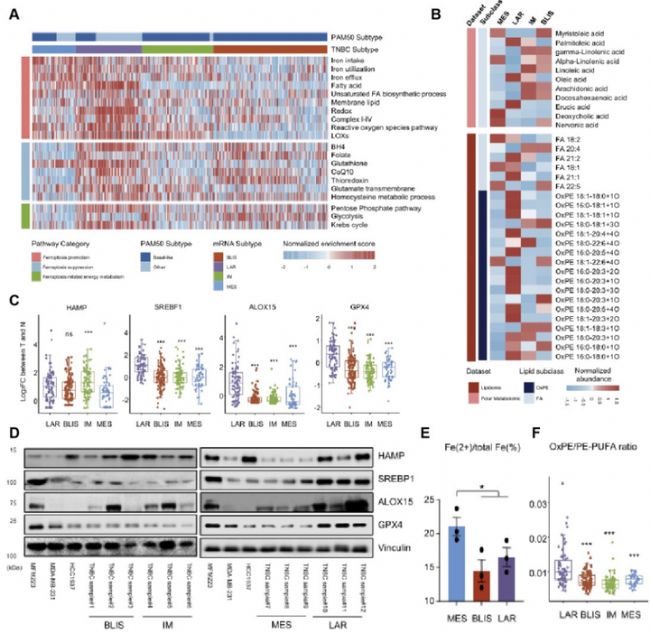
圖1. TNBC各亞型中鐵死亡相關特征的異質性
2.谷胱甘肽(GSH)代謝中的GPX4是調控LAR亞型腫瘤鐵死亡的關鍵靶點
代謝組通路富集分析顯示,LAR亞型腫瘤GSH代謝顯著上調,GPX4在LAR亞型腫瘤中表達量高且對鐵死亡高度敏感(圖1F、圖2)。代謝組學分享,基于以上發(fā)現(xiàn)進行細胞和類器官的藥敏實驗,進一步探索了針對LAR亞型腫瘤鐵死亡的最佳治療策略,結果表明GPX4抑制劑RSL3對LAR亞型抑制效果更加明顯(圖3)。
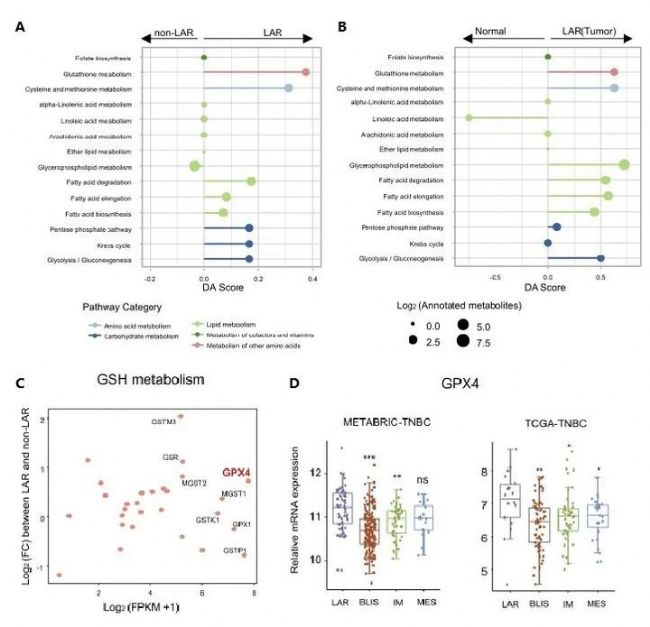
圖2. GSH代謝是抑制LAR亞型腫瘤鐵死亡的關鍵
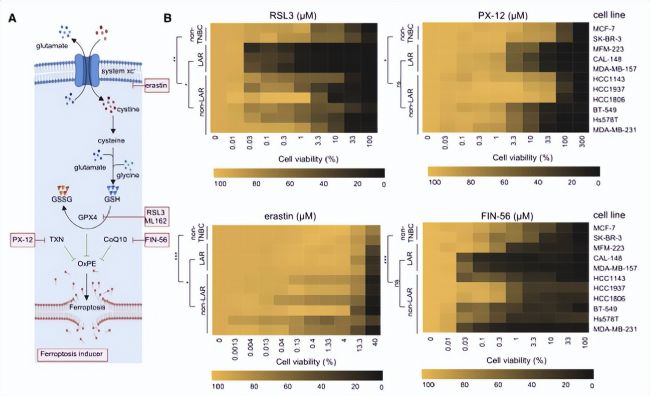
圖3. 不同敏感性的鐵死亡誘導劑突顯了GPX4在LAR亞型腫瘤中的重要性
3. 雄激素受體(AR)與GPX4啟動子結合,雙向調控LAR亞型腫瘤鐵死亡
為了探索LAR亞型腫瘤中GPX4表達增加的機制,作者首先對多組學數(shù)據(jù)進行分析,結果顯示AR信號通路密切相關的FA代謝、雄激素反應等通路與GPX4的表達呈現(xiàn)正相關(圖4A)。免疫印跡和qPCR的結果表明,AR對LAR亞型腫瘤中的GPX4起到調控作用(圖4B)。代謝組學分享,進一步的熒光素酶報告基因及ChIP-qPCR發(fā)現(xiàn)AR與GPX4-2500~-2000bp啟動子區(qū)的AR結合位點(AR binding sites, ABSs)結合并驅動GPX4的表達,從而調控LAR亞型中的GPX4高表達(圖4C)。
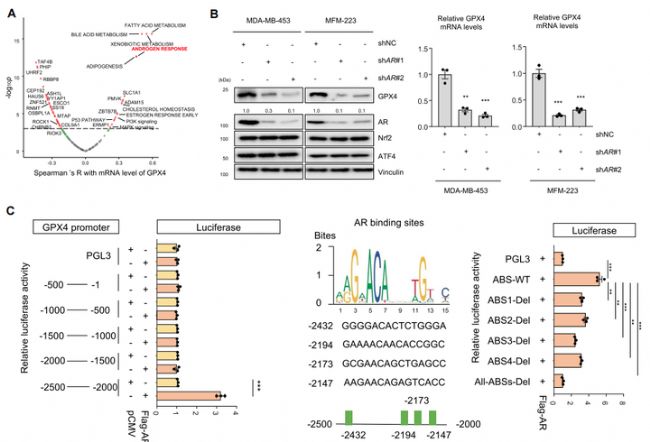
圖4. AR是LAR亞型腫瘤中GPX4表達的關鍵調控因子
基于AR對GPX4的調控作用,作者對AR抑制劑是否與GPX4抑制劑一樣,可以作為促進LAR亞型腫瘤鐵死亡的潛在抑制因子這一問題進行探究。代謝組學分享,通過免疫印跡、脂質過氧化檢測和BODIPY581/591C11染色對AR抑制劑和GPX4抑制劑誘導的LAR亞型腫瘤細胞系鐵死亡進行對比,AR抑制劑并未明顯提高腫瘤細胞內脂質過氧化水平(圖5A-C),究其原因是AR在細胞中的調控作用是雙向的,AR既可以促進鐵死亡相關多不飽和脂肪酸的生物合成,又可以上調GPX4的表達,減少引起鐵死亡的脂質過氧化(圖5D-E)。相較于抑制AR,GPX4抑制劑誘導LAR腫瘤鐵死亡的效果更佳。
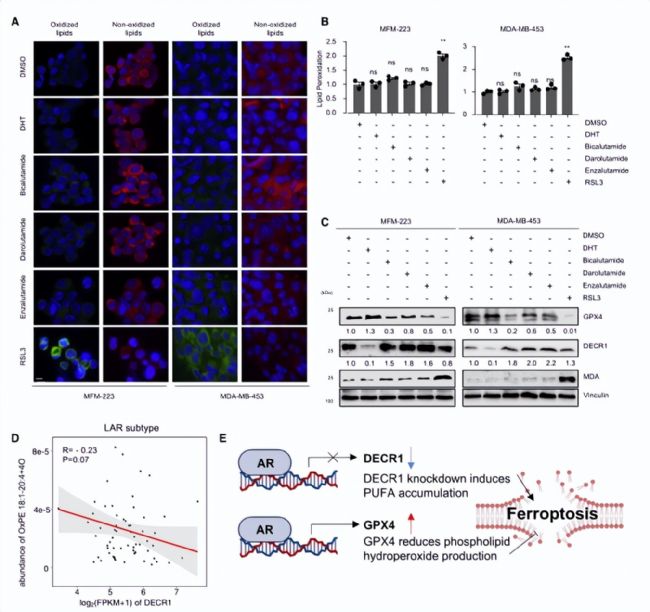
圖5. AR具有雙重作用來調節(jié)鐵死亡
4.GPX4抑制劑抑制腫瘤生長、對腫瘤微環(huán)境進行重編
基于以上的體外研究,確定了LAR亞型的鐵死亡敏感性和GPX4抑制劑具有誘導鐵死亡作用。代謝組學分享,作者通過建立LAR亞型乳腺癌小鼠模型進行體內實驗(圖6A-B),發(fā)現(xiàn)無論是沉默Gpx4基因還是使用GPX4抑制劑都可以顯著誘導腫瘤細胞的鐵死亡,抑制腫瘤生長,增加CD8+、CD4+等不同亞群T細胞數(shù)量,觸發(fā)腫瘤微環(huán)境獲得炎癥表型,使LAR亞型腫瘤微環(huán)境由“冷”轉“熱”(圖6 C-F)。
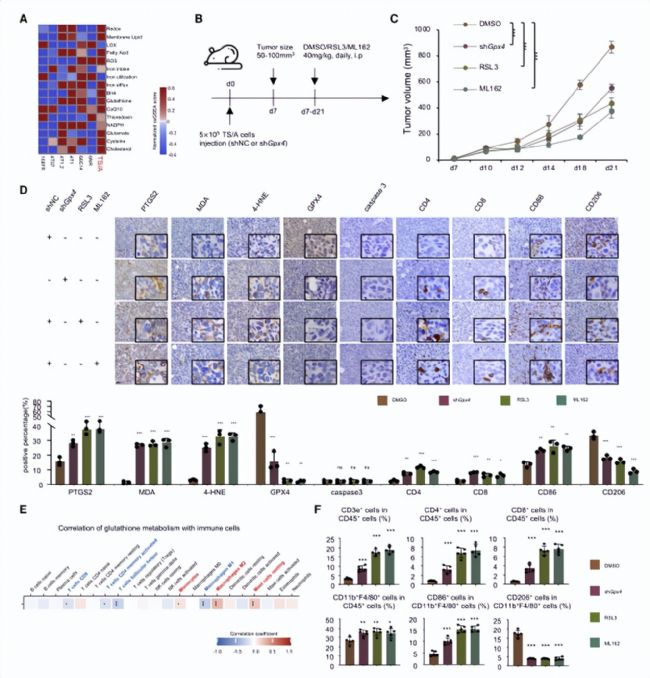
圖6. GPX4抑制劑在體內抑制腫瘤生長并重新編程腫瘤微環(huán)境
5. GPX4抑制劑聯(lián)合ICB療法為LAR亞型腫瘤治療帶來新方向
為了測試GPX4抑制劑和免疫檢查點阻斷(immune checkpoint blockade,ICB)治療是否起到協(xié)同作用,通過TS/A小鼠乳腺癌細胞系來建立TS/A異種移植瘤進行體內實驗(圖7A),結果顯示與單一治療相比,GPX4抑制劑和PD-1抗體聯(lián)合治療顯著抑制腫瘤生長,雖然未引起免疫細胞浸潤,但PRF1+CD8+T細胞和GZMB+CD8+T細胞的比例顯著增加,出現(xiàn)明顯免疫反應(圖7)。代謝組學分享,以上結果表明GPX4抑制劑與ICB聯(lián)合療法治療LAR亞型腫瘤是一種理想的治療策略,臨床免疫治療及小鼠細胞系免疫治療隊列研究也證實這一結果。

圖7. GPX4抑制劑與ICB聯(lián)用療法對LAR亞型腫瘤有顯著治療效果
結論
本研究通過多組學數(shù)據(jù)集分析和體內外實驗驗證系統(tǒng)地揭示了TNBC“復旦分型”各亞型具有鐵死亡異質性,其中LAR亞型腫瘤細胞ROS積累,F(xiàn)A代謝富集,脂氧合酶過度表達,并操縱GSH代謝防止鐵死亡的發(fā)生。代謝組學分享,且LAR亞型腫瘤對鐵死亡抑制劑、尤其是GPX4抑制劑敏感,是鐵死亡治療最為敏感的亞型。基于這些特征,靶向鐵死亡抑制劑與免疫檢查點阻斷相結合的療法,為LAR亞型腫瘤提供了精準治療新方向,為三陰性乳腺癌患者帶來新希望。





