熒光超分辨顯微術淺析與活細胞超分辨成像新進展

本文作者:錢佳銘博士
南京理工大學智能計算成像實驗室
光學顯微鏡
光學顯微鏡(optical microscopy),顧名思義,是通過光學手段將人眼所不能分辨的微小物體放大成像,以供人們提取微細結構的光學儀器。如今,光學顯微鏡已發展成為許多基礎研究和工程應用中的核心技術,廣泛應用于生命科學、生物學、物理學、化學、材料科學、納米技術、工業檢測、醫學等領域,為人類的發展做出了不可磨滅的重大貢獻。早在三百多年前,人類就已經使用光學顯微鏡觀察肉眼無法分辨的微觀物體。1662年,英國物理學家羅伯特·胡克(Robert Hooke,1635—1703年)使用自制的顯微鏡觀察軟木切片,發現其在放大后呈現出類似修道院單人居室的微觀結構,并以拉丁語“Cella”(“細胞”英文單詞“Cell”的由來)命名這些結構,意為“小房間”或“小隔間”。這是人類歷史上第一次觀察到細胞。


圖2 列文虎克制作的顯微鏡及記錄手稿。(a) 列文虎克制作的顯微鏡,先存于烏得勒支大學博物館。(b) 列文虎克繪制的細菌。(c) 列文虎克寄給英國皇家學會的書信之一

圖3 不同時期的奧林巴斯顯微鏡。依次為1920年“旭號”顯微鏡、1927年“昭和號”顯微鏡、1980年“BH2”系列顯微鏡、1983年“AH2”系列顯微鏡、1993年“BX”系列顯微鏡、1996年“MX50”顯微鏡、“IX3”系列研究型倒置顯微鏡、IXplore spinSR超分辨共聚焦顯微鏡
超分辨熒光顯微成像技術
1873年,德國物理學家恩斯特·阿貝(Ernst Karl Abbe,1840—1905年)提出了光學成像系統的衍射極限理論,指出光學顯微鏡的分辨率極限大約是可見光波長的一半(約200nm),這被稱為“阿貝極限”1,2。該問題困擾著科學家長達一個世紀之久,這一時期光學顯微鏡的應用一直被限制在細胞水平而無法在亞細胞層面進行高分辨成像。

圖4 2014年,諾貝爾化學獎授予Eric Betzig,Stefan W. Hell和William E. Moerner三位科學家,以表彰他們對超分辨率熒光顯微成像技術的重大貢獻
· 單分子定位的顯微術
在基于單分子定位的超分辨顯微成像技術中,PALM由2014年諾貝爾獎得主之一Betzig8提出,該技術基于熒光分子的光轉化能力和單分子定位,通過用光控制每次僅有少量隨機離散的單個熒光分子發光,并準確定位單個熒光分子點擴散函數的中心,最終利用多次曝光疊加成一幅超高分辨率圖像(圖5)。
由Hess9提出的熒光活化定位顯微術(fluorescence photoactivation localization microscopy, fPALM)與PLAM原理相似,熒光團經探測器成像后,由光強控制熒光分子被可逆地滅活或不可逆地光漂白而從視場中消失。由Zhuang等10提出的STORM技術與PALM技術在原理上類似,其利用化學小分子Cy3和Cy5、Cy7等熒光分子對的光轉換效應同樣可以達到突破光學極限的效果。與PALM區別在于其所利用的探針是化學小分子而不是生物大分子。因此,STORM需要利用熒光發色團標記抗體對靶蛋白進行識別,可以檢測到內源性蛋白,避免PALM中由于外源性表達偶聯熒光蛋白的靶蛋白對其定位產生的可能的影響。2014年,三個小組分別報道了互補式可激活型熒光蛋白系統,在哺乳動物(PAGFP11和PAmCherry12)和大腸桿菌中(mEos3.213)實現了熒光互補和超高分辨率成像,對二聚化或相互作用蛋白的超高分辨率成像具有重要應用價值。基于單分子定位的超分辨顯微成像技術可實現10~30nm的橫向分辨率,但由于反復激活和淬滅熒光分子,所需時間長,其時間分辨率較低。
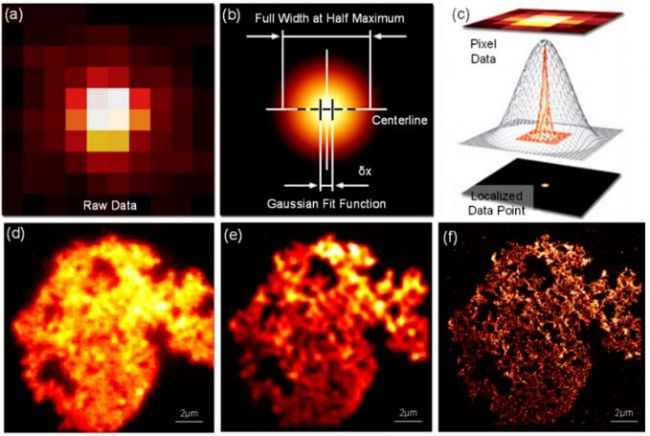 圖5 PALM原理示意圖與結果圖。(a)-(c) PALM原理示意圖,其中圖(a)為探測的單個原始光子圖像,圖(b)對對圖(a)的高斯擬合,圖(c)為定位的圖(a)的中心。(d) 聚苯乙烯微球的寬場圖像。(e) 疊加原始PALM堆棧數據中單分子圖像所獲取的聚苯乙烯微球圖像。(f) 聚苯乙烯微球的PALM超分辨圖像
圖5 PALM原理示意圖與結果圖。(a)-(c) PALM原理示意圖,其中圖(a)為探測的單個原始光子圖像,圖(b)對對圖(a)的高斯擬合,圖(c)為定位的圖(a)的中心。(d) 聚苯乙烯微球的寬場圖像。(e) 疊加原始PALM堆棧數據中單分子圖像所獲取的聚苯乙烯微球圖像。(f) 聚苯乙烯微球的PALM超分辨圖像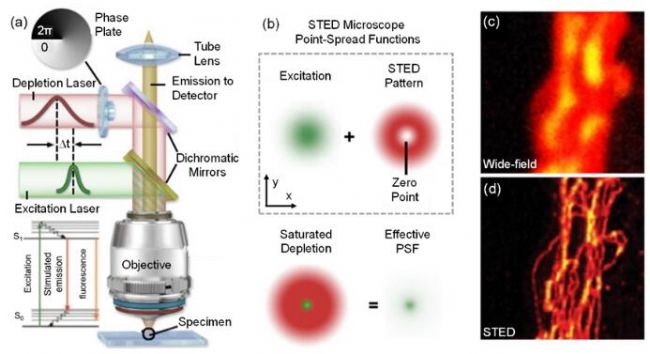
圖6 STED的超分辨原理示意圖和結果圖16。(a) STED典型光學系統。(b) STED超分辨原理。(c) 微管寬場圖
另一種典型的基于點擴散函數調制的超分辨技術是SIM技術。如前所述,成像系統的分辨率受到阿貝衍射極限的限制,存在接近波長一半尺度的衍射極限,物場信息中高于此光學傳遞函數截止頻率的成分將會被濾除。針對這一問題,Gustafsson18于2000年提出了SIM技術,其基本原理是通過結構化照明在頻域以空間混頻的方式將物體高頻信息載入光學系統的探測通帶內實現突破阿貝衍射極限的超分辨光學顯微成像。當利用周期性結構正弦照明光激發樣品時,在頻域上由于結構光頻譜與物頻譜的卷積而產生攜帶物體信息的多級頻譜。其中±1級頻譜將攜帶物體細節信息的高頻部分平移至截止頻率范圍內而被探測,如圖7所示。但這些高頻信息與0級頻譜的低頻信息疊加在一起,需要后期數據處理(如相移、反卷積、參數估計等)將三級頻譜分開才能有效獲得樣品的高頻信息19。由于結構光條紋照射在樣品上也受到系統衍射限制,因此等效截止頻率最多可拓展一倍,即SIM的分辨率最多能在衍射極限基礎上提高一倍,達到非相干衍射極限的2倍,約在100nm20。盡管SIM對橫向分辨率的提升不如PALM、STORM、STED等技術,但其高的光子效率、較快的成像速度和全場成像等優點使得其非常適合進行活細胞的超分辨成像。值得注意的是,光柵衍射效應不僅僅限于±1級頻譜,例如矩形光柵的頻譜就要豐富得多,其還包括±2級、±3級等高階頻譜。
因此,假如能采用矩形光柵作為結構光,則可以產生多級頻譜,使等效截止頻率得到多次拓展從而大幅提高分辨率。但由于結構光的產生也受到光學系統有限孔徑的限制,直接在物平面上形成一個周期接近衍射極限分辨率的矩形光柵并不現實。針對此問題,Gustafsson21在傳統SIM的基礎上進一步提出了飽和結構光照明顯微技術(saturated SIM,SSIM),巧妙地利用熒光分子的飽和激發使樣品在正弦光波激發下發出具有高階頻率分量的非正弦結構光,從而實現多級頻譜拓展[如圖7(b)],將分辨率提高到了約50nm的水平。然而飽和照明所需的高強度激光增加了SSIM的光毒性與光漂白,無法發揮SIM高光子效率、低光損傷的優勢,使其難以運用于活細胞成像,因此并未得到廣泛應用。

實時活細胞超分辨顯微成像
近日,來自南京理工大學的陳錢、左超教授課題組提出一種高效、魯棒的基于主成分分析的結構光照明顯微技術(PCA-SIM),首次實現了在有外界干擾的復雜、低信噪比實驗環境下對照明參數的快速自適應精準補償和對活細胞精細結構的實時、高質量動態超分辨成像31。他們發現,理想無干擾條件下的結構光照明相量矩陣應是一個秩-1矩陣,其僅包括一個“主成分”,在最小二乘意義上描述了相量矩陣處于一個單一維度的“特征子空間”。然而,由于噪聲、光學像差、樣品非均勻調制度等干擾因素,通常情況下實驗上所獲得的相量矩陣會存在不規則的高維分量。如何消除這些高維干擾分量以獲得對應理想照明相量矩陣中單一“主成分”,將是低信噪比條件下進行SIM準確參數估計的關鍵。
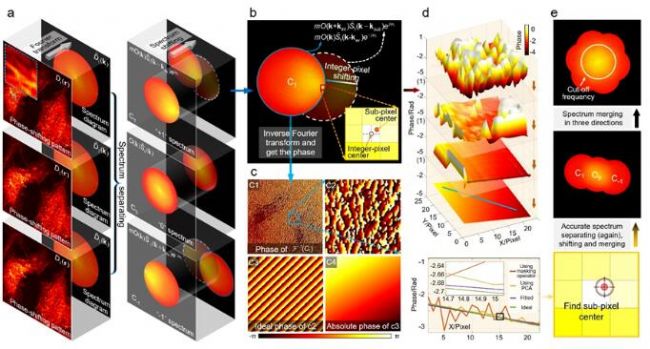
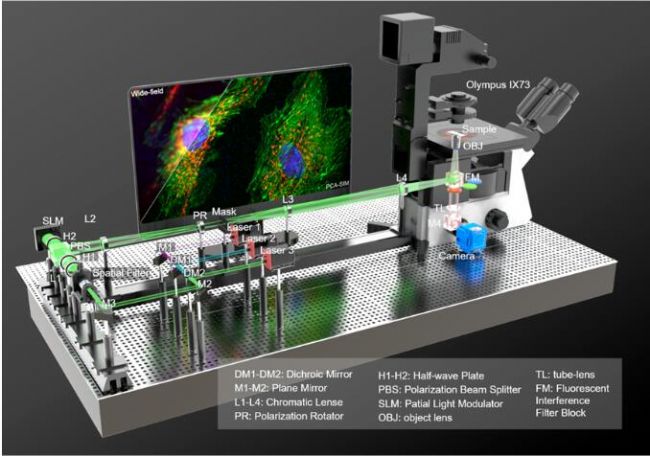
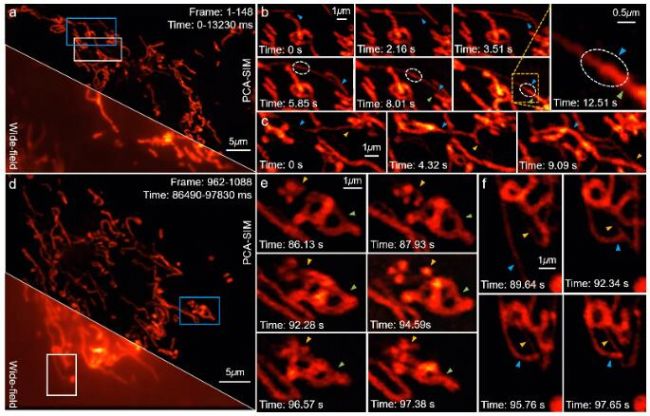
研究者基于PCA-SIM實現了對活體COS-7細胞線粒體的實時超分辨成像,依靠的平臺是基于奧林巴斯IX73倒置熒光顯微鏡自主搭建的三色干涉式SIM超分辨儀器(圖9)。圖10給出了部分實時觀測的活體COS-7細胞的線粒體動態小管事件(mitochondrial dynamic tubulation,MDT)。如圖10(a)-10(b),細長且高度動態的MDT小管從線粒體中不斷延伸,并與其他線粒體發生融合,形成了兩個線粒體之前的膜橋。隨后MDT小管逐漸增厚并趨于穩定,最終構成線粒體網絡。這些實驗現象對研究線粒體網絡的形成以及線粒體功能(如線粒體DNA完整性、細胞凋亡等)的維持具有重要意義。PCA-SIM為研究活細胞中納米尺度結構演化、細胞器互作和生物分子動力學信息提供了一種快速實時、靈活便捷、低光損傷的成像新手段,在生命科學、基礎醫學等領域具有廣闊的應用前景。
產品介紹
【IX3系列研究級倒置顯微鏡】

IX3系列(IX53/73/83)作為能提供活細胞成像的高度可擴展的光學平臺,其建立在雄厚的技術基礎之上,擁有靈活的結構,容易利用的光路,提供高分辨,高反差的寬場圖像。一切設計基于用戶的心聲,科學家的工作流程需要,廣泛應用在細胞生物學,神經生物學,發育生物學,分子生物學,光生物學等領域,將成為科研工作者進行更高水平的活細胞研究的有力武器。

X Line(翼系列)平場二代超復消色差物鏡(PlanXApo),在平場超復消色差(PlanSApo)物鏡的技術基礎上突破創新,在平場性、色差矯正和分辨率三項技術的層面兼收并舉,同時囊括三項技術的尖端參數要求,滿足高質量、大視場、高分辨率精確成像的要求,可以說,一枚物鏡就可以讓我們看得更多、更細、更美,也更自由。
Reference
1. 左超 & 陳錢. 分辨率, 超分辨率與空間帶寬積拓展—從計算光學成像角度的一些思考. 中國光學 中英文 15, 1105–1166 (2022).
2. 左超, 陳錢, & others. 計算光學成像: 何來, 何處, 何去, 何從? 紅外與激光工程 51, 20220110 (2022).
3. Westphal, V. et al. Video-rate far-field optical nanoscopy dissects synaptic vesicle movement. Science 320, 246–249 (2008).
4. Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82–87 (2000).
5. Betzig, E. et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313, 1642–1645 (2006).
6. Rust, M. J., Bates, M. & Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods 3, 793–796 (2006).
7. Weiss, P. S. Nobel prizes for super-resolution imaging. (2014).
8. Betzig, E. et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313, 1642–1645 (2006).
9. Hess, S. T., Girirajan, T. P. & Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91, 4258–4272 (2006).
10. Rust, M. J., Bates, M. & Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods 3, 793 (2006).
11. Xia, P. et al. Superresolution imaging reveals structural features of EB1 in microtubule plus-end tracking. Mol. Biol. Cell 25, 4166–4173 (2014).
12. Nickerson, A., Huang, T., Lin, L.-J. & Nan, X. Photoactivated localization microscopy with bimolecular fluorescence complementation (BiFC-PALM) for nanoscale imaging of protein-protein interactions in cells. PloS One 9, e100589 (2014).
13. Liu, Z. et al. Super-resolution imaging and tracking of protein–protein interactions in sub-diffraction cellular space. Nat. Commun. 5, 4443 (2014).
14. Hell, S. W. & Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett.19, 780–782 (1994).
15. Klar, T. A., Jakobs, S., Dyba, M., Egner, A. & Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proc. Natl. Acad. Sci. 97, 8206–8210 (2000).
16. Hell, S. W. Far-field optical nanoscopy. science 316, 1153–1158 (2007).
17. Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R. & Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis.Nature 440, 935 (2006).
18. Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82–87 (2000).
19. Eggeling, C., Willig, K. I., Sahl, S. J. & Hell, S. W. Lens-based fluorescence nanoscopy.Q. Rev. Biophys. 48, 178–243 (2015).
20. Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L. & Gustafsson, M. G. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods 6, 339 (2009).
21. Gustafsson, M. G. Nonlinear structured-illumination microscopy: wide-field fluorescence imaging with theoretically unlimited resolution. Proc. Natl. Acad. Sci. 102, 13081–13086 (2005).
22. Li, D. et al.Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349, aab3500–aab3500 (2015).
23. Li, D. et al.Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349, (2015).
24. Markwirth, A. et al. Video-rate multi-color structured illumination microscopy with simultaneous real-time reconstruction. Nat. Commun. 10, 1–11 (2019).
25. Wang, Z. et al. High-speed image reconstruction for optically sectioned, super-resolution structured illumination microscopy. Adv. Photonics 4, 026003 (2022).
26. Müller, M., Mönkemöller, V., Hennig, S., Hübner, W. & Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nat. Commun. 7, 1–6 (2016).
27. Huang, X. et al. Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nat. Biotechnol. 36, 451–459 (2018).
28. Shroff, S. A., Fienup, J. R. & Williams, D. R. Phase-shift estimation in sinusoidally illuminated images for lateral superresolution. J. Opt. Soc. Am. A 26, 413 (2009).
29. Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express 21, 24692 (2013).
30. Gustafsson, M. G. L. et al. Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophys. J. 94, 4957–4970 (2008).
31. Qian, J. et al. Structured illumination microscopy based on principal component analysis. eLight 3, 4 (2023).





