siRNA小干擾RNA轉染實驗操作流程介紹及要點
siRNA(小干擾RNA)是一種新型的基因治療工具,是由21-25個核苷酸組成的雙鏈短RNA分子,能夠特異性地誘導靶基因的沉默,進而抑制蛋白的表達。siRNA最初由Andrew Fire和Craig Melo在1998年提出,之后在2001年被證明可以特異性地抑制哺乳動物細胞中的靶基因表達。這一發現由David Baulcombe團隊在《科學》雜志上發表,成為當年全球十大科學進展之首,他的團隊并于2006年榮膺了諾貝爾生理學或醫學獎。
siRNA的抑制作用是通過其與AGO蛋白組裝成的RNA誘導沉默復合體(RISC)發揮的。一條鏈被降解,另一條鏈則與靶基因的mRNA互補配對,使其被切割降解,從而達到治療相關疾病的目的。與傳統的基因治療相比,siRNA具有高度特異性、快速、可逆性等優點,可以應用于各種真核生物的基因功能研究,藥靶發現及藥物篩選中廣泛應用。例如siRNA靶向惡性腫瘤的基因可以通過局部或系統性給藥來治療腫瘤,病毒感染和遺傳疾病也都有涉及。
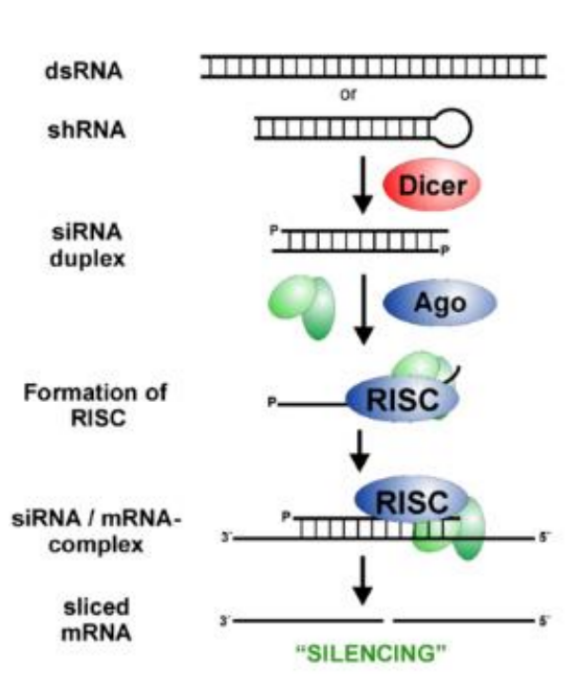
siRNA 抑制蛋白表達機制
為了方便使用,常規siRNA產品以凍干粉形式提供,可以直接用于各種細胞RNAi實驗。科研人員可以根據需要設計特定靶點,覆蓋人、小鼠、大鼠全基因組的所有基因。同時,通過對siRNA進行化學修飾,可以提高其在體內實驗中的高效性、特異性和穩定性。
RNA干擾(RNAi)是一種廣泛存在于生物體內的序列特異性基因轉錄后的沉默過程,常常被用作基因沉默(基因干擾)的工具之一。siRNA作為RNAi的一種形式,具有非常廣闊的應用前景。未來,siRNA還將繼續發揮其獨特的優勢,成為治療相關疾病的新趨勢。
siRNA轉染實驗介紹
01- siRNA儲存
常規化學合成的siRNA序列為21~23nt的雙鏈小分子RNA,為凍干粉形式的即用型試劑 ,在常溫不溶解的情況下可以保存至少1個月時間,放置于-20℃~-80℃低溫環境中,凍干粉可以穩定保存一年。
02- 轉染試劑儲存
4℃保存,不可冷凍。
03-體外轉染操作流程:
第一步、接種細胞:建議提前一天接種細胞,接種數量參考下方推薦量。
第二步、 轉染復合液配制:
● siRNA稀釋液配制:siRNA以水稀釋至140 μg/mL。
● siRNA轉染復合液配制:取無菌離心管,加入2μL siRNA稀釋液,加入LipidnanoTM Super RNAi轉染試劑A液14μL,吹打混勻,加入LipidnanoTM Super RNAi轉染試劑B液4μL,混合均勻,室溫放置5min,加培養液180μL,吹打混勻。
第三步、細胞加樣:按下方推薦量將配制好的siRNA轉染復合液加入各細胞孔中,搖動培養板,輕輕混勻。
第四步、細胞培養:37 ℃,5% CO2 培養箱培養,直至發揮干擾作用。建議24~48h測定mRNA水平、48~72h測定蛋白水平。
操作流程示例
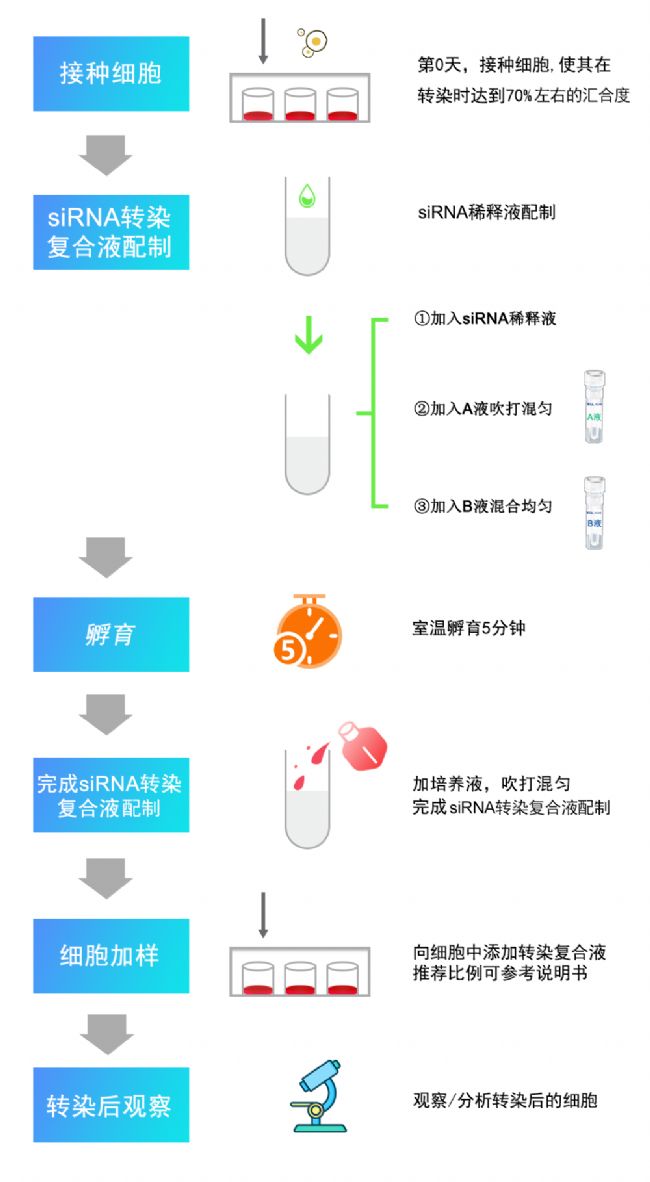
siRNA樣品加入示例
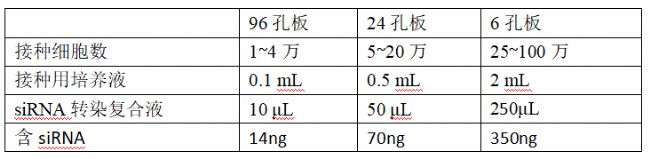
注:使用本轉染試劑對細胞進行siRNA轉染時,為了獲得最佳基因沉默效果,每一種細胞系轉染siRNA的劑量都需要經過實驗確定最佳范圍。
示例中使用的體外轉染試劑為同立海源生產的LipidnanoTM Super RNAi轉染試劑,主要應用于:貼壁細胞和懸浮細胞轉染,部分原代細胞和轉化細胞株的基因轉染,siRNA高通量轉染試驗。在進行體外轉染實驗的過程中,實驗還需注意這些細節:
❶ 轉染前,確保siRNA是經過PAGE純化和脫鹽處理過的,高純度的siRNA或者miRNA有助于獲得較高的轉染效率,并確保 siRNA/miRNA 基因沉默表達不會影響細胞活力。
❷ 首次轉染:如果您是首次轉染您的細胞系,推薦嘗試使用幾個siRNA轉染試劑復合液濃度,并在0.014μg/mL~0.70μg/mL范圍內改變siRNA的濃度,根據首次轉染結果調整劑量水平。
❸ siRNA轉染試劑稀釋液的選擇:對培養基無特殊要求,可使用完全培養基進行稀釋,不強要求減/無血清培養基。
❹ 濃度換算:摩爾濃度與質量濃度之間的換算關系可根據siRNA分子量可進行同步換算。X nmol/L*分子量=Y ng/L,如分子量為14000的siRNA,1nmol/L*14000=14000ng/L=14μg/L。
❺ 轉染細胞密度:推薦在70%左右時進行轉染。通常基因沉默的分析要在轉染后24小時進行。本轉染試劑極低的細胞毒性可以方便研究者根據目的細胞生長特性,靶基因的表達特性,選擇適合條件進行轉染。健康的細胞培養物和嚴格的操作確保轉染的重復性。通常健康的細胞轉染效率較高,較低的傳代數能確保每次實驗所用細胞的穩定性。推薦用50代以下的細胞轉染。
❻ 陽性對照選擇:通過合適的陽性對照、實驗siRNA優化轉染和檢測條件,對大多數細胞,GADPH-siRNA是較好的陽性對照。將不同濃度的陽性對照siRNA或實驗siRNA轉入靶細胞,轉染24小時后,以內參基因如β-actin mRNA為對照,統計目標mRNA相對于未轉染細胞的降低水平。
傳統轉染試劑可通過表面正電荷幫助siRNA大量攝取入胞,但入胞后siRNA內含體逃逸水平低,造成攝取的siRNA無法發揮作用,同時造成細胞毒性。本品為非強正電性脂質轉染試劑,避免細胞大量攝取造成的毒性,但本品可提升細胞內吞后的siRNA內含體逃逸效率,通過促進內含體逃逸使更多siRNA釋放入細胞質中實現高效基因沉默作用。故在細胞水平上通過熒光標記siRNA進行條件優化的方法不適用于本轉染試劑。推薦使用Western Blot或QPCR方式對最佳轉染濃度進行優化。
❼ 操作注意:siRNA與轉染試劑A液實現充分混合后加入B液,繼續混合均勻,放置5min后加入培養基稀釋,稀釋后需在1h內加入細胞孔內。將siRNA轉染試劑復合液加至每一個包含細胞和培養基的孔中,加入后可以輕輕地前后搖動培養板混合均勻。
❽ 避免RNA酶污染:微量RNA酶會導致siRNA實驗失敗。由于實驗環境中RNA酶普遍存在,如皮膚、頭發、所有徒手接觸過的物品或暴露在空氣中的物品。因此請確保實驗每個步驟不受RNA酶污染。推薦使用商業化無酶實驗耗材。
❾ 效果評價:細胞轉染后,不同細胞和siRNA效率存在差異。在mRNA水平觀察siRNA效果的最佳時間是轉染后24~48小時,在蛋白水平觀察siRNA效果的最佳時間是轉染后48~72小時。siRNA干擾是非線性的,不同基因半衰期存在較大差異,首次進行siRNA干擾效果測定時,建議多點測定,確定最佳測定時間點。
siRNA沉默效果分析
siRNA 轉染細胞后,siRNA 在細胞內一系列酶的作用下形成RNA誘導的沉默復合物(RISC),識別并切割靶基因mRNA,誘發宿主細胞針對這些mRNA的降解反應, 從而抑制了細胞內目的基因蛋白的表達,一般可從兩個方面進行檢測。mRNA 水平 - qPCR檢測:
siRNA的作用機理在于其引起靶基因mRNA的降解,因此mRNA的降解水平是siRNA 沉默效率的直接證明。一般在siRNA轉染后24小時后即可檢測到靶mRNA水平的降低,可采用細胞總RNA提取,全長cDNA合成,熒光定量實驗即可檢測到mRNA 的敲除效率。
蛋白水平 - WB檢測:
siRNA引起靶基因mRNA的降解,從而影響了靶蛋白的表達。但蛋白水平檢測時間受細胞內目的蛋白表達量、穩定性、半衰期、甚至其他調控等因素的影響,蛋白質水平下降的幅度與mRNA水平下降不一定成線性正比關系。一般在轉染后48小時后開始WB檢測,并于72小時、96 小時甚至更長時間之后多點采樣。
小結:RNA轉染過程中的影響因素比較多,主要可以歸納為轉染方法、轉染試劑和轉染細胞等三個方面。除此之外,RNA的結構、RNA轉染時RNA的用量、RNase的污染、進入細胞后RNA的降解等因素也會使RNA轉染過程更加復雜、給轉染結果帶來影響,其中RNA在轉入細胞后的降解問題在RNA轉染過程中是比較重要的,如果轉染的RNA在進入細胞體后大量降解,那么實驗結果就很不準確了。
說明:本文僅用于傳播知識、普及科學,不構成任何醫療建議,如有版權等問題,請隨時聯系我們。





