抗腫瘤靶向藥物直接療法和間接療法的作用機制
癌癥是人類最常見的死亡原因之一。癌癥的主要特征是細胞不受控制和侵入性生長,這些細胞可能在轉移的過程中通過血液和淋巴管擴散到身體的其他部位。靶向治療是一種旨在干擾腫瘤生長或進展中起關鍵作用的特定靶蛋白的治療手段。與傳統化療藥物相比,靶向藥物可特異性靶向癌細胞,且不影響正常細胞,具有高效、低毒的特點。
靶向治療包括各種各樣的直接和間接方法。
直接方法: 通過小分子藥物或單克隆抗體 (MAbs) 直接靶向腫瘤抗原以改變其信號轉導,它們通過多種方式治療癌癥,如幫助免疫系統摧毀癌細胞,作用靶點如免疫檢查點 PD-1、PD-L1 等;干擾癌細胞分裂信號蛋白阻止癌細胞生長,如 EGFR、HER2、mTOR 等。
間接方法: 以表達于細胞表面的腫瘤抗原作為效應分子配體 (如放射型配體) 的靶標 (即配體靶向療法),利用配體與癌細胞質膜上受體的親和性,將抗癌藥物運送到腫瘤組織提高治療效果。
藥物可以通過綁定腫瘤特異性單克隆抗體或肽配體與腫瘤細胞上的受體結合,從而靶向腫瘤。如: 177Lu-PSMA-617,一種小分子化合物 (PSMA-617) 和治療性放射性同位素 (177Lu) 的結合的PSMA 靶向性放射配體。對 177Lu-PSMA-617 與表達 PSMA 的前列腺癌細胞結合,放射性同位素的輻射會損傷腫瘤細胞,破壞其復制能力并觸發細胞死亡。
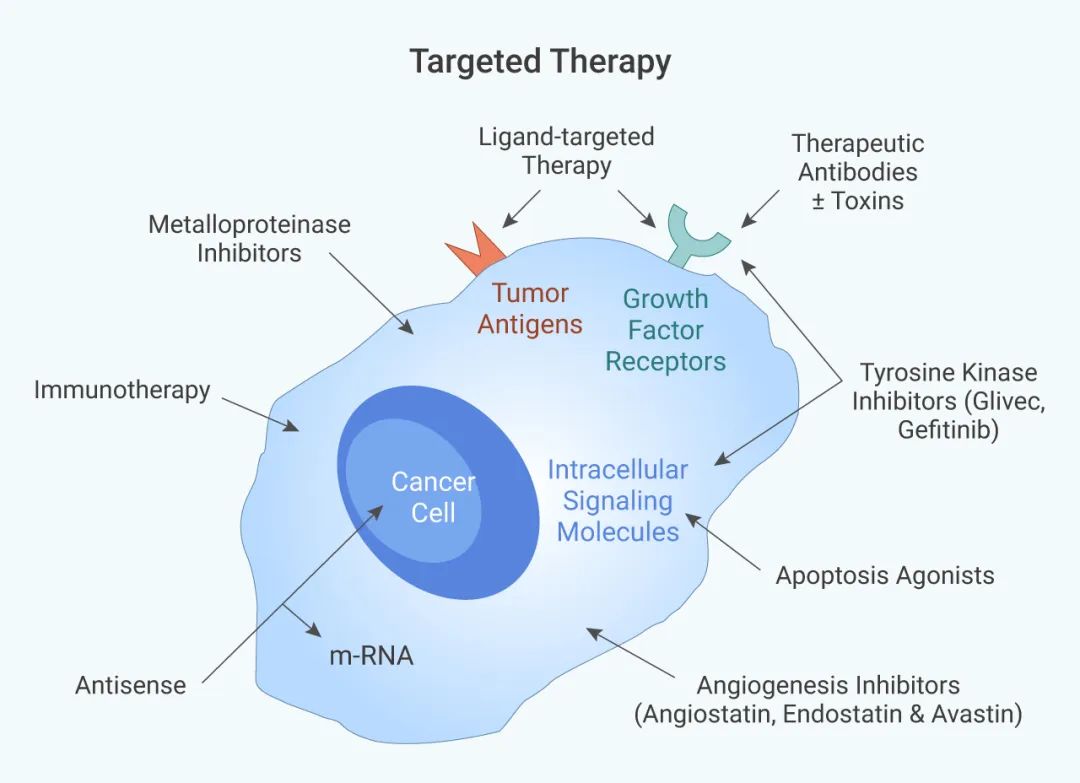
血管生成是癌癥的標志之一,在腫瘤發生過程中起著至關重要的作用,新血管的形成為腫瘤提供營養和氧氣并負責清除代謝廢物,還涉及腫瘤細胞的轉移。因此,可通過血管生成抑制劑抑制血管生成的信號靶點如 VEGF/VEGFR、PDGFR、MEK 等,最終阻斷腫瘤增殖和轉移所需的營養物質和氧氣,導致腫瘤“餓死” (圖 1)。
圖 1. 靶向治療[1]
直接療法:小分子抑制劑或激動劑,間接療法:配體靶向療法
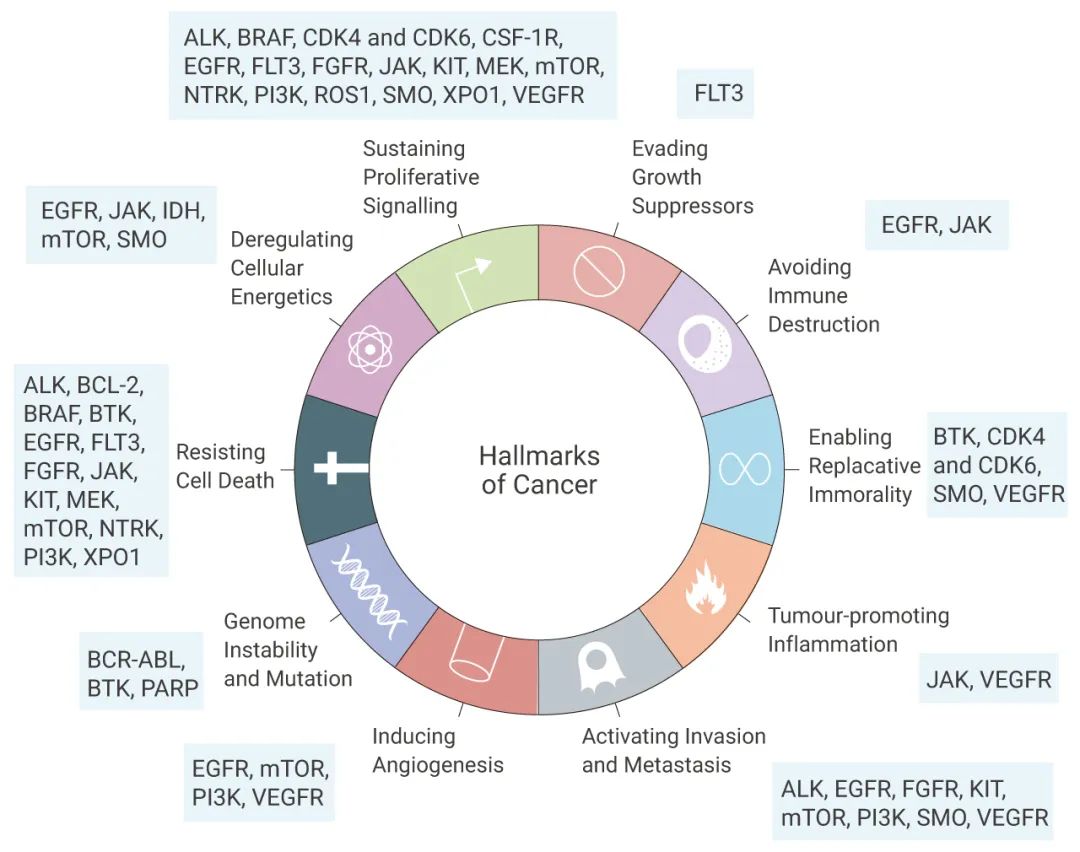
小分子靶向化合物的原理是靶向腫瘤發生的分子生物學機制,通常這些藥物作用為調節蛋白靶點的活性。過去幾十年已有許多靶向癌癥的小分子藥物成功應用于臨床治療。大多數這些藥物抑制關鍵的癌癥靶點,如絲氨酸/蘇氨酸/酪氨酸激酶、基質金屬蛋白酶 (MMP)、熱休克蛋白 (HSP)、蛋白酶體和在信號轉導途徑中發揮作用的蛋白質 (如受體)。
圖 2. 部分熱門癌癥靶點蛋白[3]
蛋白激酶在細胞生長、增殖和分化中具有重要作用。人類激酶組包含約 535 種蛋白激酶。根據底物殘基,蛋白激酶可分為酪氨酸激酶 (包括受體和非受體酪氨酸激酶)、絲氨酸/蘇氨酸激酶和酪氨酸激酶樣酶。蛋白激酶的失調與多種疾病有關,尤其是癌癥。蛋白激酶是研究最廣泛的腫瘤治療靶點,大約 30% 的抗癌藥物發現研究集中在激酶抑制劑。
靶向受體酪氨酸激酶:受體酪氨酸激酶通常被作為抗癌藥物的關鍵靶標,因為它們的異常激活通常會導致下游信號傳導。幾種具有內在酪氨酸激酶活性的生長因子受體與腫瘤疾病的發展和進展有關,如 EGFRs、VEGFR、血小板衍生生長因子受體 (PDGFR)、肝細胞生長因子受體 (HGFR) 等,它們通常在大多數癌癥中具有組成型活性,并且已發現使用小分子抑制劑抑制這些激酶可使腫瘤細胞對細胞凋亡敏感。
EGFR 組成型激活的突變與許多人類腫瘤有關,許多表皮生長因子受體酪氨酸激酶抑制劑 (EGFR-TKI) 已被開發并成功用于臨床,如 EGFR 小分子藥物 Lapatinib 被 FDA 批準為 EGFR 突變陽性轉移性 NSCLC 孤兒藥、Ramucirumab + 厄洛替尼用于 First-line 轉移性 NSCLC 治療。
間變性淋巴瘤激酶 (ALK),胰島素受體家族的單一跨膜酪氨酸激酶。已在多種人類癌癥中發現通過點突變或染色體重排激活 ALK,如間變性大細胞淋巴瘤、彌漫性大 B 細胞淋巴瘤 (DLBCL)、炎性肌纖維母細胞瘤、非小細胞肺癌 (NSCLC)。2022 年 3 月,Brigatinib 被 NMPA 批準在中國上市,作為一種 ALK 的強效抑制劑,Brigatinib 可抑制 ALK 以及 ALK 融合蛋白,從而抑制腫瘤的生長。
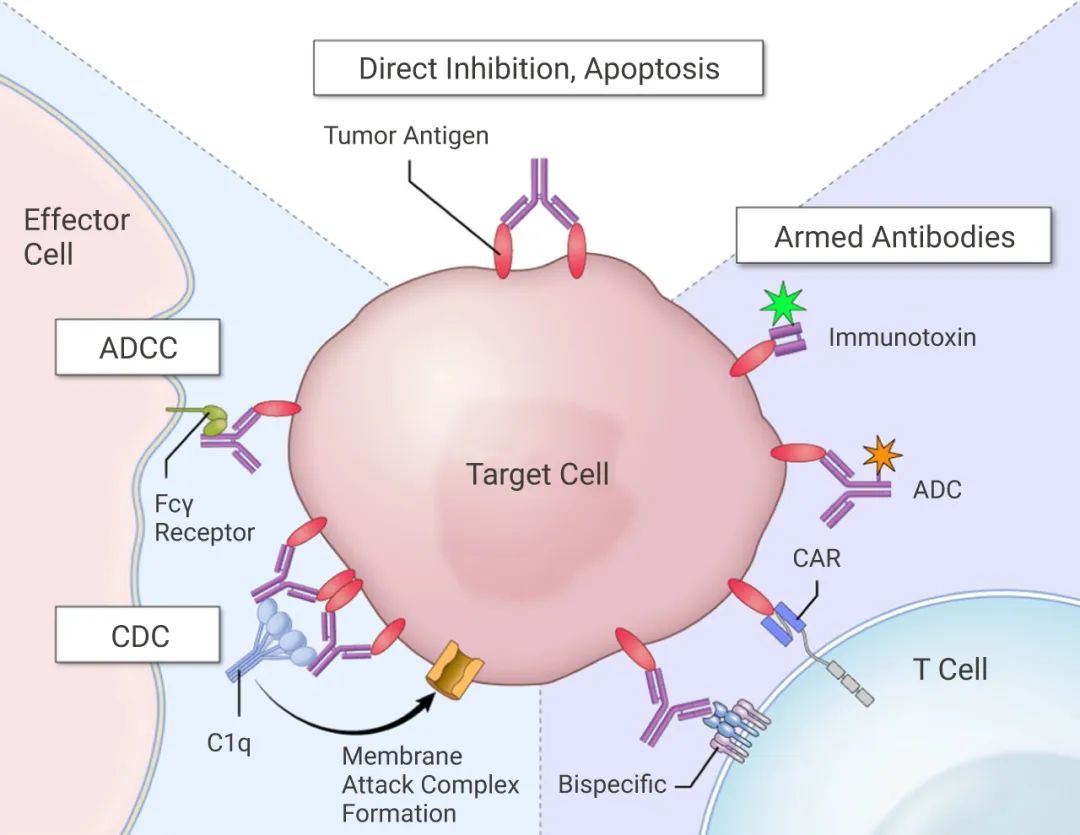
針對細胞表面抗原的抗體可能在幾個方面起作用。
(a) 通過誘導細胞凋亡或抑制細胞生長的關鍵信號通路直接抑制腫瘤細胞增殖。
(b) 可通過啟動抗體依賴性細胞介導細胞毒性 (ADCC) 和補體依賴性細胞毒性 (CDC) 來殺死目標腫瘤細胞。
(c) 招募免疫細胞,如T細胞或嵌合抗原受體 (CAR) T 細胞。
(d) 通過傳遞包括細菌毒素 (免疫毒素) 或毒性小分子 (抗體藥物偶聯物) 在內的細胞毒素來殺死腫瘤細胞。
特異性靶向疾病細胞的單克隆抗體 (MAbs) 被認為是最有希望成為對抗癌癥的優秀候選者。臨床上大多的抗體通過直接靶向腫瘤細胞 (直接靶向抗體),例如特異性抗 CD38 的單克隆抗體達雷木單抗 (Daratumumab),或通過靶向和激活免疫細胞,使其在腫瘤微環境中尋找并殺死癌細胞發揮抗腫瘤活性 (免疫檢查點抗體),如抗 CTLA-4 的伊匹木單抗 (Lpilimumab)。
此外,其它熱門抗體靶點包括:血管生成素 (Angiopoietin)、BCMA、CD19、CD20、CD22、EGFR、EpCAM、HER2、VEGF-R、DKK-1 等。
圖 3. 基于抗體的癌癥治療機制[4]
另外,在藥物研發中,對蛋白質-蛋白質相互作用 (PPI) 的抑制引起了研究者的廣泛關注。PPIs 是各種生物學過程的核心,PPI 系統將不同的酶與其蛋白質底物連接起來,調節蛋白質的活性,其功能障礙涉及一系列包括癌癥等人類疾病的發病機制。因此,靶向 PPI 可能是一種可行的癌癥治療方法,因為這些網絡的異常活動通常直接導致腫瘤進展。
多種重組蛋白表達方法已被開發用于藥物篩選和結構研究,MCE 提供多種類別產品,如受體蛋白、酶、免疫檢查點蛋白、CAR-T 相關蛋白等藥物靶標蛋白,可應用于蛋白結構、蛋白相互作用、蛋白-小分子相互作用研究、藥物篩選,助力藥物研發!
| EGFR | HER2/neu | VEGFR |
| Bcr-Abl | ALK | RET |
| PDGFR | FGFR-1 | HGFR |
| FLT-3 | KIT | CSF-1 |
| B-Raf | JAK | c-Met |
| MMPs | FLT3 | CDK |
|
相關產品 |
|
EGFR 存在于細胞表面,多種配體能結合并激活 EGFR,包括表皮生長因子 (EGF)、轉化生長因子 (TGF-α)、雙調蛋白、肝素結合 EGF 樣生長因子和 β 細胞蛋白,涉及 Ras-Raf-MAPK、PI-3K/Akt、PKC 和 Stat/Jak 通路的激活,參與調控細胞增殖、分化和存活。 |
|
HER2 是表皮生長因子受體家族的成員,與其他配體結合的 EGF 受體家族成員緊密結合,形成異源二聚體,穩定配體結合,增強激酶介導的下游信號通路。在許多癌癥中,包括乳腺癌、胃癌和卵巢癌,HER2 過表達。 |
|
FGFR 是表達在細胞膜上的受體酪氨酸激酶成員,參與多種生物過程,包括細胞生長、遷移、分化、生存和凋亡,對胚胎和神經發育、骨骼和器官形成至關重要。多種腫瘤的發生中伴隨著腫瘤組織的 FGFR 過表達和激活,它們可促進腫瘤血管形成和腫瘤細胞分裂增殖等。 |
|
c-Met/HGFR 是一種可以與肝細胞生長因子(HGF)結合的受體酪氨酸激酶,當表達或調節異常時則可促進腫瘤細胞的增殖與轉移。c-MET 通路異常激活存在于諸多實體瘤中,包括腦瘤、乳腺癌、結直腸癌、胃癌、頭頸癌等。 |
|
CSF-1R 激活需要 CSF-1 結合和受體二聚化,CSF-1R 與其配體 CSF-1 和 IL-34 結合后被激活,從而對單核-巨噬細胞的增殖分化與生長起著重要作用。 |
參考文獻
1. Han-Chung Wu, et al. Targeted Therapy for Cancer. January 2006. Journal of Cancer Molecules 2(2).
2. Lei Zhong, Yueshan Li, Shengyong Yang, et al. Small molecules in targeted cancer therapy: advances, challenges, and future perspectives. Signal Transduct Target Ther. 2021 May 31;6(1):201.
3. Philippe L Bedard, David M Hyman, et al. Small molecules, big impact: 20 years of targeted therapy in oncology. Lancet. 2020 Mar 28;395(10229):1078-1088.
4. Bhupinder Kumar, Sandeep Singh, Ira Skvortsova3, and Vinod Kumar. Promising Targets in Anti-cancer Drug Development: Recent Updates. Curr Med Chem. 2017;24(42):4729-4752.
5. Lavanya V, Mohamed Adil A.A, Shazia Jamal, Arun K. Rishi et al. Small molecule inhibitors as emerging cancer therapeutics. Integr Cancer Sci Therap. 2014.
6. Ingrid Teige, Linda Mårtensson, and Björn L. Frendéus, et al. Targeting the Antibody Checkpoints to Enhance Cancer Immunotherapy–Focus on FcγRIIB. Front Immunol. 2019; 10: 481.
7. Mitchell Ho. Inaugural Editorial: Searching for Magic Bullets. Antib Ther. 2018 Jun;1(1):1-5.
8. Shijie Jin, Yanping Sun, Shuqing Chen, Liqiang Pan, et al. Emerging new therapeutic antibody derivatives for cancer treatment. Signal Transduct Target Ther. 2022 Feb 7;7(1):39.
9. Heather J. Bax, Debra H. Josephs, Sophia N. Karagiannis, et al. Therapeutic targets and new directions for antibodies developed for ovarian cancer. MAbs. 2016 Nov-Dec; 8(8): 1437–1455.
10. Guoqiang Sun, Hongyong Cao, Ye Cheng, Weiwei Tang, Yangbai Sun, et al. Role of Small Molecule Targeted Compounds in Cancer: Progress, Opportunities, and Challenges. Front Cell Dev Biol. 2021 Sep 8;9:694363.