Gyrolab檢測方法在檢測人血清中的游離補體蛋白C5的應用

補體系統
補體是存在于人和動物血清與組織液中的一組激活后具有酶活性、可介導免疫應答和炎癥反應的球蛋白。補體系統是由30余種蛋白質組成的復雜的網絡,屬于人體先天免疫系統的一部分。正常情況下,補體系統激活后,介導一系列的細胞反應,如溶胞、調理吞噬、炎癥反應、清除免疫復合物等,協助人體免疫系統抵御病原入侵和感染。但是補體系統的不適當調節或激活則會對組織器官造成損傷,引發包括眼部疾病、自體免疫疾病、哮喘、癌癥、溶血性疾病等多種常見病和罕見病。
補體系統主要由固有成分、調節蛋白及受體組成。補體固有成分以非活性狀態廣泛存在于血液中,被激活時會按照一定順序,以級聯反應依次進行激活,并發揮一系列生物學效應。補體系統可通過經典途徑 (抗原-抗體復合物結合C1q啟動)、旁路途徑 (又稱替代途徑,由細菌、真菌或外源異物直接激活) 和凝集素途徑 (又稱MBL途徑,由甘露聚糖結合凝集素MBL識別并結合病原微生物表面的糖結構啟動) 三種途徑激活。三種途徑的激活起始物和前端反應各異,但相互聯系并在C3轉化酶處匯合,進入共同的末端通路,即生成C5轉化酶將C5裂解成C5a和C5b, C5b與C6、C7和C8結合,在目標細胞表面形成C5b-8復合物,之后與12~15個C9分子結合形成膜攻擊復合物 (MAC)。當足夠數量的MAC插入目標細胞膜時,形成親水性穿膜孔道介導目標細胞快速滲透性裂解。
補體成分C5和C5藥物
C5是補體激活的共同組分之一,它是一種190 kDa的糖基化的β球蛋白,在正常人血清中約為75 µg/ml (0.4 µM)。成熟的C5是一個由999個氨基酸的115kD α鏈與655個氨基酸的75kD β鏈二硫連接的異構體。C5由C5轉化酶裂解生成C5a (10.4 kD) 和C5b (179 kD),C5a是一種強效過敏毒素和趨化因子,C5b參與形成末端膜攻擊復合物。
由于補體系統失衡涉及多種疾病的發病機制,所以針對補體系統的藥物開發逐漸受到關注,其中靶向C5及其相關受體的藥物最多。Alexion Pharmaceuticals 專注于補體藥物研究和開發領域。2007年,Alexion公司的人源化抗人C5單克隆抗體Eculizumab (衣庫珠單抗,商品名Soliris®) 被批準用于治療陣發性睡眠性血紅蛋白尿癥 (PNH) 和非典型溶血性尿毒癥 (aHUS)。Eculizumab特異性地與人C5蛋白結合,阻斷強效促炎性蛋白C5a的生成,并進一步阻斷末端補體復合物的形成。Eculizumab治療可減少PNH患者的血管內溶血,并降低aHUS患者的補體水平。2018年,Alexion又上市了長效C5補體抑制劑Ravulizumab (商品名Ultomiris®),能有效降低游離的C5水平,并且只需每隔8周給藥一次,極大地改善了患者的生活。Alexion公司研究人員采用Gyrolab® 技術建立了定量分析人血清中游離補體成分C5的檢測方法,并申請了專利“A Method of Quantitating Unbound C5 In A Sample (WO 2018/075758 A1)”, 本文就這一檢測方法做相關介紹。
1. 傳統ELISA法檢測游離C5的缺陷
在接受Eculizumab治療的患者血清中存在與藥物結合的C5 (Eculizumab-C5 復合物) 和未結合的游離C5,因此在以藥物作為捕獲試劑的ELISA檢測中,在樣品孵育時捕獲試劑可以與基質中的Eculizumab-C5 復合物建立動態平衡,根據Biacore結果,在基于多孔板的ELISA檢測中,大約15%的Eculizumab-C5復合物在60分鐘內解離 (ka~l.le6(1/Ms), kd=4.6e-5(1/s), 25°C),所以檢測可能高估基質中的游離C5水平從而導致潛在的不準確的建模、劑量選擇、申報數據和標簽聲明。在這種情況下,檢測中的樣品孵育時間、稀釋、溫度、樣品以及檢測方法的濃度范圍等都成為影響結果的關鍵因素。通常縮短孵育時間、減少稀釋、冰浴降溫等有助于減少藥物-C5復合物解離。
2. Gyrolab檢測游離C5
Gyrolab在微流控CD上進行小型化的免疫檢測,配體結合在親和柱上進行。試劑和樣品通過毛細作用加入到微流控通道中,然后在離心力作用下快速流穿親和柱,沒有孵育步驟且試劑和基質的接觸時間非常短,基質中與藥物結合的C5 很難發生解離并再次與被用作捕獲抗體的藥物結合。此外,Gyrolab檢測動態范圍很寬, 可以使用同一稀釋度對藥物治療前和治療后的患者樣品進行檢測。因為治療前的樣品中游離C5水平遠遠高于治療后的樣品,寬動態范圍足以覆蓋這兩種情況下的預期分析物濃度時,就不必針對每種情況下的樣品進行不同的稀釋,降低了樣品處理誤差。
Gyrolab檢測方法:
-
Gyrolab xPand/Gyrolab xPlore, Bioaffy 200 CD (200 nL)
-
捕獲抗體:生物素化Eculizumab或ALXN1210 (Alexion公司候選抗C5藥物),用PBST配制成100 µg/mL的工作濃度。
-
檢測抗體:Alexa Flour 647®標記的小鼠抗人C5抗體N19-8,用Rexxip F緩沖液 (Gyros) 配制成1 µg/mL的工作濃度。該抗體與捕獲抗體識別C5上的不同表位,因此不會與捕獲抗體競爭結合C5。
-
未知樣品:接受抗C5抗體藥物 (Eculizumab或ALXN1210) 治療前和治療后的患者血清樣本,均用Rexxip A 緩沖液 (Gyros) 以1:30稀釋,MRD 30。
-
標曲樣品:純化的重組人C5蛋白以300 µg/mL的濃度添加到去除C5的人血清基質中,然后3X梯度稀釋:300、100、33.3、11.1、3.70、1.23、0.41、0.14、0.045、0.015和0.005 µg/mL。0.005 µg/mL作為錨定點。然后用Rexxip A緩沖液以MRD30進行稀釋。
-
QC樣品:純化的重組人C5蛋白以240、10和0.045 µg/mL的濃度添加到去除C5的人血清基質中,然后用Rexxip A緩沖液以MRD30進行稀釋。ULOQ (300 µg/mL) 和LLOQ (0.015 µg/mL) 以同樣的方式配制。
-
洗滌緩沖液:Bioaffy Wash Buffer 1 (PBST), Bioaffy Wash buffer 2 (pH 11, Gyros)
3. Gyrolab檢測結果與性能
使用以上方法檢測人血清中游離C5的動態范圍為0.015-300 µg/mL,這一動態范圍和樣品稀釋度 (1:30) 覆蓋了預期的樣品濃度,無論是患者接受藥物治療前血清中可能高達200 µg/mL的游離C5水平,還是治療后血清中低于0.5 µg/mL的水平。使用ALXN1210作為捕獲試劑的檢測性能見表1:
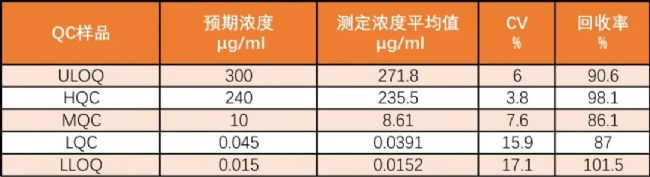
表1:QC樣品的檢測性能 (2天,4次獨立運行)
選擇性是靶點生物標志物檢測一個重要的參數。在10個供體血清樣品中添加50 µg/mL的純化人C5標準樣品,因為血清樣品中已經存在內源性的C5,故可考察檢測方法的選擇性。表2為Gyrolab對10個加標血清樣品的檢測結果,顯示Gyrolab檢測法準確地測量了添加到含有內源性對應物的樣品中的純化C5標準物質。
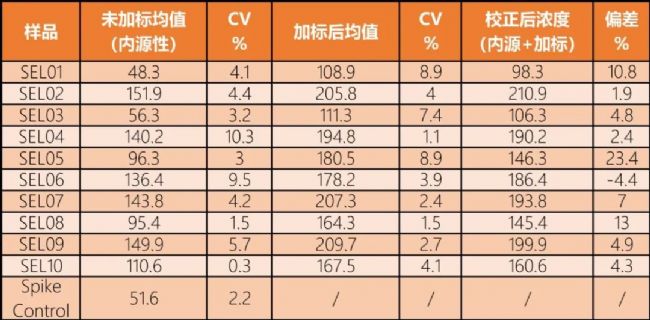
表2. Gyrolab選擇性 (10個供體樣本,ALXN1210作為捕獲試劑)
4. Gyrolab檢測 vs ELISA檢測
在人血清樣品中添加不同濃度的Eculizumab和ALXN1210藥物,兩組加標樣品均用ELISA法和Gyrolab法同時檢測,表3和表4分別為ELISA和Gyrolab檢測的結果。在每組添加藥物的樣品中,Gyrolab的檢測結果都較低,表明幾乎沒有結合型的C5從血清中的藥物中被拉出來(being pulled)并與捕獲試劑結合, 而在ELISA檢測中,由于發生了結合型C5解離的現象,導致檢測結果高估了游離C5水平。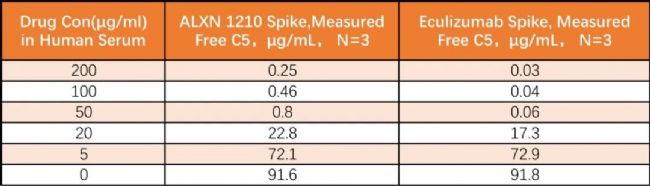
表3 . ALXN1210和Eculizumab加標血清樣品中游離C5的ELISA檢測結果
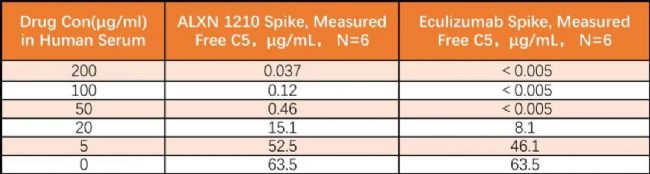
表4. ALXN1210和Eculizumab加標血清樣品中游離C5的Gyrolab檢測結果
5. Gyrolab檢測 vs ECL檢測
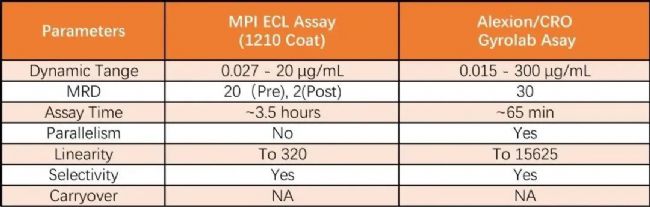
研究人員還建立了電化學發光免疫分析ECL (MSD) 檢測人血清中游離C5的方法,該方法動態范圍為0.0274 - 20.0 µg/mL,治療前血清樣品MRD為20,治療后血清樣品MRD為2,下表為MSD與Gyrolab兩種檢測方法的比較:
總結
Alexion 公司研究人員為補體藥物開發建立了Gyrolab檢測方法測定人血清中的游離補體C5蛋白。該方法檢測動態范圍為0.015-300 µg/mL,寬動態范圍允許對患者接受藥物治療前和治療后游離C5水平差異極大的血清樣品以相同的稀釋度 (MRD) 進行測量,避免了對不同批次樣品進行不同稀釋的要求并減小了因稀釋不同而造成的樣品處理誤差。Gyrolab檢測是在親和柱上以流穿模式 (Flow-through) 進行配體結合,試劑與樣品接觸時間短且沒有孵育步驟,大大降低了作為捕獲試劑的藥物與血清中已經與藥物結合的C5達到動態平衡的可能性,使得對血清中真正游離的C5蛋白的定量檢測更準確和可靠。Gyrolab檢測法使用的樣品量非常少,僅需4 µL,并且分析速度快,約1小時完成一張CD運行,產生112個數據點。數據表明該方法具有良好的選擇性和平行性。
參考文獻:
A Method of Quantitating Unbound C5 In A Sample (WO 2018/075758 A1)

關于Gyros Protein Technologies
Gyros Protein Technologies AB 由成立于2000年的Gyros AB和成立于1985年的Protein Technologies, Inc.合并而成,其別具一格的生物分析和多肽合成解決方案可以幫助科學家提高科研、藥物發現、臨床前和臨床研究以及生物工藝應用中的生物分子性能和生產力。在生物制藥行業,Gyros Protein Technologies公司的納升級自動化免疫分析工作站(Gyrolab® xPand和Gyrolab xPlore™)和多肽合成儀(PurePep® Chorus、Symphony® X和PurePep® Sonata®+)擁有大量且不斷增長的應用,加速了更安全、更有效的生物治療藥物、細胞基因療法和疫苗等的發現、開發和生產。Gyros Protein Technologies是Mesa Labs的一個部門。如需獲取詳細信息,敬請訪問https://www.gyrosproteintechnologies.com





