腫瘤微環境影響癌癥空間和細胞異質性研究進展
腫瘤微環境與微生物
無處不在的微生物也存在于腫瘤微環境中。2020 年 5 月,Ravid Straussman 團隊在 Science 上發表了一項大規模腫瘤微生物組的研究結果。他們采集了 1526 份不同癌癥類型患者樣品,發現每種腫瘤類型都有不同的微生物組組成,例如,厚壁菌門和擬桿菌門的細菌在結直腸腫瘤中數量最多,變形桿菌在胰腺癌的微生物組中占主導地位。他們還通過代謝組學預測了腫瘤微生物的功能與其腫瘤微環境之間存在聯系[1]。但這一研究并未證明腫瘤微生物是否在癌癥的發展中起因果作用。
今年 11 月,Susan Bullman 領導的研究小組在 Nature 上發表了一篇題為 Effect of the intratumoral microbiota on spatial and cellular heterogeneity in cancer 的研究性論文。他們采用空間轉錄組學來鑒定癌癥患者患者腫瘤內微生物群落及其原位位置,還開發了一種單細胞 RNA 測序方法,用于識別細胞相關細菌和它們相互作用的宿主細胞。該研究結果揭示了腫瘤微生物促進癌癥進展的作用[2]。
腫瘤微生物促進癌癥進展
■ 腫瘤內微生物群的異質性
研究者們首先對 11 例結直腸癌 (colorectal cancer, CRC) 患者的 44 塊腫瘤組織進行了 16S rRNA 基因測序,發現在個體患者腫瘤中瘤內微生物門屬水平上的種類有所不同,大部分患者 (n=7/11) 的瘤內微生物表現出不同程度的異質性,即一部分患者的瘤內微生物在組織中分布不均勻。
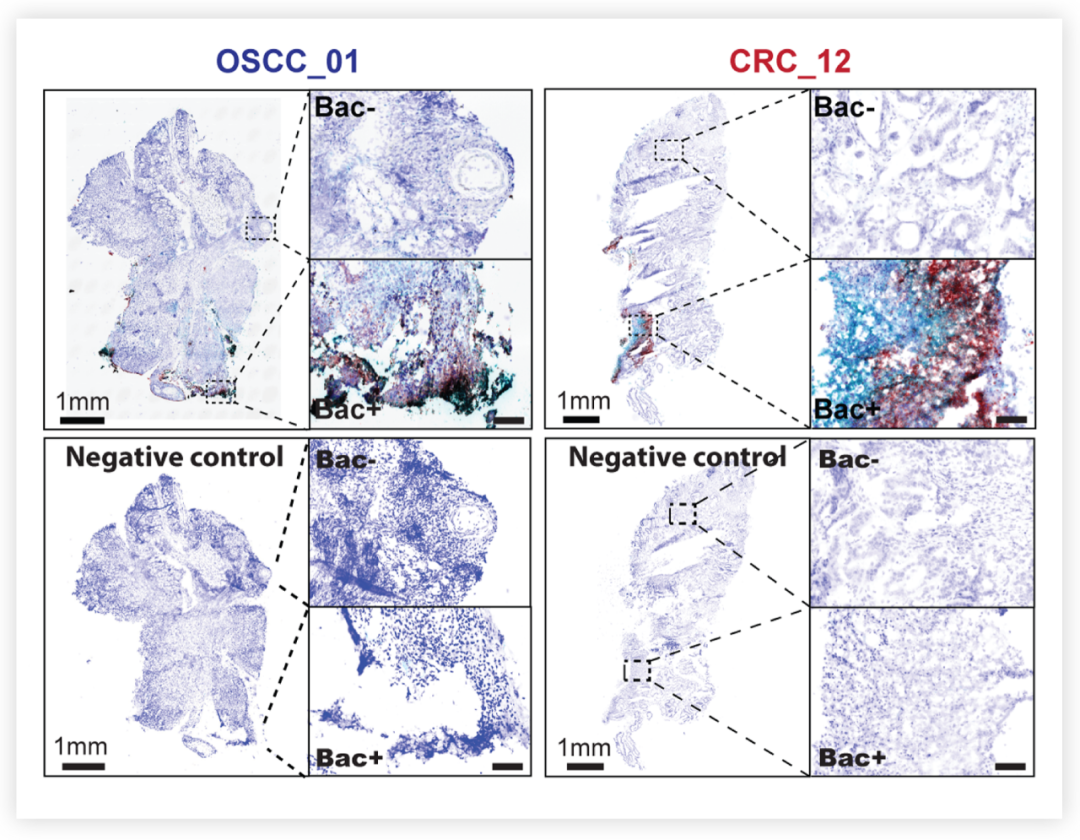 圖 1. 具核梭桿菌 (Fusobacterium nucleatum) 和其他細菌群落在口腔鱗狀細胞癌 (OSCC) (左) 和 CRC (右) 腫瘤組織中的空間分布[2]
圖 1. 具核梭桿菌 (Fusobacterium nucleatum) 和其他細菌群落在口腔鱗狀細胞癌 (OSCC) (左) 和 CRC (右) 腫瘤組織中的空間分布[2]
具核梭桿菌探針為紅色,真細菌探針為青色;Bac- 為細菌陰性區,Bac+ 為細菌陽性區
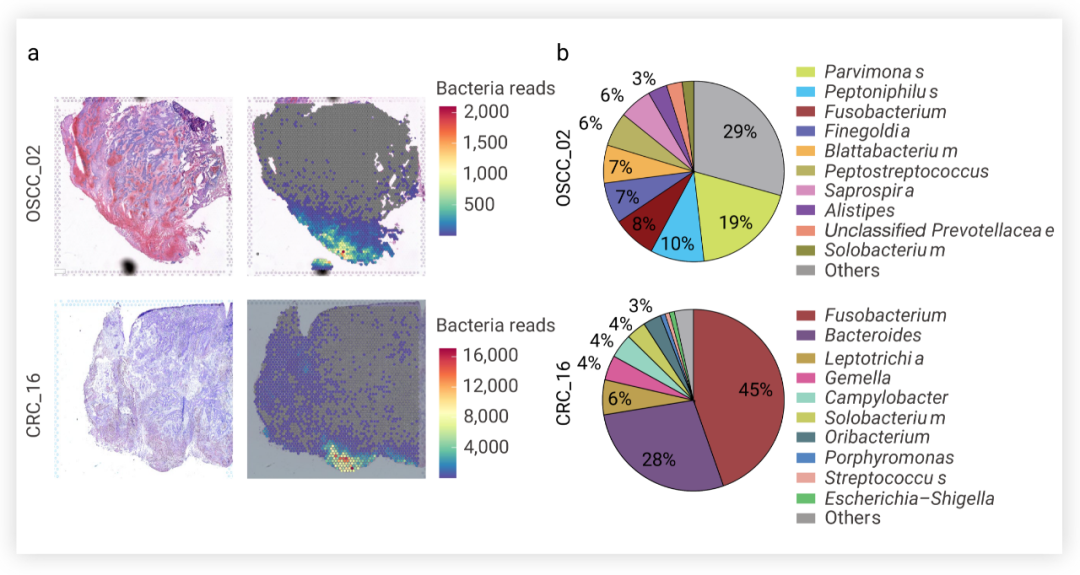
為了進一步研究瘤內微生物的分布空間和特性問題,研究者使用 10× Visium 空間轉錄組學對 CRC 樣本和口腔鱗狀細胞癌 (oral squamous cell carcinoma, OSCC) 樣本進行無偏分析,定位細菌轉錄本空間坐標以及量化細菌轉錄量。細菌分布及載量如圖 2a 所示,此外還發現,微單胞菌屬 (Parvimonas)、嗜胨菌屬 (Peptoniphilus) 和梭桿菌屬 (Fusobacterium) 是 OSCC 腫瘤樣本中最主要的屬,梭桿菌屬 (Fusobacterium) 和擬桿菌屬 (Bacteroides) 是 CRC 腫瘤樣本中最主要的屬。 a. OSCC 和 CRC 腫瘤樣本中細菌空間分布及轉錄量;b. OSCC 和 CRC 腫瘤樣本中不同菌屬占比■ 腫瘤內生態位被微生物定植
為了確定瘤內微生物在個體腫瘤中的異質分布是否與 TME 的功能有關,作者團隊通過 GeoMx 數字空間分析 (digital spatial profiling, DSP) 平臺,使用靶向方法,量化了與抗腫瘤免疫和癌癥進展相關的 77 種蛋白質的表達譜,對所感興趣的免疫區室或上皮癌區室中的蛋白進行分區分析 (細菌陰性區 Bac- 與細菌陽性區 Bac+)。
在 OSCC 和 CRC 腫瘤的 CD45+ 免疫區室中,細菌存在于高度免疫抑制的微生態位 (microniches),其特征是成熟 CD66b+ 骨髓細胞以及免疫抑制分子 ARG1 (精氨酸酶 1) 和免疫檢查點蛋白 CTLA4 (細胞毒性 T 淋巴細胞相關蛋白 4) 的上調。此外,在兩種癌癥類型中,ERK1 和 ERK2 磷酸化水平升高,這表明骨髓對腫瘤內細菌的反應可能是通過激活 MAPK 信號通路發生的。
在兩種癌癥類型的 PanCK+上皮腫瘤區室中,細菌定植區域 (Bac+) 的血管化程度低于細菌陰性區域 (Bac-),平滑肌肌動蛋白 (SMA) 表達減少,增殖水平降低 (圖 3) (在連續的組織切片中,使用抗泛細胞角蛋白 (PanCK) 和CD45免疫熒光可標記上皮癌細胞和免疫區室在腫瘤組織的分布)。在 OSCC 和 CRC 腫瘤組織的細菌定植微生態位中,腫瘤抑制因子 p53 野生型構型的蛋白質表達顯著降低,表明細菌定位與 TME 內高度轉化的癌細胞相關。細菌定植的微生態位顯著增加了 CRC 腫瘤中 JNK、ERK1 和 ERK2 以及 P38 的磷酸化水平,這一通路即為在細菌響應中被激活的信號通路。
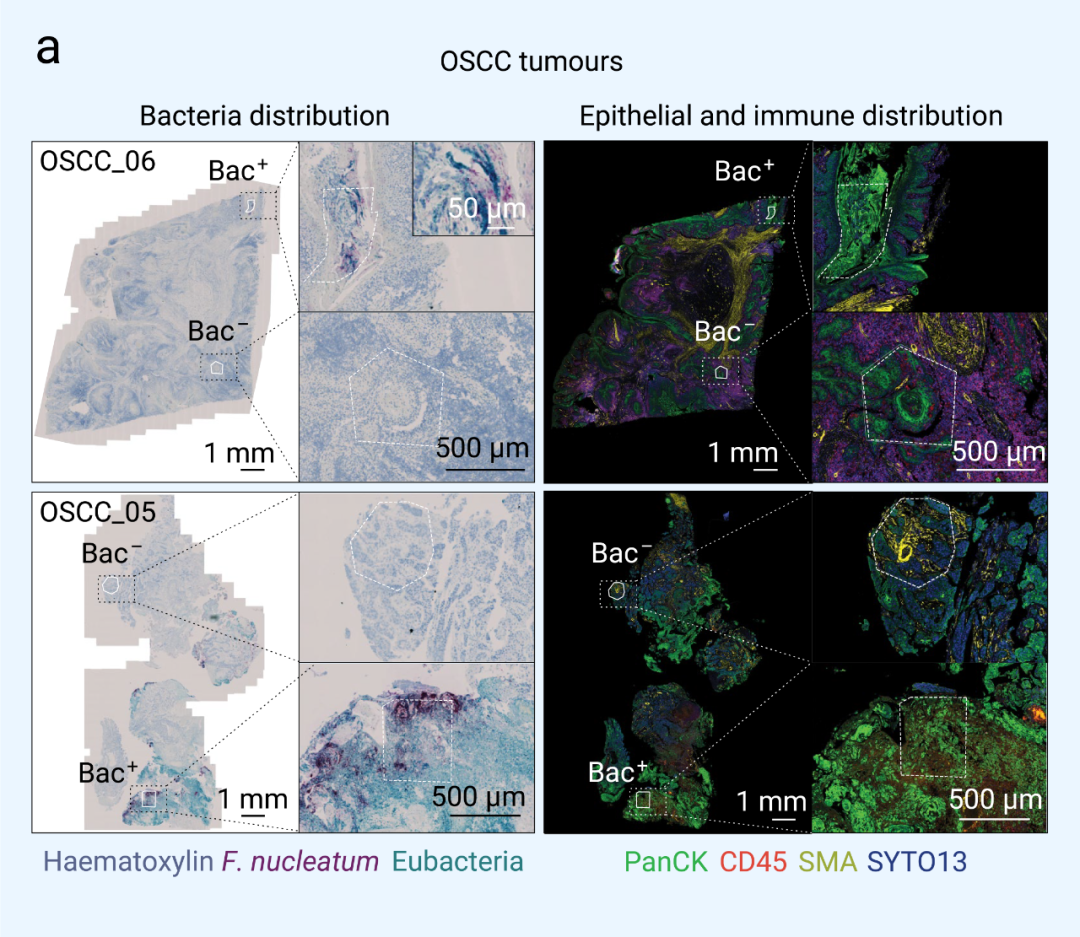
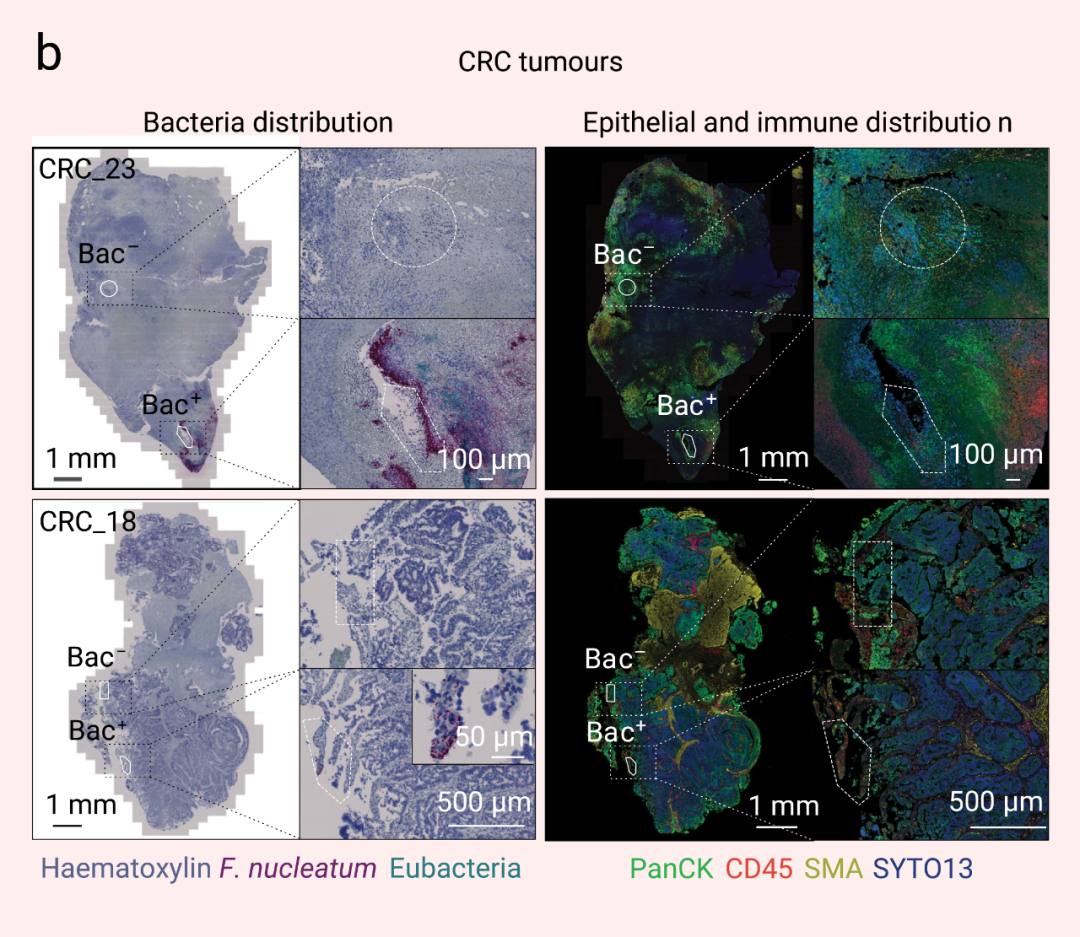
圖 3. 腫瘤相關微生物群對局部微生態位的影響[2]
RNascope-CISH 圖像顯示具核梭桿菌 (暗紅色) 和其他細菌群落 (青藍色) 在腫瘤組織中的分布,連續的免疫組織化學圖像顯示 CD45+ (紅色) 和 PanCK+ (綠色) 細胞的分布,以分別鑒定腫瘤組織中的免疫和上皮區室。■ 微生物驅動的單細胞異質性
為了研究 TME 中細菌-宿主細胞間的相互作用以及對宿主細胞轉錄組學的影響,作者團隊通過引入靶向細菌 16S rRNA 保守區域的引物開發了侵襲-黏附定向表達測序法 (invasion-adhesion-directed expression sequencing, INVADEseq)。他們利用該方法檢測了 7 位 OSCC 患者的新鮮腫瘤組織。共聚焦成像結果顯示,在組織分離成單個細胞后,這些患者腫瘤的單個細胞內含有細胞粘附細菌和細胞內細菌 (圖 4a)。這 7 份腫瘤樣本的整合 scRNA-seq 結果顯示,瘤內微生物區系以梭桿菌屬 (Fusobacterium) (占 34%) 和密螺旋體屬 (Treponema) (29.8%) 為主 (圖 4b)。
為了確定這兩種菌屬是否影響上皮細胞的信號通路,作者團隊將梭桿菌屬或密螺旋體屬陽性的單上皮細胞與上皮細胞簇中的細菌陰性細胞 (Total Bac-) 進行比較。GSEA分析結果顯示,IFN 和 JAK-STAT 信號顯著上調 (伴隨 SERPIN 家族分子表達增加),趨化因子 (如 CXCL10, CXCL11, CCL4 和 CCL3) 以及金屬蛋白酶 (MMP9 和 MMP3) 也顯著上調 (圖 4d-e)。另外還比較了泛細菌陽性 (Total Bac+) 與細菌陰性 (Total Bac-) 細胞之間的差異,結果顯示,與感染特定菌屬的細胞相比,泛細菌陽性上皮細胞中與癌癥進展相關的基因表達和細胞信號通路僅受到很小程度影響。
這些結果表明,瘤內微生物可以在免疫和上皮細胞群的單細胞水平上驅動患者腫瘤的異質性。
a. OSCC 患者腫瘤內細菌的分布;b. 使用 INVADEseq 方法整合 7 例 OSCC 患者的腫瘤 scRNA-seq 數據后,在屬水平上的微生物組組成。c-d. 梭桿菌屬 (Fuso) (上) 和密螺旋體屬 (Trep) (下) 陽性單上皮細胞與陰性細胞 (Total Bac-) 的 GSEA 分析結果顯示,兩種細胞之間信號通路與基因表達有顯著差異 (NES:normalized enrichment scores 歸一化富集分數)
■ 瘤內微生物誘導癌細胞遷移
作者團隊還探究了腫瘤內微生物群的主要菌屬與免疫或上皮癌細胞的直接相互作用。他們將 CRC 上皮球狀體與從 CRC 分離的具核梭桿菌共培養,然后包埋到含有均勻分布中性粒細胞的膠原蛋白基質中 (圖 5a)。通過活細胞共聚焦顯微鏡發現,在沒有具核梭桿菌的情況下,中性粒細胞在上皮球狀體內自由遷移 (平均速度為 4.329 µm·min-1 ± 0.08766 (s.e.m.),平均細胞位移為 57.21 µm)。在有具核梭桿菌的情況下,中性粒細胞通過降低其遷移能力來應對細菌感染 (平均速度為 3.593 µm·min-1 ± 0.08561 (s.e.m.),平均細胞位移為 34.53 µm)。中性粒細胞簇的形成伴隨著 ERK 和p38 MAPK 磷酸化水平的顯著增加。其部分原因是髓系對瘤內細菌的反應。
另外,作者團隊還發現,感染具核梭桿菌的 CRC 上皮細胞從球狀體脫離,并作為單個上皮細胞遷移到周圍的膠原蛋白基質中 (圖 5b)。進入基質的被感染癌細胞以平均速度為 19.99 µm·h-1 ± 0.827 (s.e.m.) 的速率遷移。
這些結果表明,入侵癌細胞的細菌不僅促進了癌細胞在膠原基質中的擴散,而且還改變了受感染癌細胞的運動模式,從而在功能水平上促進了細胞的異質性。
a. 活細胞共聚焦成像顯示,在沒有 (左) 或有 (右) 具核梭桿菌的情況下,與 CRC 球體相關的中性粒細胞運動狀態;b. 共聚焦顯微鏡觀察在沒有 (左) 和有具核梭桿菌 (右) 的情況下 HCT116 細胞球體入侵膠原基質的狀態。
總結
參考文獻
1. Nejman D, Straussman R, et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980.
2. Galeano Niño JL, Bullman S, et al. Effect of the intratumoral microbiota on spatial and cellular heterogeneity in cancer. Nature. 2022 Nov;611(7937):810-817.