敲除 RASA2助力提高過繼性 T 細胞持抗原敏感性和持久性
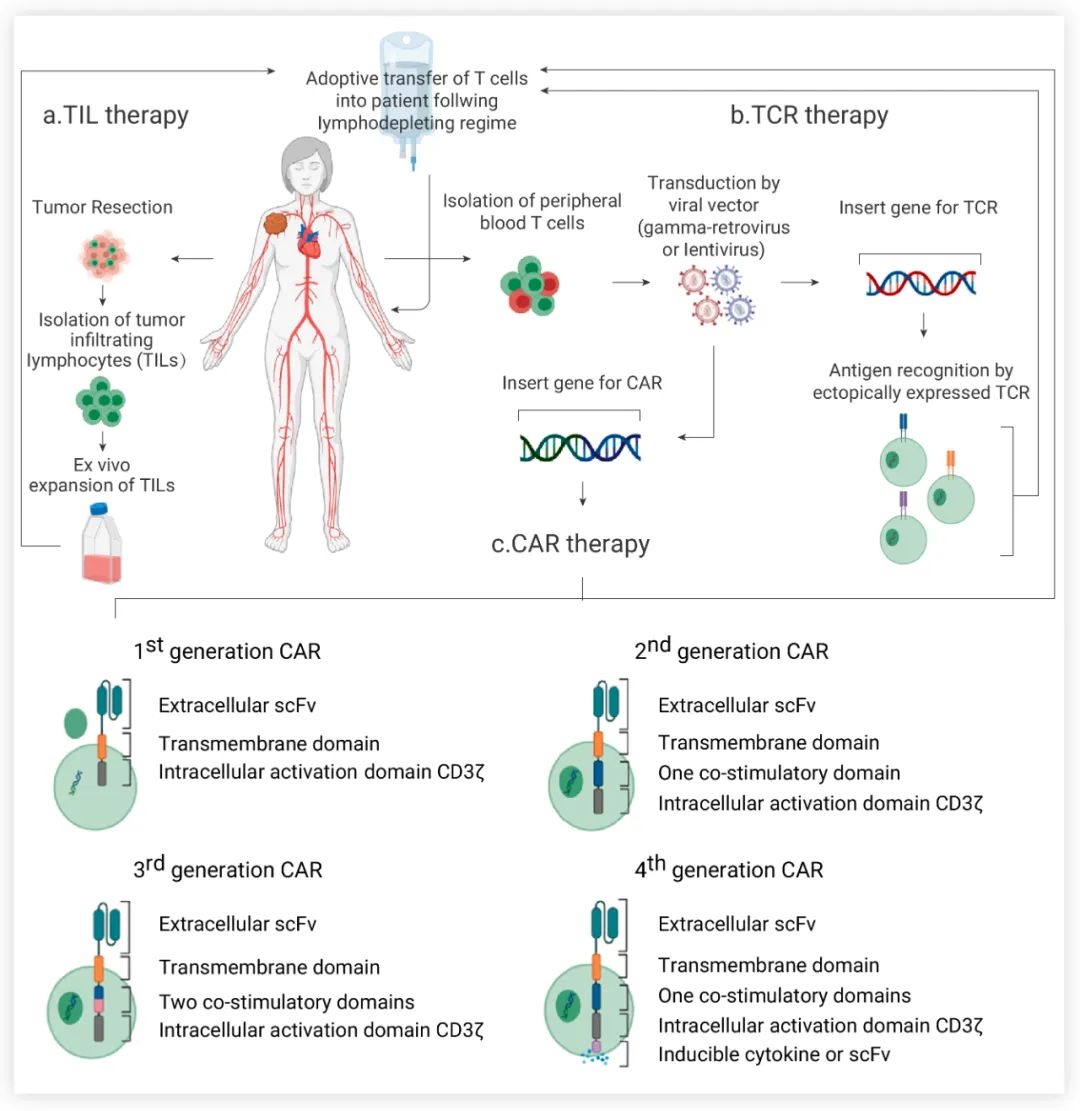
圖 1. 過繼性 T 細胞療法[1]
a. TIL 療法:切除腫瘤后,分離腫瘤反應性 T 細胞進行體外培養;b-c.TCR-T 與 CAR-T療法:通過病毒載體對外周血 T 細胞進行基因修飾以表達特定的 TCR 或 CAR。在過繼轉移 TILs、TCR-T 或 CAR-T 細胞之前,患者先進行淋巴細胞衰竭預治療,以創造過繼細胞可生存的空間和內穩態環境。
目前,臨床試驗使用經過改造的 CAR 和 TCR 在復發或難治性血液系統惡性腫瘤患者中已產生了不錯的治療效果[2],但過繼 T 細胞療法依然有很大的改善空間。研究表明,過繼 T 細胞治療癌癥的療效可能受到來自外部因素和內在抑制檢查點的抑制信號的限制[3],而靶向基因編輯有可能克服這些限制并增強 T 細胞治療功能。
今年 8 月 Nature 發表了一篇題為 RASA2 ablation in T cells boosts antigen sensitivity and long-term function 的文章——該研究證明了敲除 T 細胞中的 RASA2 可以提高其抗原敏感性和持久性[4]。RASA2 是一種 RAS GTPase 激活蛋白 (RasGAP),是人類T細胞中的信號檢查點,這項研究的發現意味著 RASA2 作為一個有希望的靶標基因將為 T 細胞治療血液病和實體瘤適應癥提供新的策略。下面我們就來看一下研究人員是如何開展這項研究的。
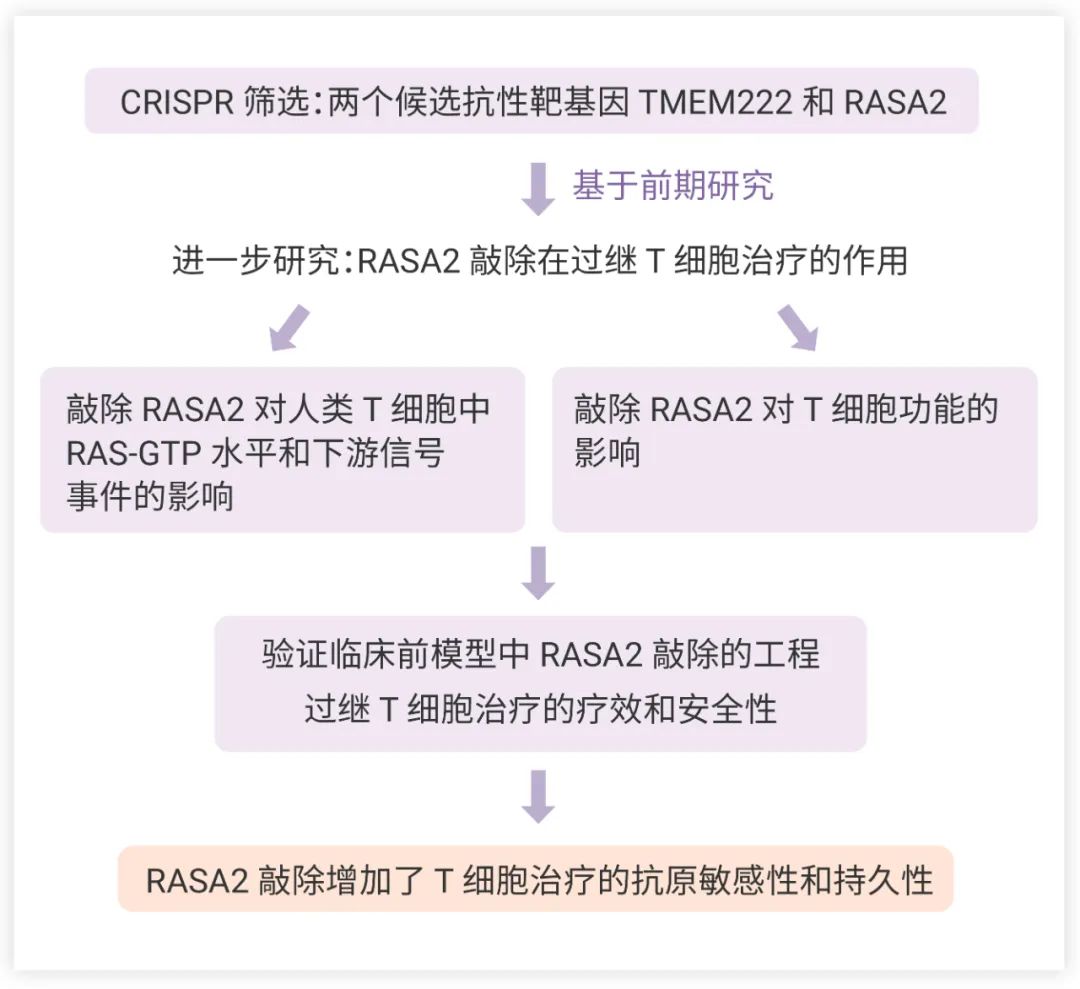 圖 2. RASA2 ablation in T cells boosts antigen sensitivity and long-term function 文章思維導圖
圖 2. RASA2 ablation in T cells boosts antigen sensitivity and long-term function 文章思維導圖
抑制性腫瘤微環境和 T 細胞內在檢查點都會影響靶向實體瘤的工程 T 細胞的功效。為了識別 T 細胞中對內在和外在抑制條件具有抗性的調節因子,研究人員利用全基因組 CRISPR 敲除來篩選原代人 T 細胞 (圖 3a)。他們使用來自多個獨立供體的 T 細胞和在多種抑制條件下進行了分析,并在每一種分析條件下都用流式細胞技術分選鑒定了促進 T 細胞增殖的基因靶點。最后在高度分裂的 T 細胞中成功篩選出兩個候選抗性靶基因:TMEM222 和 RASA2 (圖 3b)。基于該團隊前期的研究[5],研究人員選擇進一步對 RASA2 敲除 (RASA2 Knock-out, RASA2-KO) 在過繼 T 細胞治療的作用進行了研究。
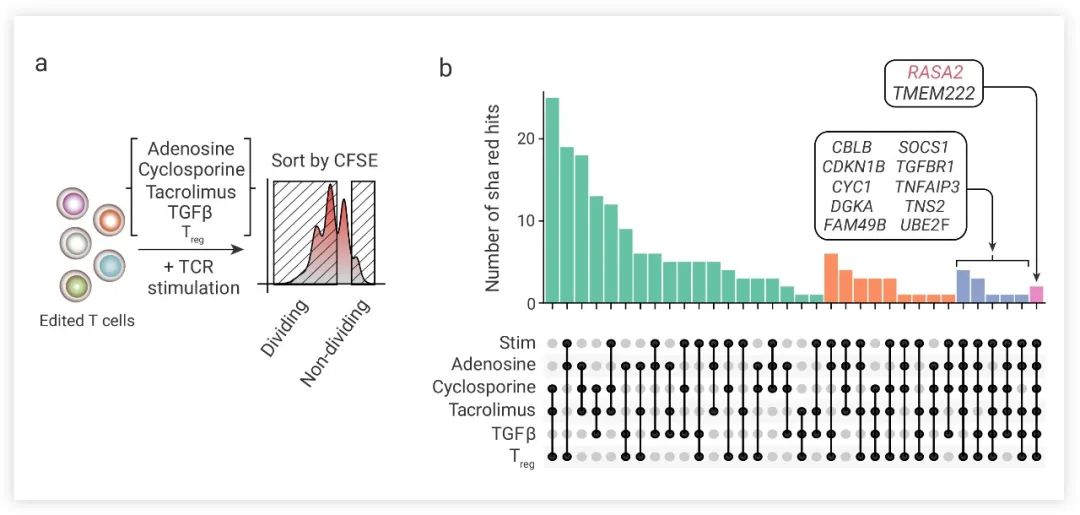
圖 3. CRISPR 篩選確定 RASA2 為免疫抑制抵抗的調節劑[4]
a. 人類 T 細胞中抗藥基因靶點的全基因組篩選示意圖;b. 與非分裂細胞相比,高分裂細胞在所有篩選中共有的基因命中分析集中在兩個候選抗性目標基因,TMEM222 和 RASA2
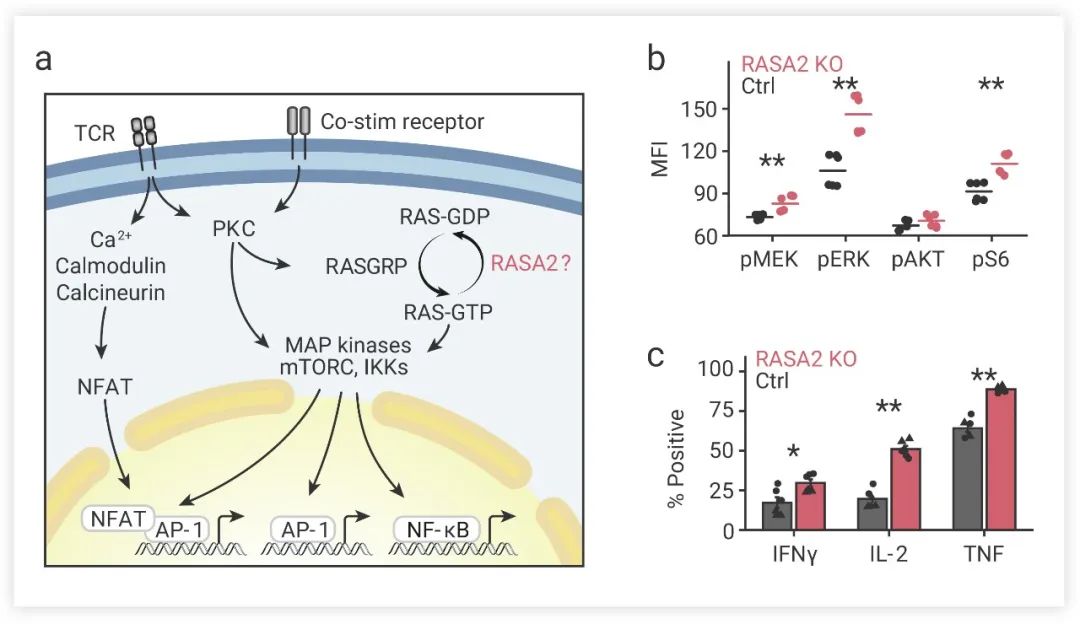
圖 4. RASA2 敲除可以促進 T 細胞活化、提高抗原敏感性[4]
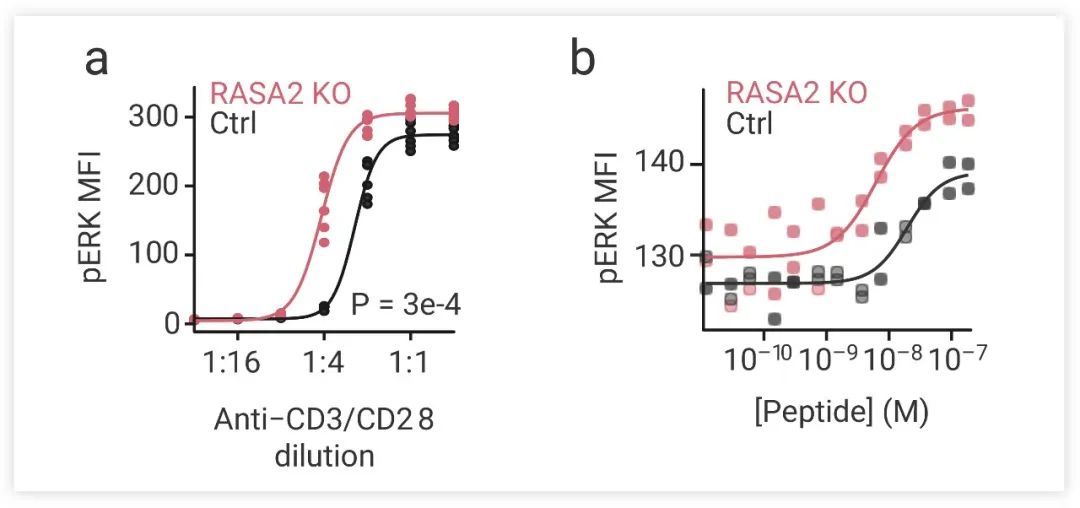
圖 5. RASA2 敲除 (RASA2-KO) T 細胞的 ERK 磷酸化水平隨抗 CD3/CD28 抗體濃度 (a) 和 NY-ESO-1 多肽濃度 (b) 增加,且比對照細胞水平更高 (MFI: mean fluorescent intensity,平均熒光強度)[4]
■ 增強 T 細胞對癌細胞的殺傷力
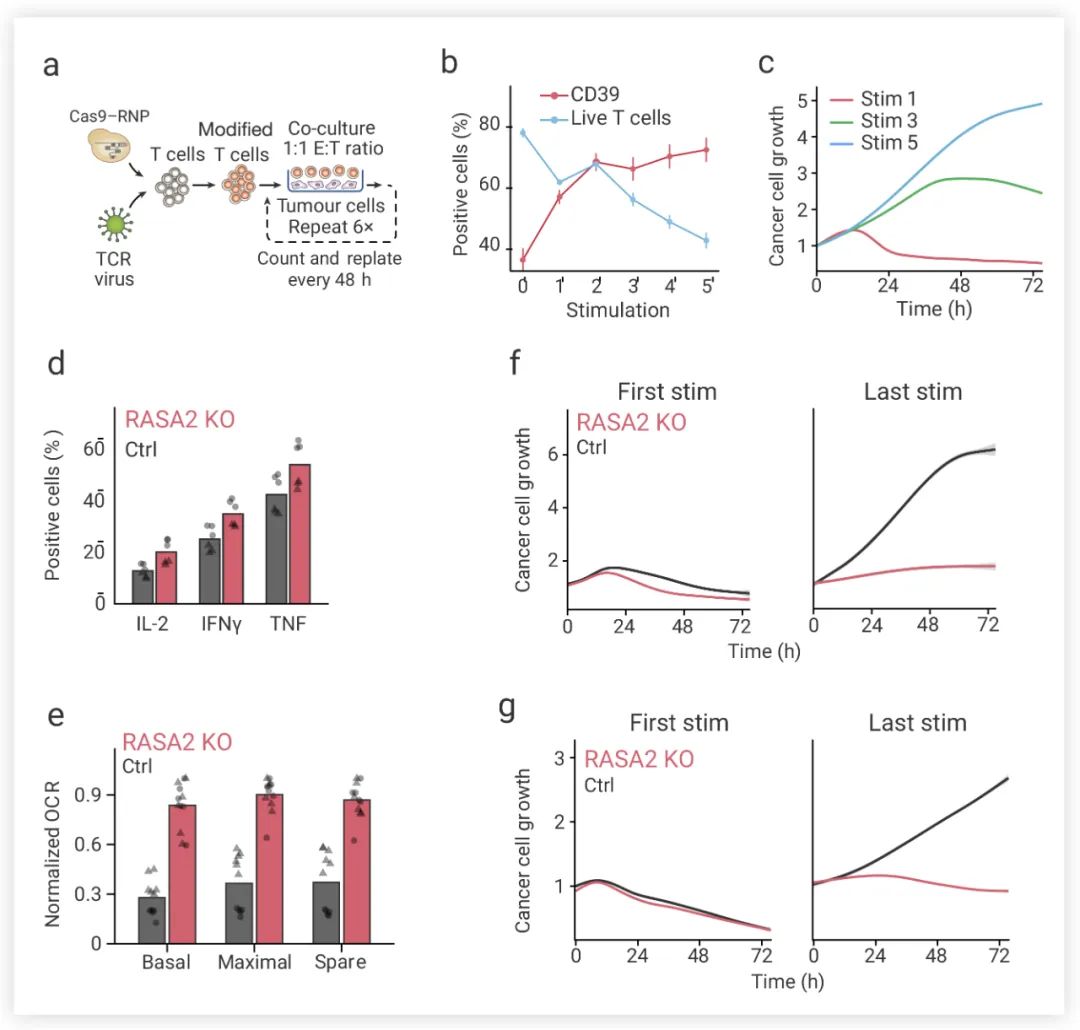
為了測試 RASA2 的敲除是否會改善慢性抗原暴露誘導的 T 細胞功能障礙,研究者們建立了一種重復刺激試驗——將抗原特異性 T 細胞與新鮮靶腫瘤細胞以 1:1 的效靶比 (E:T) 進行共培養,每 48 小時重復一次 (圖 6a)。在重復刺激下,抗原特異性 T 細胞相對富集 (CD39 比例逐漸升高),T 細胞活力和活化水平下降 (圖 6b),代謝譜的改變以及關鍵細胞表型標記物的漸進性變化,與功能失調的T細胞狀態一致。T 細胞暴露次數越多,控制癌細胞擴張的能力越弱 (圖 6c)。 而 RASA2 敲除能夠緩解 T 細胞的活力下降。與對照組 T 細胞相比,重復刺激后 RASA2 敲除 T 細胞會表現出更高水平磷酸化 MAPK 信號、激活和多重效應細胞因子 (圖 6d);實時細胞代謝分析顯示,重復刺激后,與對照組T細胞相比,RASA2 敲除 T 細胞的基礎耗氧率 (OCR) 高于對照組 T 細胞的基礎耗氧率 (圖 6e)。接下來研究人員測試反復接觸腫瘤抗原是否會影響 RASA2 敲除 T 細胞的癌細胞殺傷能力。結果表明,與對照組 T 細胞相比, RASA2 敲除的 T 細胞在多次刺激后對癌細胞殺傷作用的優勢更為顯著,RASA2 的敲除可使 TCR-T 細胞和 CAR-T 細胞對這種功能失調狀態產生抵抗力 (圖 6f-g)。
圖 6. 通過反復接觸癌細胞,RASA2 敲除可以改善功能性 T 細胞的持久性[4]
a. T 細胞重復刺激實驗示意圖;b. 隨刺激次數增加,T 細胞活力下降;c. 在第 1、3、5 次對 T 細胞刺激后,癌細胞生長隨時間逐漸失控;d. RASA2-KO T 細胞的細胞因子 IL-2、IFNγ、TNF 水平升高;e. RASA2-KO T 細胞的 OCR 高于對照組T細胞的基礎耗氧率;f-g. 在第一次和最后一次次刺激 RASA-KO T 細胞仍能有效抑制癌細胞生長,對照細胞在最后一次刺激時無法控制癌細胞
■ 改善 T 細胞在動物模型的抗腫瘤效力
最后,研究人員在多個臨床前模型中測試了 RASA2 的敲除是否會改善過繼性T細胞治療的性能。通過 TCR-T 細胞治療的黑色素細胞瘤 A375 模型、TCR-T 細胞治療的白血病 Nalm6 模型、CAR-T 細胞治療的 Nalm6 模型以及 CAR-T 細胞治療的腹膜內局部骨肉瘤 LM7 模型,證明了 RASA2 敲除可以提高腫瘤小鼠的存活率、延長腫瘤小鼠的存活時間。以上結果說明 RASA2 敲除可以改善 TCR-T 和 CAR-T 細胞對抗一系列液體和固體腫瘤的臨床前模型的性能,突出了其在多種免疫治療適應癥方面的潛力。研究人員也評估了過繼 T 細胞轉移對小鼠健康的影響,與對照組相比,RASA2 敲除的T細胞小鼠的體重和組織病理并沒有發生改變。敲除 CAR-T 細胞中的 RASA2 可以提高抗腫瘤療效 (圖7) 和生存率,且沒有明顯增加安全風險。
圖 7. RASA2-KO 的 CAR-T 細胞比對照 T 細胞的在第 56 天抑瘤效果比較 (藍圈中為腫瘤)[4]
|
相關產品 |
|
是一種超級激動劑抗 CD28 單克隆抗體,可直接刺激 T 細胞。 |
| Binetrakin是一種 T 淋巴細胞衍生的多效性細胞因子,可影響多種細胞類型,包括 B 細胞和 T 細胞。 |
|
可抑制 T 淋巴細胞信號轉導和 IL-2 轉錄。具有強免疫抑制特性。 |
|
是一種免疫抑制劑,可抑制抗 CD3 /抗 CD28 單抗和脂多糖激活的小鼠脾細胞增殖。 |
|
是一種 T 細胞特異性表面糖蛋白 CD28 (TP44) 拮抗劑,通過靶向和減弱關鍵的 CD28/B7-2 共刺激通路來調節炎癥反應。 |
|
Tyrosinase (192-200), human mouse 是一種多肽,可被 HLA-B44 分子上的細胞溶解 T 細胞 (CTL) 識別。可用于黑色素瘤相關癌癥的研究。 |
參考文獻
2. Fesnak AD, June CH, Levine BL. Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer. 2016;16(9):566-581.
3. Anderson KG, et al. Obstacles Posed by the Tumor Microenvironment to T cell Activity: A Case for Synergistic Therapies. Cancer Cell. 2017 Mar 13;31(3):311-325.
4. Carnevale J, Shifrut E, et al. RASA2 ablation in T cells boosts antigen sensitivity and long-term function. Nature. 2022 Sep;609(7925):174-182.
5. Shifrut E, et al. Genome-wide CRISPR Screens in Primary Human T Cells Reveal Key Regulators of Immune Function. Cell. 2018 Dec 13;175(7):1958-1971.e15.