項目文章: 單細胞測序揭示共刺激分子CD226對胸腺T細胞發育的影響
2022年11月,第四軍醫大學聯合西北工業大學在學術期刊IMMUNOLOGY上發表題為“CD226 knockout reduces the development of CD8+ T by impairing the TCR sensitivity of double-positive thymocytes”的研究成果。本研究通過對野生型(WT)和CD226基因敲除小鼠(KO)的胸腺細胞進行單細胞測序,探索了共刺激分子CD226對于T細胞發育的重要作用。實驗發現,CD226KO小鼠胸腺中CD8+ T細胞顯著減少,DPT-Q細胞顯著增加,并且削弱了TCR信號通路中AKT的磷酸化水平,促進DPT細胞凋亡,表明CD226對胸腺細胞發育有重要影響。新格元在該研究中承擔了單細胞轉錄組測序以及單細胞數據生信分析等工作。
研究背景
T淋巴細胞在胸腺發育成熟,其經歷的陽性選擇是表達不同TCRs的未成熟雙陽性(DP) T細胞成熟為MHC限制性單陽性(SP) T細胞的關鍵步驟。CD226是一種I型跨膜活化性受體,以往對CD226功能的研究主要集中在外周組織中調節免疫的作用。CD226信號通路促進CD8+ T細胞活化,增強細胞毒性,它對抗腫瘤免疫至關重要,但在胸腺細胞發育過程中其特征尚不明確。
DPT:共表達CD4/CD8,雙陽性T細胞(DPT);
DPT-Q:DPT at the quiescent phase靜止期的DPT細胞;
DPT-P:DPT at proliferating phase增殖期的DPT細胞;
DNT:雙陰性T細胞。
研究結果
1.scRNA-seq揭示了CD226在胸腺T細胞發育中的意義
為了確定CD226分子在胸腺T細胞發育中的作用,研究者使用Singleron GEXSCOPE平臺對5周齡CD226 KO小鼠和對照的野生型(WT)小鼠的胸腺細胞進行了scRNA-seq(圖1a)。通過質量控制并分別獲得了26962個(WT)和26283個(KO)胸腺細胞;利用UMAP對細胞群進行識別和可視化,大多數胸腺細胞被鑒定為T細胞(圖1b)。然后將T細胞進一步細分聚類為7個亞群,然后使用之前報道的marker進行了注釋(圖1c),并對T細胞每個cluster的前10個特征基因進行了展示。擬時序分析顯示,WT和CD226KO小鼠的胸腺細胞發育軌跡如下:DNT、DPT-P、DPT-Q、CD4+/CD8+ SP T細胞(CD4/CD8 T)(圖1c,e),這與前人的報道一致。
圖1 scRNA-seq揭示了CD226在胸腺T細胞發育中的重要性
CD226 KO組胸腺細胞各亞群的分布和比例發生了顯著變化(圖2a)。與WT小鼠相比,CD226KO小鼠的CD8+ SP胸腺細胞比例顯著降低,DPT-Q細胞比例顯著增加(圖2a,b)。然后,研究者又通過流式細胞術分析證實,CD226敲除降低了胸腺中CD8 T細胞的比例,增加了DPT細胞的比例(圖2c)。通過對DPT-Q、CD4+ T和CD8+ T細胞進行Monocle 2擬時序表明,CD226敲除一定程度上阻止DPT-Q分化為CD8+ T細胞(圖2d,e)。提示CD226在胸腺T細胞的發育過程中起重要作用,尤其是在DPT-Q向CD8+ T細胞的轉化過程中。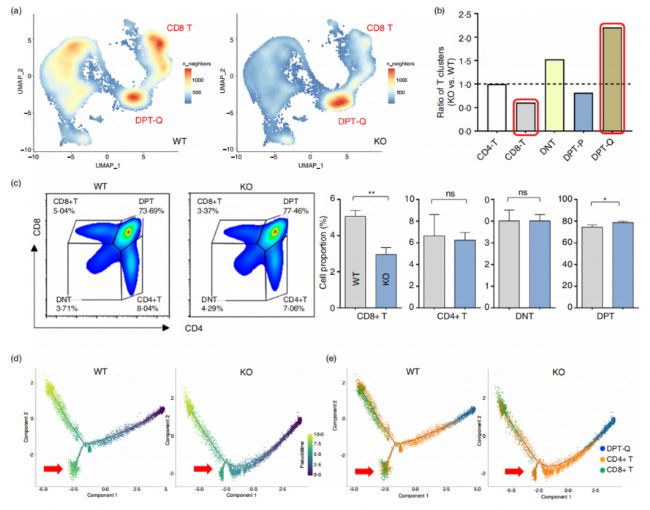
圖2 CD226敲除破壞胸腺T細胞發育
2.CD226在DPT期開始高表達
基于CD226在胸腺T細胞發育中的重要作用,研究者檢測了WT小鼠中不同發育階段的T細胞中CD226的表達情況。首先是通過jitter圖顯示了在T細胞分化的假時間過程中CD226的表達(圖3a),發現:CD226不表達于DNT期之前的各階段胸腺細胞,在DPT-Q期開始表達,在CD4+、CD8+和NKT細胞等終末分化T細胞中表達最高。接著,采用流式細胞術檢測WT小鼠胸腺中CD226蛋白的表達水平,發現:CD226水平按照DNT、DPT、CD4+ T和CD8+ T細胞的順序逐漸升高,其中CD226在DNT中表達最低,但在DPT期顯著升高(圖3b,c)。這表明CD226在DPT細胞中起重要作用。此外,CD8+ T細胞中CD226的表達顯著高于其他亞群,這可能是CD226敲除主要影響了CD8+ T細胞發育和功能的原因之一。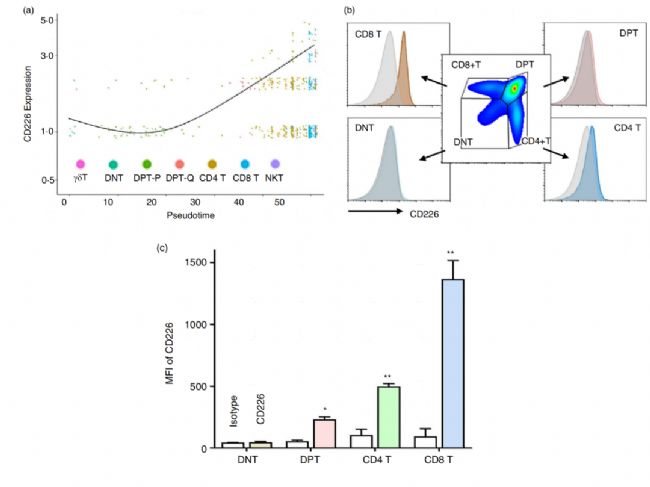
圖3 CD226在DPT期開始高表達
CD226敲除抑制DPT-Q向CD8+ T細胞的發育,DPT-Q是T細胞向SP細胞發育的關鍵階段。接下來,文章作者進一步對DPT-Q細胞展開研究。首先將DPT-Q細胞進行進一步分群,分為5個亞群,使用UMAP進行數據分析和可視化(圖4a)。通過UMAP圖可以看出,CD226敲除導致DPT-Q中缺少簇2、3和5(圖4c)。同時作者也對這些亞群的特征基因以熱圖的形式進行了展示。簇2可以由Granzyme A (Gzma)注釋(圖4e),而Granzyme A是一種選擇性地表達于CTL和NK細胞的絲氨酸蛋白酶,誘導腫瘤細胞和病毒感染細胞死亡,表明Gzma+ Cluster 2可能進一步發展為CD8+ T細胞。這些結果表明,CD226敲除抑制DPT-Q的發育,Gzma+亞群的缺失可能是CD8+ T發育障礙的潛在原因。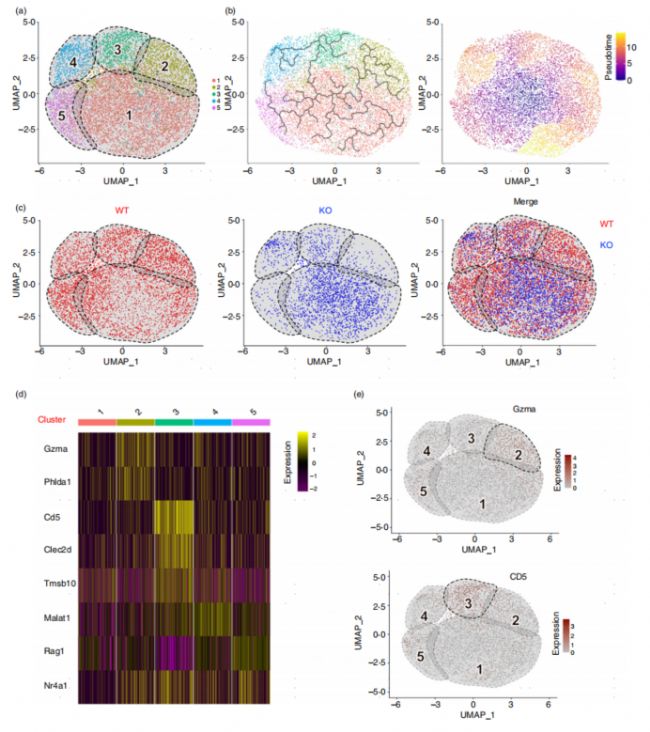
圖4 CD226敲除阻礙DPT-Q向CD8+ T細胞的發育
3.CD226的缺失通過減弱TCR信號強度阻礙了T細胞的陽性選擇
DPT-Q期的陽性選擇對T細胞向SP(單陽性)細胞的發育至關重要,DPT細胞只有接收到合適強度的TCR信號,才能通過陽性選擇,繼續存活和成熟。CD5的水平在陽性選擇過程中受到嚴格的調控,并且CD5的表達反映了TCR轉導信號的強度,CD5+ Cluster 3被鑒定為正在發生陽性選擇的DPT細胞。接下來,文章作者對CD5+ Cluster 3細胞展開了研究,jitter圖顯示CD5表達增加,之后隨擬時序順序降低,反映了DPT細胞經歷陽性選擇的動態過程(圖5a)。鑒于CD226敲除造成CD5+ Cluster 3細胞的顯著減少(圖4c),文章作者進一步研究了CD226是否影響DPT細胞的TCR信號強度。基于scRNA-seq的氣泡圖顯示,CD226 KO小鼠的DPT-Q和CD5+ DPT-Q細胞中TCR下游信號分子如Lck、Lat和Zap70的基因表達均下調(圖5b)。WT和CD226 KO 組DPT細胞之間差異基因的富集分析指向TCR下游的MAPK等相關信號通路(圖5c)。GO富集分析也顯示了TCR信號的一致結果,如分子功能中的轉錄因子和蛋白激酶結合,細胞成分中的細胞質,以及生物過程中的細胞分化(圖5d)。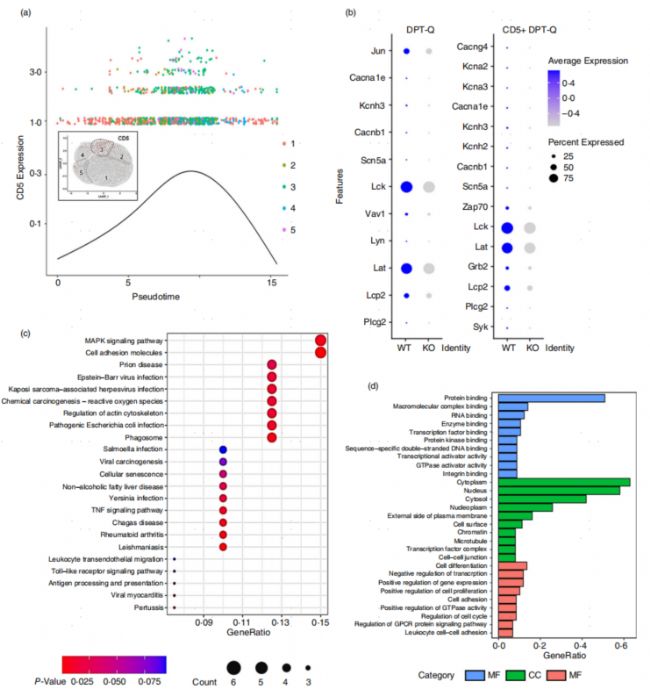
圖5 CD226基因敲除減弱了陽性選擇中的TCR信號強度
4.CD226通過調控AKT活性調控DPT細胞凋亡
細胞凋亡是胸腺細胞進行陽性選擇和決定成熟單陽性T細胞數量的最重要機制,研究者通過流式細胞術檢測了WT和CD226KO小鼠胸腺細胞凋亡水平。WT胸腺細胞和CD226KO胸腺細胞中CD4+和CD8+ SP細胞的百分比沒有顯著差異,而CD226缺陷的DPT細胞顯示出更高的凋亡水平(圖6a)。
AKT通路參與細胞存活/凋亡的調節,當TCR被激活時,其下游元件NF-κB、AKT和MAPK發生級聯磷酸化。然而,在CD226缺陷的DPT細胞中,AKT在Ser473位點的磷酸化、ERK在Thr202/ Tyr204位點的磷酸化、NF-κB在Ser536位點的磷酸化和P38在Thr180/Tyr182位點的磷酸化顯著降低(圖6b)。與WT DPT細胞相比,CD226缺陷的DPT細胞表現出更高的凋亡水平,AKT激活劑SC79顯著逆轉了這種凋亡水平(圖6c)。
同時,促凋亡相關蛋白Bax和cleaved-caspase 3在CD226缺陷的DPT細胞中表達上調。AKT抑制劑增強了DPT細胞中Bax和cleaved-caspase 3的表達,AKT激活劑顯著逆轉了CD226缺陷的DPT細胞中Bax和cleaved-caspase 3的上調(圖6d)。上述結果表明,CD226可以通過調節AKT活性來調控DPT細胞凋亡,TCR信號強度減弱是CD226 KO小鼠陽性選擇受損和胸腺細胞發育障礙的原因。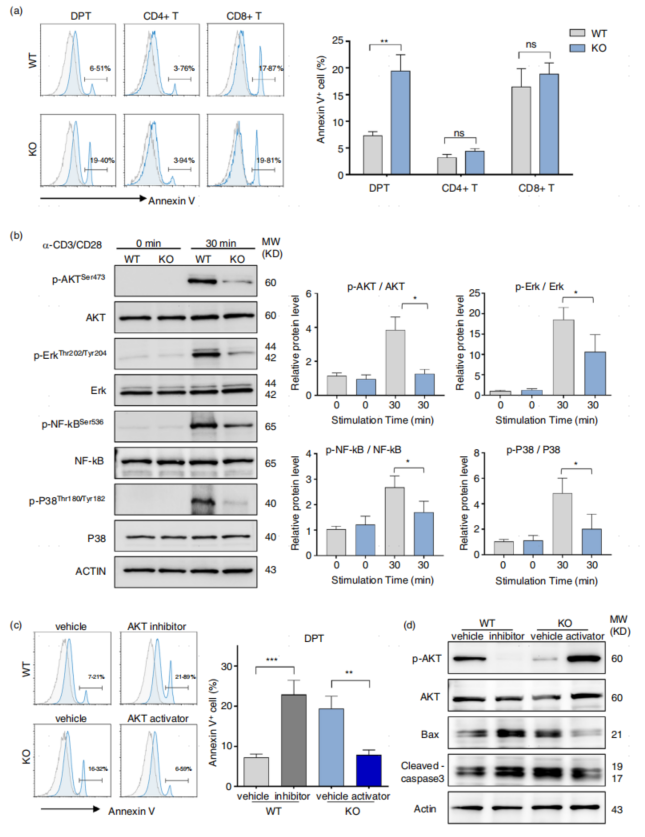
圖6 CD226敲除通過調控AKT磷酸化促進DPT細胞凋亡
結論
1、本研究對WT和CD226 KO小鼠胸腺細胞進行了單細胞測序,CD226KO小鼠胸腺中CD8+ T細胞顯著減少,DPT-Q細胞顯著增加,表明CD226對胸腺細胞發育有重要影響。
2、研究了CD226在胸腺細胞各發育階段的動態表達規律,發現其在DPT時期開始高表達。
3、DPT-Q細胞被細分為5個細胞亞群,包括CD5高表達的細胞群,而CD226 KO組胸腺中明顯缺乏CD5表達,而另一簇Gzma+ DPT-Q亞群在CD226 KO胸腺中同樣缺失,表明DPT-Q向CD8+ T細胞發育過程受損。
4、CD226 KO降低了多個TCR下游分子基因的表達,CD226缺陷導致多個TCR信號通路相關的差異基因富集,包括MAPK通路。
5、通過體外實驗發現CD226敲除增加了DPT細胞的凋亡水平,而AKT激活劑可以在很大程度上逆轉CD226缺失的DPT細胞的凋亡增加。
綜上所述,CD226在DPT細胞陽性選擇過程中協同pMHC-TCR相互作用,為DPT-Q細胞向SP階段的發育提供足夠強度的刺激信號,其分子機制與AKT通路抑制DPT細胞凋亡有關,參與胸腺細胞發育的調節。該發現為共刺激分子CD226在T細胞分化和成熟中的調節作用研究提供了新的實驗數據和思路。
參考文獻
Jingchang Ma ,Yitian Liu , Chujun Duan et al. CD226 knockout reduces the development of CD8+ T by impairing the TCR sensitivity of double-positive thymocytes. Immunology. 2022 Nov 24. doi: 10.1111/imm.13612.
研究背景
T淋巴細胞在胸腺發育成熟,其經歷的陽性選擇是表達不同TCRs的未成熟雙陽性(DP) T細胞成熟為MHC限制性單陽性(SP) T細胞的關鍵步驟。CD226是一種I型跨膜活化性受體,以往對CD226功能的研究主要集中在外周組織中調節免疫的作用。CD226信號通路促進CD8+ T細胞活化,增強細胞毒性,它對抗腫瘤免疫至關重要,但在胸腺細胞發育過程中其特征尚不明確。
DPT:共表達CD4/CD8,雙陽性T細胞(DPT);
DPT-Q:DPT at the quiescent phase靜止期的DPT細胞;
DPT-P:DPT at proliferating phase增殖期的DPT細胞;
DNT:雙陰性T細胞。
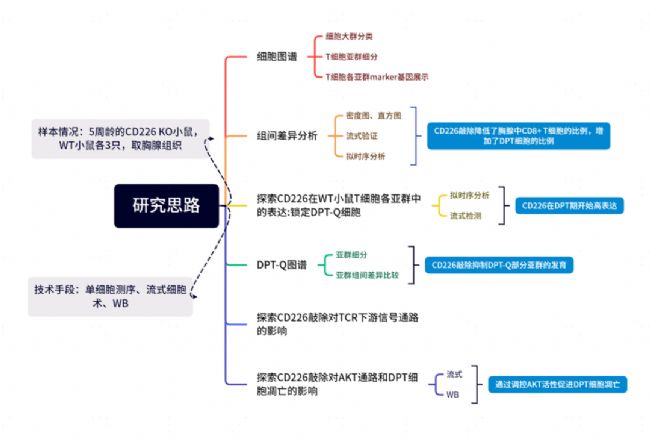
思維導圖

研究結果
1.scRNA-seq揭示了CD226在胸腺T細胞發育中的意義
為了確定CD226分子在胸腺T細胞發育中的作用,研究者使用Singleron GEXSCOPE平臺對5周齡CD226 KO小鼠和對照的野生型(WT)小鼠的胸腺細胞進行了scRNA-seq(圖1a)。通過質量控制并分別獲得了26962個(WT)和26283個(KO)胸腺細胞;利用UMAP對細胞群進行識別和可視化,大多數胸腺細胞被鑒定為T細胞(圖1b)。然后將T細胞進一步細分聚類為7個亞群,然后使用之前報道的marker進行了注釋(圖1c),并對T細胞每個cluster的前10個特征基因進行了展示。擬時序分析顯示,WT和CD226KO小鼠的胸腺細胞發育軌跡如下:DNT、DPT-P、DPT-Q、CD4+/CD8+ SP T細胞(CD4/CD8 T)(圖1c,e),這與前人的報道一致。

圖1 scRNA-seq揭示了CD226在胸腺T細胞發育中的重要性
CD226 KO組胸腺細胞各亞群的分布和比例發生了顯著變化(圖2a)。與WT小鼠相比,CD226KO小鼠的CD8+ SP胸腺細胞比例顯著降低,DPT-Q細胞比例顯著增加(圖2a,b)。然后,研究者又通過流式細胞術分析證實,CD226敲除降低了胸腺中CD8 T細胞的比例,增加了DPT細胞的比例(圖2c)。通過對DPT-Q、CD4+ T和CD8+ T細胞進行Monocle 2擬時序表明,CD226敲除一定程度上阻止DPT-Q分化為CD8+ T細胞(圖2d,e)。提示CD226在胸腺T細胞的發育過程中起重要作用,尤其是在DPT-Q向CD8+ T細胞的轉化過程中。

圖2 CD226敲除破壞胸腺T細胞發育
2.CD226在DPT期開始高表達
基于CD226在胸腺T細胞發育中的重要作用,研究者檢測了WT小鼠中不同發育階段的T細胞中CD226的表達情況。首先是通過jitter圖顯示了在T細胞分化的假時間過程中CD226的表達(圖3a),發現:CD226不表達于DNT期之前的各階段胸腺細胞,在DPT-Q期開始表達,在CD4+、CD8+和NKT細胞等終末分化T細胞中表達最高。接著,采用流式細胞術檢測WT小鼠胸腺中CD226蛋白的表達水平,發現:CD226水平按照DNT、DPT、CD4+ T和CD8+ T細胞的順序逐漸升高,其中CD226在DNT中表達最低,但在DPT期顯著升高(圖3b,c)。這表明CD226在DPT細胞中起重要作用。此外,CD8+ T細胞中CD226的表達顯著高于其他亞群,這可能是CD226敲除主要影響了CD8+ T細胞發育和功能的原因之一。

圖3 CD226在DPT期開始高表達
CD226敲除抑制DPT-Q向CD8+ T細胞的發育,DPT-Q是T細胞向SP細胞發育的關鍵階段。接下來,文章作者進一步對DPT-Q細胞展開研究。首先將DPT-Q細胞進行進一步分群,分為5個亞群,使用UMAP進行數據分析和可視化(圖4a)。通過UMAP圖可以看出,CD226敲除導致DPT-Q中缺少簇2、3和5(圖4c)。同時作者也對這些亞群的特征基因以熱圖的形式進行了展示。簇2可以由Granzyme A (Gzma)注釋(圖4e),而Granzyme A是一種選擇性地表達于CTL和NK細胞的絲氨酸蛋白酶,誘導腫瘤細胞和病毒感染細胞死亡,表明Gzma+ Cluster 2可能進一步發展為CD8+ T細胞。這些結果表明,CD226敲除抑制DPT-Q的發育,Gzma+亞群的缺失可能是CD8+ T發育障礙的潛在原因。

圖4 CD226敲除阻礙DPT-Q向CD8+ T細胞的發育
3.CD226的缺失通過減弱TCR信號強度阻礙了T細胞的陽性選擇
DPT-Q期的陽性選擇對T細胞向SP(單陽性)細胞的發育至關重要,DPT細胞只有接收到合適強度的TCR信號,才能通過陽性選擇,繼續存活和成熟。CD5的水平在陽性選擇過程中受到嚴格的調控,并且CD5的表達反映了TCR轉導信號的強度,CD5+ Cluster 3被鑒定為正在發生陽性選擇的DPT細胞。接下來,文章作者對CD5+ Cluster 3細胞展開了研究,jitter圖顯示CD5表達增加,之后隨擬時序順序降低,反映了DPT細胞經歷陽性選擇的動態過程(圖5a)。鑒于CD226敲除造成CD5+ Cluster 3細胞的顯著減少(圖4c),文章作者進一步研究了CD226是否影響DPT細胞的TCR信號強度。基于scRNA-seq的氣泡圖顯示,CD226 KO小鼠的DPT-Q和CD5+ DPT-Q細胞中TCR下游信號分子如Lck、Lat和Zap70的基因表達均下調(圖5b)。WT和CD226 KO 組DPT細胞之間差異基因的富集分析指向TCR下游的MAPK等相關信號通路(圖5c)。GO富集分析也顯示了TCR信號的一致結果,如分子功能中的轉錄因子和蛋白激酶結合,細胞成分中的細胞質,以及生物過程中的細胞分化(圖5d)。

圖5 CD226基因敲除減弱了陽性選擇中的TCR信號強度
4.CD226通過調控AKT活性調控DPT細胞凋亡
細胞凋亡是胸腺細胞進行陽性選擇和決定成熟單陽性T細胞數量的最重要機制,研究者通過流式細胞術檢測了WT和CD226KO小鼠胸腺細胞凋亡水平。WT胸腺細胞和CD226KO胸腺細胞中CD4+和CD8+ SP細胞的百分比沒有顯著差異,而CD226缺陷的DPT細胞顯示出更高的凋亡水平(圖6a)。
AKT通路參與細胞存活/凋亡的調節,當TCR被激活時,其下游元件NF-κB、AKT和MAPK發生級聯磷酸化。然而,在CD226缺陷的DPT細胞中,AKT在Ser473位點的磷酸化、ERK在Thr202/ Tyr204位點的磷酸化、NF-κB在Ser536位點的磷酸化和P38在Thr180/Tyr182位點的磷酸化顯著降低(圖6b)。與WT DPT細胞相比,CD226缺陷的DPT細胞表現出更高的凋亡水平,AKT激活劑SC79顯著逆轉了這種凋亡水平(圖6c)。
同時,促凋亡相關蛋白Bax和cleaved-caspase 3在CD226缺陷的DPT細胞中表達上調。AKT抑制劑增強了DPT細胞中Bax和cleaved-caspase 3的表達,AKT激活劑顯著逆轉了CD226缺陷的DPT細胞中Bax和cleaved-caspase 3的上調(圖6d)。上述結果表明,CD226可以通過調節AKT活性來調控DPT細胞凋亡,TCR信號強度減弱是CD226 KO小鼠陽性選擇受損和胸腺細胞發育障礙的原因。

圖6 CD226敲除通過調控AKT磷酸化促進DPT細胞凋亡
結論
1、本研究對WT和CD226 KO小鼠胸腺細胞進行了單細胞測序,CD226KO小鼠胸腺中CD8+ T細胞顯著減少,DPT-Q細胞顯著增加,表明CD226對胸腺細胞發育有重要影響。
2、研究了CD226在胸腺細胞各發育階段的動態表達規律,發現其在DPT時期開始高表達。
3、DPT-Q細胞被細分為5個細胞亞群,包括CD5高表達的細胞群,而CD226 KO組胸腺中明顯缺乏CD5表達,而另一簇Gzma+ DPT-Q亞群在CD226 KO胸腺中同樣缺失,表明DPT-Q向CD8+ T細胞發育過程受損。
4、CD226 KO降低了多個TCR下游分子基因的表達,CD226缺陷導致多個TCR信號通路相關的差異基因富集,包括MAPK通路。
5、通過體外實驗發現CD226敲除增加了DPT細胞的凋亡水平,而AKT激活劑可以在很大程度上逆轉CD226缺失的DPT細胞的凋亡增加。
綜上所述,CD226在DPT細胞陽性選擇過程中協同pMHC-TCR相互作用,為DPT-Q細胞向SP階段的發育提供足夠強度的刺激信號,其分子機制與AKT通路抑制DPT細胞凋亡有關,參與胸腺細胞發育的調節。該發現為共刺激分子CD226在T細胞分化和成熟中的調節作用研究提供了新的實驗數據和思路。
參考文獻
Jingchang Ma ,Yitian Liu , Chujun Duan et al. CD226 knockout reduces the development of CD8+ T by impairing the TCR sensitivity of double-positive thymocytes. Immunology. 2022 Nov 24. doi: 10.1111/imm.13612.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





