2022年納米流式檢測儀應用高分文獻精選:細胞外囊泡研究方法學篇
細胞外囊泡(extracellular vesicles, EVs)是由細胞分泌的具膜小囊泡,具有多種生物學功能,已有研究表明,EVs廣泛參與機體免疫應答、抗原遞呈、細胞遷移、細胞分化、腫瘤侵襲等過程,在多種疾病和生理過程中扮演重要的角色。由于EVs的來源、分離純化方法等存在差異,導致研究結果間的重復性和一致性不佳。制定EVs分離純化和表征標準已然成為各個細胞外囊泡學會或團體討論的熱點。由中國研究生醫院學會發布的《人間充質干細胞來源的小細胞外囊泡》和《人多能干細胞來源的小細胞外囊泡》兩項團體標準自2022年1月1日起正式開始實施,廈門福流自主研發的納米流式檢測儀已經被納入這兩項標準中,用于干細胞來源的小細胞外囊泡的質量控制。
本期小編將帶來2022年度細胞外囊泡研究方法學的4篇影響因子大于10分的文章,包含不同來源EVs的分離純化、蛋白標志物評估、DNA定量分析等,這些文章的共同點是均選用納米流式檢測儀(Nano-Flow Cytometry, NanoFCM)進行單個EV的分析。
01 間充質干細胞來源的凋亡囊泡和外泌體的蛋白組學分析

關鍵詞
凋亡囊泡、Fas、功能蛋白、A型血友病、間充質干細胞、血小板
研究摘要
凋亡囊泡(apoVs)是一種凋亡細胞來源的納米級囊泡,在多種病理生理環境中起著至關重要的作用。然而,它們的詳細特征、生物標志物和生物學特性尚未完全闡明。該研究比較了來自三種不同類型的間充質干細胞(MSC)衍生的apoVs和外泌體,包括人骨髓間充干細胞質干細胞(hBMSCs)、人脂肪間充質干細胞(hASCs)和小鼠骨髓間充質干細胞(mBMSCs)。建立了MSC衍生的apoV的獨特蛋白質圖譜,并確定了apoVs和外泌體在功能性蛋白質貨物和表面標志物方面的差異。與外泌體相比,鑒定出了13個在apoVs中特異性富集的蛋白,它們可以作為apoVs特異性的生物標志物。此外,該研究還發現apoVs繼承了凋亡相關因子Fas等親代細胞的凋亡印記,通過與血小板的配體FasL結合以激活血小板功能,從而改善凝血因子VIII敲除小鼠的A型血友病癥狀、挽救凝血障礙。本研究首次系統表征了MSCs來源的apoVs的生物學特征,為apoVs的研究奠定了堅實基礎,并首次闡明了apoVs通過Fas/FasL聯動機制激活血小板、糾正凝血障礙的生物學功能,提示了apoVs在血友病A治療中的潛在應用前景。
02 T細胞突觸囊泡研究新方法

關鍵詞
T細胞突觸囊泡,珠狀脂質雙分子層,捕獲技術,表征
研究摘要
免疫突觸(immunological synapse)是抗原遞呈細胞(antigen-presenting cell, APC)和T細胞相互作用的過程中,在細胞與細胞接觸部位形成的一個特殊結構,是促進抗原、共刺激/共抑制、細胞因子三種激活信號從抗原遞呈細胞傳遞到T細胞的分子樞紐。在與抗原遞呈細胞作用過程中,T細胞會釋放第四類信號—跨突觸囊泡(trans-synaptic vesicles, tSV),介導免疫細胞之間的雙向通信,但是它們作用的具體方式和原理仍不清楚。
該研究開創性地提出了脂質雙分子層珠子(Glass Bead Supported Lipid Bilayers, BSLB)作為一種多功能的合成APCs來捕獲、表征tSV,為研究tSV提供了一種新的檢測手段。BSLB可促進來自受刺激T細胞的CD40L的轉移,這在被轉移的tSV組成的BSLB上留下了突觸印記。該研究發現與細胞外囊泡(EVs)相比,tSV在大小、產量和免疫受體載體上都存在差異。此外,研究發現PD-L1與TSG101、ADAM10和CD81是決定CD40L囊泡釋放的關鍵。最后,作者發現,與EV相比,tSV中有更多的RNA結合蛋白和更高含量的microRNA,再次驗證了tSV作為細胞間信使的特殊作用。該研究開發了一種免疫細胞間信息傳遞和交流研究的新方法。
03 人血清和血漿來源細胞外囊泡的分離方法及不同亞群的評估

關鍵詞
生物標志物,外泌體,細胞外囊泡,微囊泡,血漿,血清,亞群
研究摘要
背景
從血液中分離獲得高純度的細胞外囊泡(EV)對于疾病診斷生物標志物的發現和驗證至關重要。血清和血漿的來源的EV都有相關的文獻報道,但鮮有研究對不同來源的EVs進行比較。本研究旨在確定血漿和血清中不同EV亞群的存在。
方法
(如圖1所示)采集健康受試者的血液,平行分離血漿和血清。使用ACD(淺黃色)或EDTA(紫色)管收集血漿,而在血凝塊激活劑管中獲得血清。利用以下三種方法純化EV:
①碘克沙醇墊(iodixanol density cushion, IDC)和尺寸排阻色譜法(size exclusion chromatography, SEC)結合;
②免疫磁珠捕獲系統(immuno-bead capturing, IBC),抗CD9、抗CD63和抗CD81的磁珠;
③IDC與碘克沙醇密度梯度離心(iodixanol density gradient,IDG)方法結合。
采用NTA、Western blot、SP-IRIS、常規流式細胞術和納米流式檢測技術、ELISA和質譜法分析不同分離方法獲得的EV亞群。此外,作者還比較了不同的血漿分離方法獲得的樣品血小板殘留的情況。
結果
本研究表明,與ACD血漿和血清相比,EDTA血漿中存在更多的CD9+EV,這些EV上存在CD41a,表明它們是從血小板中釋放的。此外,血液中只有極少數的EV是呈CD63和CD81雙陽性的。CD63+EV富含于血清,而CD81+EV在血漿和血清中都是最罕見的亞群。此外,使用EDTA管收集的血漿比ACD管收集血漿和血清含有更多的殘留血小板,在EV分離前對樣品進行兩次離心對于降低血漿中的血小板殘留至關重要。
結論
這些結果表明,人類血液中含有多個攜帶不同四次跨膜蛋白的EV亞群。血液取樣方法,包括抗凝血劑的使用和離心方案的選擇,都可能會影響EV分析,在發表文章時應做詳細報告。
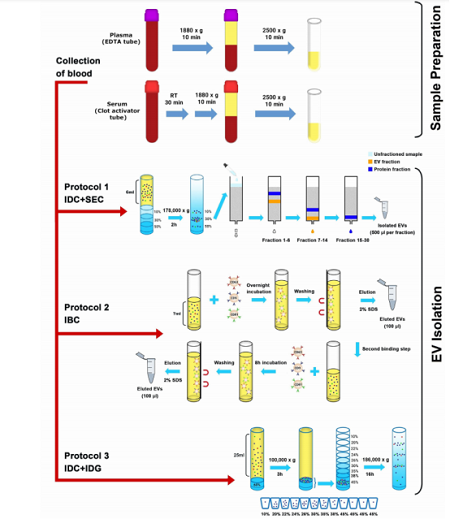

圖1. 實驗流程示意圖
04 利用納米流式檢測儀分析單個細胞外囊泡的DNA

關鍵詞
DNA,DNA酶消化,外泌體,細胞外囊泡,微囊泡,納米流式檢測儀,單顆粒分析
研究摘要
已有研究表明,細胞外囊泡(EVs)攜帶DNA,然而,EV中DNA(EV-DNA)的許多基本特征仍不清楚。本研究采用納米流式檢測儀(NanoFCM),散射光通道可檢測粒徑低至40 nm的單個EV的信號,熒光通道可實現SYTO 16標記的單個200 bp的DNA片段的檢測(技術路線如圖2所示)。通過同時對單個EV進行側向散射和熒光(FL)檢測并結合酶處理,本研究發現:
01 游離的DNA或與非囊泡實體相關的DNA大量存在于由細胞培養物制備的EV樣品中(培養基經超速離心處理)
02 單個EVs中EV-DNA的數量表現出很大的異質性,DNA陽性(DNA+)EVs的數量在30%到80%之間變化,具體取決于細胞類型;
03 外部EV-DNA主要定位在相對較小的EVs上(例如,HCT-15細胞系<100 nm),通過抑制外泌體分泌途徑可顯著降低DNA+EVs 的分泌;
04 內部EV-DNA主要封裝在相對較大的EV的內腔(例如HCT-15細胞系為80-200 nm);
05 雙鏈DNA(dsDNA)是外部和內部EV-DNA的主要存在形式;
06 EVs中未發現組蛋白(H3),EV-DNA與組蛋白不相關;
07 基因毒性藥物誘導DNA+EVs的釋放增加,外部DNA+EVs和內部DNA+EVs的數量以及單個EVs中的DNA含量均顯著增加。
這項研究為深入了解DNA與EV的相關性提供了直接和確鑿的實驗證據。
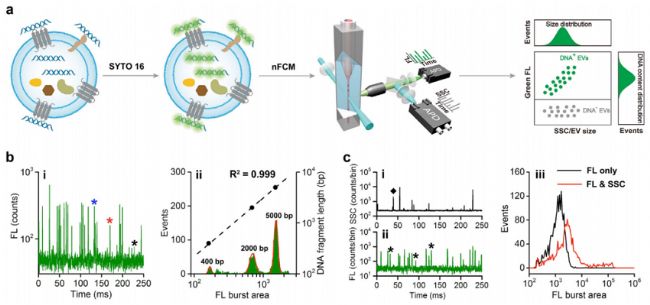
圖2. EV-DNA標記和NanoFCM分析示意圖
EVer福利
如您對于以上外泌體研究方法學文獻感興趣,歡迎掃描右方二維碼,即可獲取以上任意文獻PDF版本,同時,還可申請納米流式檢測技術在各個方向的應用主題報告,我們將第一時間與您取得聯系!






