腦立體定位注射系統應用揭示星形膠質細胞調控大腦抑郁網絡的作用機制
重度抑郁癥(Major depressive disorder, MDD)是導致自殺和致殘的主要原因,其終生患病率高達17%。識別抑郁癥患者大腦的功能連接異常,有助于抑郁癥病理生理機制的闡明和疾病的診斷。靜息態功能磁共振成像(resting-state functional magnetic resonance imaging, rsfMRI)是一種功能強大的非侵入性的功能連接研究技術,能夠對全腦尺度的腦區靜息態功能連接(resting-state functional connectivity, rsFC)進行量化。已有研究證實,抑郁癥患者情緒相關腦區存在rsFC異常,如前額葉皮層(medial prefrontal cortex, mPFC)、前扣帶回(anterior cingulate, ACC)、杏仁核(amygdala, AMY)、紋狀體(striatum, Str)等,因此,rsfMRI在抑郁癥的診斷中具有重要價值,然而對于抑郁癥相關rsFC異常的機制,目前的研究尚未闡明。
2022年11月16日,南方醫科大學曹雄教授、馮衍秋教授聯合香港大學吳學奎教授在Science Advances雜志上發表題為“Astrocyte dysfunction drives abnormal resting-state functional connectivity in depression”的文章。該研究基于星形膠質細胞鈣信號缺失兼具抑郁樣表型的Itpr2−/−小鼠,通過整合全腦rsfMRI和細胞特異性的光遺傳技術,并結合抑郁癥患者的rsfMRI分析,作者觀察到MDD患者的rsFC變化和Itpr2−/−小鼠高度一致,特別是與mPFC相關的環路連接。此外,光遺傳激活mPFC神經元或mPFC-Str環路拯救了Itpr2−/−小鼠的rsFC紊亂和抑郁樣表型。這些結果揭示了星形膠質細胞功能障礙驅動抑郁相關的大腦功能連接異常的神經環路機制。

星形膠質細胞是哺乳動物大腦中最豐富的一類膠質細胞,與抑郁癥關系密切。星形膠質細胞的激活表現為細胞內鈣信號的升高,主要由肌醇1,4,5-三磷酸(IP3)途徑介導,而其中的IP32型受體(IP3R2)是星形膠質細胞中的主要功能亞型。小鼠在敲除IP3R2(Itpr2−/−小鼠)后,星形膠質細胞表現出明顯的鈣信號減弱,但在神經元中并沒有,并且小鼠在強迫游泳測試和蔗糖偏好測試中表現出明顯的抑郁樣行為。
為了探討星形膠質細胞功能障礙對于rsfMRI功能連接的影響以及在抑郁癥中的作用,作者對Itpr2−/−小鼠全腦rsFC進行了檢測,結果顯示星形膠質細胞鈣信號降低導致全腦范圍內多個腦區的rsFC發生改變,并且其中6個環路連接的rsFC的變化與動物的抑郁樣表型呈現顯著負相關,表明星形膠質細胞功能障礙可導致全腦rsfMRI連接異常,并可預測抑郁表型。隨后,作者對1080名MDD患者和931名健康對照的rsfMRI數據進行了分析,發現MDD患者大腦rsFC的變化與Itpr2−/−小鼠存在高度一致性,尤其是與mPFC相關的環路。
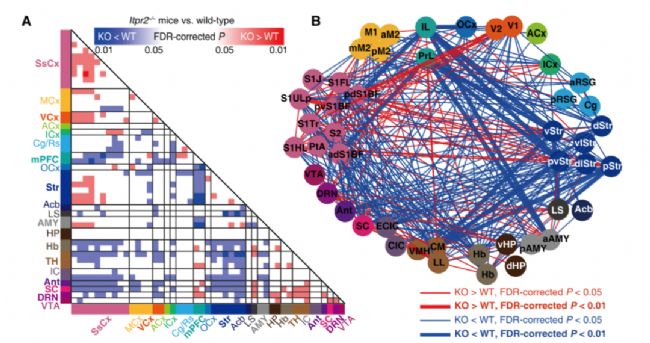
圖1.星形膠質細胞功能障礙導致全腦多個腦區rsFC改變
為了進一步揭示星形膠質細胞對抑郁相關網絡中rsFC的作用,作者利用光遺傳直接激活了mPFC中的星形膠質細胞,結果顯示51%的抑郁癥相關的功能連接的rsFC發生了反轉,表明光遺傳激活mPFC星形細胞可以緩解IP3R2敲除引起的rsFC改變。進一步的錳離子增強磁共振成像結果表明IP3R2缺失主要導致mPFC-Str環路的功能連接顯著受損,而通過光遺傳特異性激活mPFC神經元或mPFC-Str環路,均可拯救Itpr2−/−小鼠的絕大部分rsFC異常,并逆轉小鼠的抑郁樣行為。
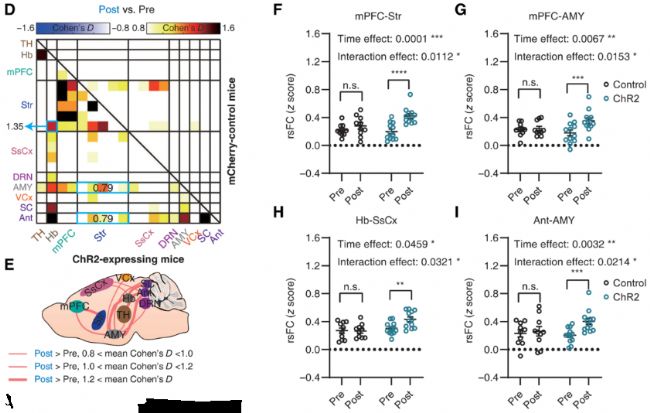
圖2.光遺傳激活mPFC-Str環路拯救了Itpr2−/−小鼠大部分的rsFC異常
綜上,該研究揭示了星形膠質細胞功能障礙導致抑郁癥相關rsFC異常的作用機制,實現了對微觀的星形膠質細胞功能障礙和宏觀的抑郁癥功能連接網絡異常這兩個概念的統一,這些結果可為rsfMRI作為抑郁癥的診斷和治療工具提供更為具體的解釋。
研究方法亮點
這項工作揭示了星形膠質細胞功能障礙驅動抑郁相關的大腦功能連接異常的神經環路機制。研究用到了腦立體定位手術、光遺傳學、免疫組化以及行為學評估等實驗技術。瑞沃德深耕生命科學研究領域20年,一直致力于為客戶提供可信賴的解決方案和服務。在該研究中,研究人員采用了瑞沃德公司生產的腦立體定位注射系統,為實驗的順利開展提供了支持。此外,瑞沃德還可提供該研究所涉及的光遺傳學、免疫組化以及行為學評估等實驗的完整解決方案。截至目前,瑞沃德產品及服務覆蓋海內外100多個國家和地區,客戶涵蓋全球700+醫院,1000+科研院所,6000+高等院校,已助力全球科研人員發表SCI文章14500+,獲得行業廣泛認可。

論文原文連接:https://www.science.org/doi/10.1126/sciadv.abo2098





