項目文章:固有免疫細胞焦亡是PD-L1檢查點阻斷的重要調節因子
2022年10月,南京醫科大學及南京中醫藥大學研究團隊在Cell Reports上發表題為“Gasdermin D restricts anti-tumor immunity during PD-L1 checkpoint blockade”的研究成果。本文系統地研究了GSDMD介導的固有免疫細胞焦亡對腫瘤免疫的影響及其作用機制,為GSDMD/PD-L1檢查點阻斷聯合治療提供新依據。
新格元參與該項研究中單細胞捕獲(Singleron Matrix®Single Cell Processing System)、單細胞文庫構建(GEXSCOPE® Single Cell RNA Library Kits)及生信分析工作。
研究背景
腫瘤微環境(TME)影響腫瘤的發生、發展以及對免疫療法的響應。CD8 T細胞(CTL)對于腫瘤細胞的抑制和清除至關重要。臨床發現大量患者對抗PD-1/PD-L1療法無響應,提示CD8 T細胞效應功能下降可能存在其他調控機制。
Gasdermins家族蛋白在腫瘤細胞中誘導細胞焦亡和腫瘤免疫調控作用已有較多報道。Gasdermin D(GSDMD)是細胞焦亡的主要效應分子,是經典和非經典炎癥小體共有的關鍵下游效應蛋白,主要表達于固有免疫抗原呈遞細胞(APC),其在抗腫瘤免疫和CD8 T細胞反應中的作用機制尚不清楚。
思維導圖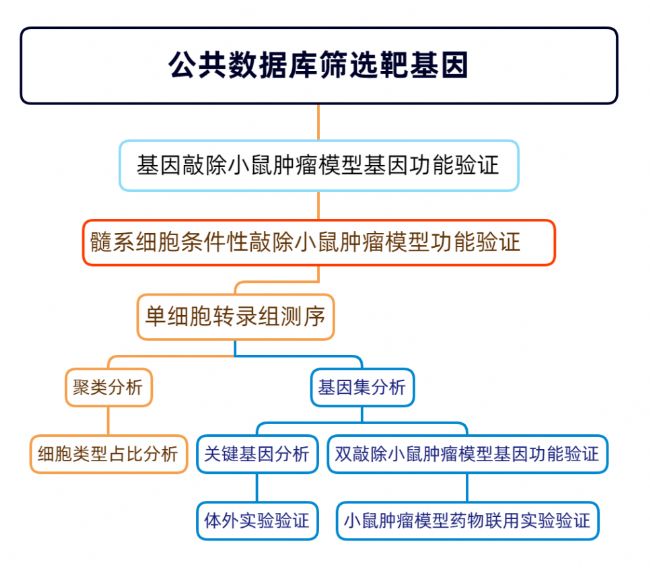
研究方法
TCGA數據庫篩選出與免疫檢查點表達相關的Gasdermin蛋白家族;用B16F10細胞系構建小鼠腫瘤模型;流式細胞術對不同免疫細胞表型鑒定;構建全敲除小鼠(Gsdmd-/-、cGas-/-及Gsdmd-/-cGas-/-)及髓系細胞特異性敲除小鼠(Gsdmdfl/fl、Cx3cr1-Cre)驗證基因功能;各實驗組小鼠腫瘤組織解離后通過流式分選富集免疫細胞并進行單細胞測序;免疫熒光共聚焦成像驗證GSDMD在各類免疫細胞的表達情況。
研究結果
1.TCGA數據庫相關性分析及Gsdmd-/-小鼠對PD-L1抑制劑的響應情況
作者首先通過公共數據庫分析Gasdermin蛋白家族成員在人和小鼠各類免疫細胞中的表達情況,發現Gasdermin D總體表達水平最高,尤其在髓系細胞。在TCGA數據庫收集的所有癌癥數據中,Gasdermin D的表達與多個免疫檢查點分子(如PDCD1、CTLA4及CD244等)表達正相關。此外,通過GEPIA2預后數據庫對33種不同癌種的分析發現GSDMD高表達與腫瘤患者總生存期負相關(圖1 D-F ACC、LGG及UVM3個癌種的GSDMD表達和患者預后)。
通過檢測GSDMD在多個腫瘤細胞系(B16F10、 MC38、GL261 及MCA205)的蛋白表達水平,發現其在B16F10細胞系的水平最低,選擇該細胞系研究GSDMD對抗腫瘤免疫抑制的調控作用。構建Gsdmd-/-小鼠并構建黑色素瘤小鼠模型,發現化療藥物奧沙利鉑可以提高WT及Gsdmd-/-小鼠抗腫瘤效果,但兩組小鼠對化療藥物的響應沒有顯著差別。Gsdmd-/-小鼠PD-L1阻斷治療效果較野生型小鼠好(腫瘤體積變小,免疫檢查點阻斷后生存期變長)。流式細胞術分析結果表明GSDMD敲除后I型干擾素及PD-1+TIM-3-T細胞比例上升,TIM-3+及TIGIT+CD8+ T細胞減少,CD4 T細胞、B細胞及NK細胞比例上升。此外表達MHC II的樹突細胞及巨噬細胞比例增加,骨髓來源抑制性細胞(MDSCs)比例顯著下降。以上結果說明GSDMD缺失可顯著提高PD-L1阻斷介導的CD8 T細胞抗腫瘤免疫響應。
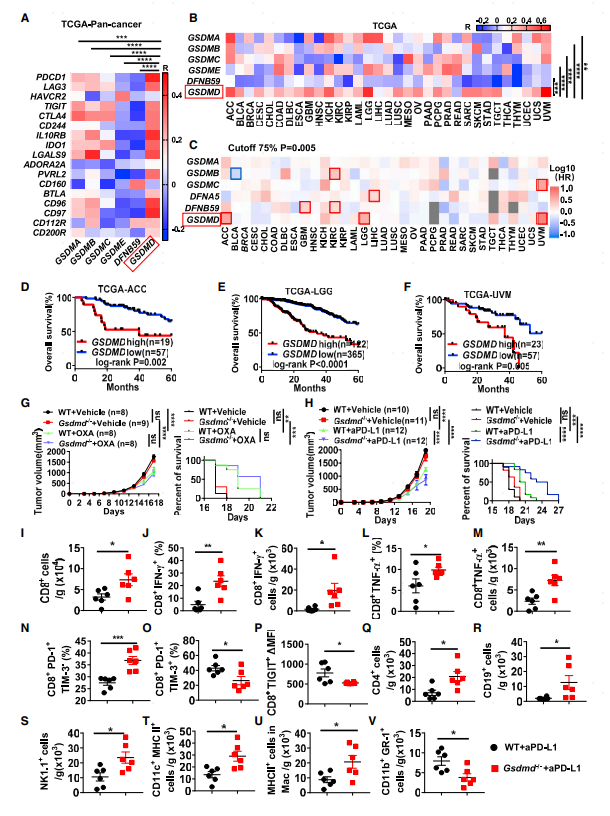
圖1 TCGA數據庫相關性分析及Gsdmd-/-小鼠對PD-L1抑制劑的響應情況
2.GSDMD缺失可提高腫瘤組織對PD-L1阻斷劑的響應
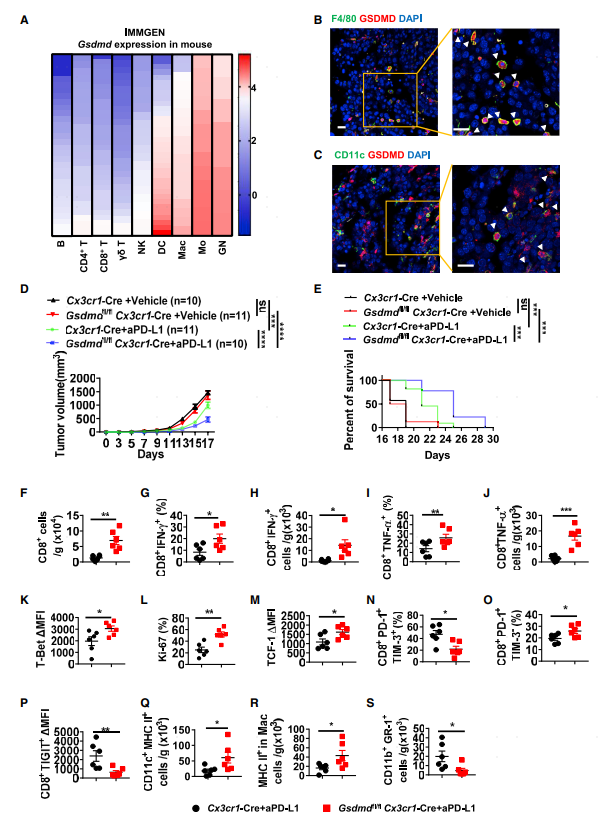
研究人員在ImmGen數據庫分析GSDMD在小鼠各類免疫細胞的表達情況,發現其在巨噬細胞和樹突細胞中高表達。共聚焦原位成像分析驗證了該結果(圖2B-C),提示GSDMD通過抗原呈遞細胞來抑制PD-L1的抗腫瘤效果。為了驗證這一猜想,構建了條件性敲除小鼠(Gsdmdfl/fl、Cx3xr1-Cre)。敲除GSDMD并不會影響腫瘤進展,但是可以提升PD-L1的治療效果(圖2D-E)。流式分析發現這類小鼠腫瘤組織中CD8 T細胞比例顯著上升,尤其是IFN-γ+和TNF-α+CD8+ T細胞(圖2F-J)。此外CD8 T細胞T-bet、Ki-67及TCF表達水平上升,表現出增強的毒性T細胞及干細胞特征。同樣PD-1+TIM-3-非耗竭性CD8 T細胞比例上升,PD-1+TIM-3+耗竭性CD8 T細胞及TIGIT+CD8+ T比例下降(圖2N-P)。和此前的結果一致,表達MHC II的樹突細胞及巨噬細胞比例上升,MDSCs比例下降。這些研究結果表明抗原呈遞細胞表達的GSDMD在PD-L1阻斷治療過程中對效應T細胞及抗原呈遞細胞的擴張起負調控的作用。
為了闡明GSDMD抑制APC細胞抗腫瘤免疫治療的分子機制,研究人員從腫瘤組織中分離出免疫細胞進行單細胞測序。無監督分群將TME的免疫細胞分為16個亞群,兩組小鼠的免疫細胞在降維圖上邊界明顯,說明它們基因表達特征差異較大。和流式結果一致,GSDMD敲除小鼠高表達和效應T細胞和記憶祖細胞相關的分子。此外MDSCs和遷移性DC細胞比例下降,已有研究表明這些細胞可以抑制CD8 T細胞的抗腫瘤作用。因為CD8 T細胞是腫瘤進展中關鍵的細胞類型,研究人員進一步分析了它和其他細胞的通訊情況。結果顯示Mac-4及migDC這兩類細胞和CD8 T細胞的互作評分最高(圖3C),巧合的是這兩類細胞ISG基因集評分也高于其他細胞類型,且敲除小鼠的ISG表達水平更高(圖3E)。另外注意到Mac-4和migDCs這兩類細胞是通過抗原呈遞相關的受配體與CD8 T進行細胞通訊,先前的研究表明干擾素刺激會促進抗原呈遞,這和單細胞分析結果是一致的。GSDMD敲除小鼠的幾個免疫細胞亞群比對照組有較高的抗原呈遞相關蛋白表達(圖3F-G)。分離出髓系細胞用B16F10腫瘤細胞的DNA進行體外實驗進行qPCR及流式檢測,發現接收腫瘤刺激信號后GSDMD敲除小鼠來源的髓系細胞ISG基因集相關蛋白(圖3H-I)及pTBK1和IRF3表達水平升高。以上結果表明GSDMD通過調節APC細胞中ISG的基因表達從而發揮抑制抗原呈遞及CD8 T細胞的抗腫瘤作用。
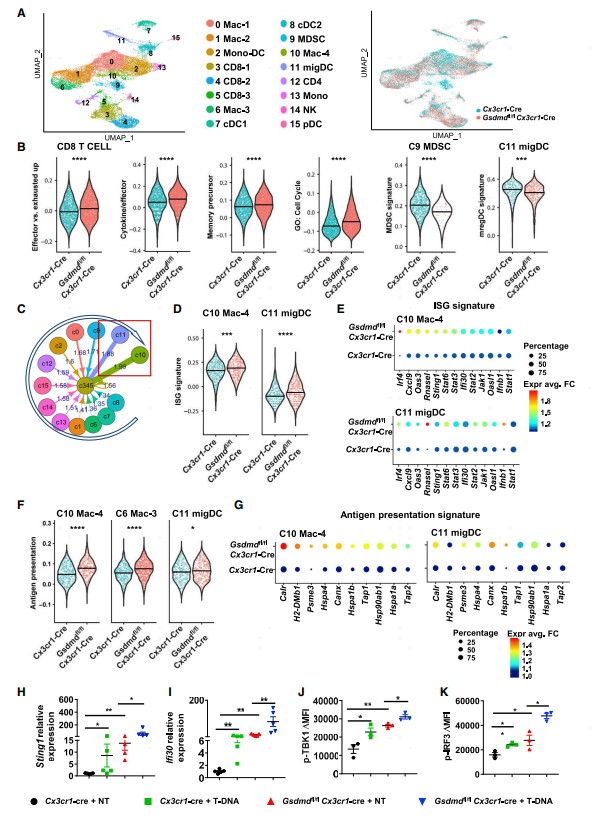
圖3 GSDMD缺失通過APC細胞ISG途徑促進CD8 T細胞的抗腫瘤免疫
4.GSDMD缺陷可增強PD-L1抑制劑處理時依賴cGAS的抗腫瘤免疫效果
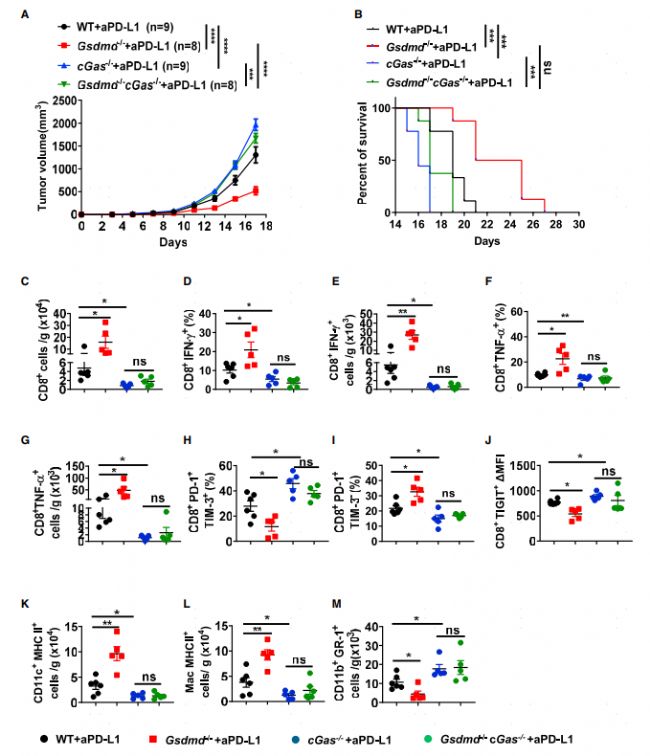
已有的研究表明在結腸炎及F.novicida感染時GSDMD是c-Gas介導的炎癥反應的負調控分子。TME的抗原呈遞細胞通過吞噬胞外腫瘤DNA分子激活cGAS-STING信號通路,從而誘導ISG的響應。基于這些研究基礎,研究人員構建了Gsdmd-/-cGas-/-雙敲除小鼠驗證GSDMD的促癌作用是否依賴c-GAS。GSDMD敲除小鼠腫瘤體積變小且生存期較長,而雙敲除小鼠沒有明顯的抗腫瘤特征(圖4A-B)。和表型結果一致,進一步的流式細胞分析發現雙敲除小鼠腫瘤組織中表達INFα和INFγ的CD8 T細胞比例及表達水平都要低于Gsdmd-/-單敲小鼠(圖4C-G)。此外,雙敲除小鼠中耗竭相關marker如TIM-3及TIGIT表達上調(圖4H-J),表達MHC II的DC及巨噬細胞比例也顯著下降(圖4K-L),而MDSCs細胞比例顯著上升(圖4M)。這些數據一致表明GSDMD通過抑制cGAS途徑來推動腫瘤進展。
此前有研究報道富馬酸二甲酯(DMF)可以抑制經典細胞焦亡通路中GSDMD被caspase1切割及后續的活化過程。用PD-L1抑制劑聯合DMF處理荷瘤小鼠,小鼠的腫瘤體積減小生存期延長(圖5A-B)。同時,總CD8 T細胞及產生細胞因子的T細胞比例較PD-L1抑制劑單藥處理組上升(圖5C-G),且耗竭特征T細胞比例下降(圖5H-I)。同時DMF和PD-L1抑制劑聯合處理后腫瘤組織中表達MHC II的DC及巨噬細胞比例上升,MDSCs細胞比例下降(圖5J-L)。此前有報導mTORC1可以調節GSDMD介導的細胞焦亡途徑,作者用mTORC1/2抑制劑AZD2014處理荷瘤的野生型小鼠及Gsdmd-/-小鼠,結果表明阻斷GSDMD介導的細胞焦亡途徑可提高PD-L1的抗腫瘤效果。 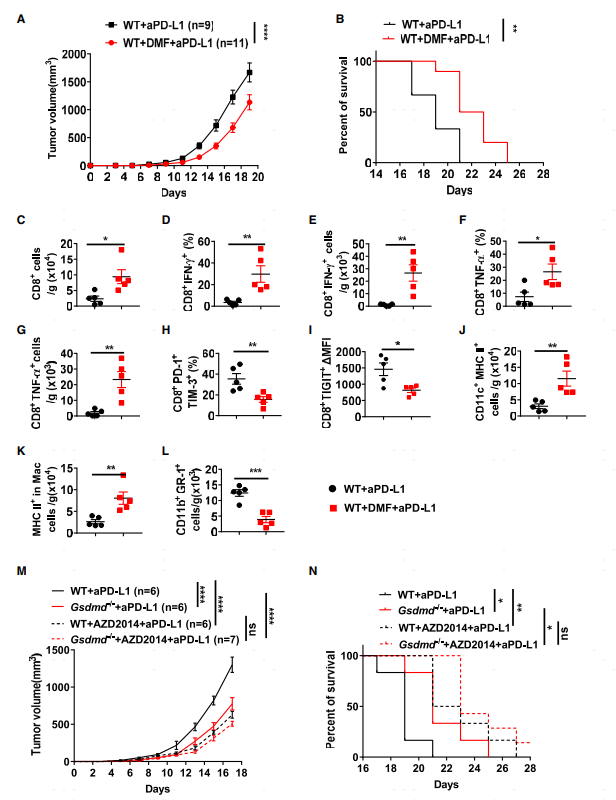
結論
本研究發現APC中的GSDMD缺失可顯著提高PD-L1阻斷介導的CD8 T細胞抗腫瘤效果,其以cGAS依賴性方式促進APC細胞的抗原提呈能力。首次將焦亡效應分子GSDMD鑒定為在腫瘤微環境中影響CD8 T細胞抗腫瘤效應的限制因子,突出免疫細胞焦亡效應在調節CD8 T細胞和抗腫瘤免疫反應中的重要作用和機制。此外,本研究還提示DMF/PD-L1聯合抑制在腫瘤免疫治療中的潛力。
參考文獻
Yuying Jiang , Yongbing Yang, Yingchao Hu, et al. Gasdermin D restricts anti-tumor immunity during PD-L1 checkpoint blockade.Cell Reports. 2022 Oct 25;41(4):111553.
新格元參與該項研究中單細胞捕獲(Singleron Matrix®Single Cell Processing System)、單細胞文庫構建(GEXSCOPE® Single Cell RNA Library Kits)及生信分析工作。
研究背景
腫瘤微環境(TME)影響腫瘤的發生、發展以及對免疫療法的響應。CD8 T細胞(CTL)對于腫瘤細胞的抑制和清除至關重要。臨床發現大量患者對抗PD-1/PD-L1療法無響應,提示CD8 T細胞效應功能下降可能存在其他調控機制。
Gasdermins家族蛋白在腫瘤細胞中誘導細胞焦亡和腫瘤免疫調控作用已有較多報道。Gasdermin D(GSDMD)是細胞焦亡的主要效應分子,是經典和非經典炎癥小體共有的關鍵下游效應蛋白,主要表達于固有免疫抗原呈遞細胞(APC),其在抗腫瘤免疫和CD8 T細胞反應中的作用機制尚不清楚。
思維導圖

研究方法
TCGA數據庫篩選出與免疫檢查點表達相關的Gasdermin蛋白家族;用B16F10細胞系構建小鼠腫瘤模型;流式細胞術對不同免疫細胞表型鑒定;構建全敲除小鼠(Gsdmd-/-、cGas-/-及Gsdmd-/-cGas-/-)及髓系細胞特異性敲除小鼠(Gsdmdfl/fl、Cx3cr1-Cre)驗證基因功能;各實驗組小鼠腫瘤組織解離后通過流式分選富集免疫細胞并進行單細胞測序;免疫熒光共聚焦成像驗證GSDMD在各類免疫細胞的表達情況。
研究結果
1.TCGA數據庫相關性分析及Gsdmd-/-小鼠對PD-L1抑制劑的響應情況
作者首先通過公共數據庫分析Gasdermin蛋白家族成員在人和小鼠各類免疫細胞中的表達情況,發現Gasdermin D總體表達水平最高,尤其在髓系細胞。在TCGA數據庫收集的所有癌癥數據中,Gasdermin D的表達與多個免疫檢查點分子(如PDCD1、CTLA4及CD244等)表達正相關。此外,通過GEPIA2預后數據庫對33種不同癌種的分析發現GSDMD高表達與腫瘤患者總生存期負相關(圖1 D-F ACC、LGG及UVM3個癌種的GSDMD表達和患者預后)。
通過檢測GSDMD在多個腫瘤細胞系(B16F10、 MC38、GL261 及MCA205)的蛋白表達水平,發現其在B16F10細胞系的水平最低,選擇該細胞系研究GSDMD對抗腫瘤免疫抑制的調控作用。構建Gsdmd-/-小鼠并構建黑色素瘤小鼠模型,發現化療藥物奧沙利鉑可以提高WT及Gsdmd-/-小鼠抗腫瘤效果,但兩組小鼠對化療藥物的響應沒有顯著差別。Gsdmd-/-小鼠PD-L1阻斷治療效果較野生型小鼠好(腫瘤體積變小,免疫檢查點阻斷后生存期變長)。流式細胞術分析結果表明GSDMD敲除后I型干擾素及PD-1+TIM-3-T細胞比例上升,TIM-3+及TIGIT+CD8+ T細胞減少,CD4 T細胞、B細胞及NK細胞比例上升。此外表達MHC II的樹突細胞及巨噬細胞比例增加,骨髓來源抑制性細胞(MDSCs)比例顯著下降。以上結果說明GSDMD缺失可顯著提高PD-L1阻斷介導的CD8 T細胞抗腫瘤免疫響應。

圖1 TCGA數據庫相關性分析及Gsdmd-/-小鼠對PD-L1抑制劑的響應情況
研究人員在ImmGen數據庫分析GSDMD在小鼠各類免疫細胞的表達情況,發現其在巨噬細胞和樹突細胞中高表達。共聚焦原位成像分析驗證了該結果(圖2B-C),提示GSDMD通過抗原呈遞細胞來抑制PD-L1的抗腫瘤效果。為了驗證這一猜想,構建了條件性敲除小鼠(Gsdmdfl/fl、Cx3xr1-Cre)。敲除GSDMD并不會影響腫瘤進展,但是可以提升PD-L1的治療效果(圖2D-E)。流式分析發現這類小鼠腫瘤組織中CD8 T細胞比例顯著上升,尤其是IFN-γ+和TNF-α+CD8+ T細胞(圖2F-J)。此外CD8 T細胞T-bet、Ki-67及TCF表達水平上升,表現出增強的毒性T細胞及干細胞特征。同樣PD-1+TIM-3-非耗竭性CD8 T細胞比例上升,PD-1+TIM-3+耗竭性CD8 T細胞及TIGIT+CD8+ T比例下降(圖2N-P)。和此前的結果一致,表達MHC II的樹突細胞及巨噬細胞比例上升,MDSCs比例下降。這些研究結果表明抗原呈遞細胞表達的GSDMD在PD-L1阻斷治療過程中對效應T細胞及抗原呈遞細胞的擴張起負調控的作用。

圖2 GSDMD缺失可提高腫瘤對PD-L1阻斷劑的響應
3.GSDMD缺失通過APC細胞ISG程序促進CD8 T細胞的抗腫瘤免疫為了闡明GSDMD抑制APC細胞抗腫瘤免疫治療的分子機制,研究人員從腫瘤組織中分離出免疫細胞進行單細胞測序。無監督分群將TME的免疫細胞分為16個亞群,兩組小鼠的免疫細胞在降維圖上邊界明顯,說明它們基因表達特征差異較大。和流式結果一致,GSDMD敲除小鼠高表達和效應T細胞和記憶祖細胞相關的分子。此外MDSCs和遷移性DC細胞比例下降,已有研究表明這些細胞可以抑制CD8 T細胞的抗腫瘤作用。因為CD8 T細胞是腫瘤進展中關鍵的細胞類型,研究人員進一步分析了它和其他細胞的通訊情況。結果顯示Mac-4及migDC這兩類細胞和CD8 T細胞的互作評分最高(圖3C),巧合的是這兩類細胞ISG基因集評分也高于其他細胞類型,且敲除小鼠的ISG表達水平更高(圖3E)。另外注意到Mac-4和migDCs這兩類細胞是通過抗原呈遞相關的受配體與CD8 T進行細胞通訊,先前的研究表明干擾素刺激會促進抗原呈遞,這和單細胞分析結果是一致的。GSDMD敲除小鼠的幾個免疫細胞亞群比對照組有較高的抗原呈遞相關蛋白表達(圖3F-G)。分離出髓系細胞用B16F10腫瘤細胞的DNA進行體外實驗進行qPCR及流式檢測,發現接收腫瘤刺激信號后GSDMD敲除小鼠來源的髓系細胞ISG基因集相關蛋白(圖3H-I)及pTBK1和IRF3表達水平升高。以上結果表明GSDMD通過調節APC細胞中ISG的基因表達從而發揮抑制抗原呈遞及CD8 T細胞的抗腫瘤作用。

圖3 GSDMD缺失通過APC細胞ISG途徑促進CD8 T細胞的抗腫瘤免疫
已有的研究表明在結腸炎及F.novicida感染時GSDMD是c-Gas介導的炎癥反應的負調控分子。TME的抗原呈遞細胞通過吞噬胞外腫瘤DNA分子激活cGAS-STING信號通路,從而誘導ISG的響應。基于這些研究基礎,研究人員構建了Gsdmd-/-cGas-/-雙敲除小鼠驗證GSDMD的促癌作用是否依賴c-GAS。GSDMD敲除小鼠腫瘤體積變小且生存期較長,而雙敲除小鼠沒有明顯的抗腫瘤特征(圖4A-B)。和表型結果一致,進一步的流式細胞分析發現雙敲除小鼠腫瘤組織中表達INFα和INFγ的CD8 T細胞比例及表達水平都要低于Gsdmd-/-單敲小鼠(圖4C-G)。此外,雙敲除小鼠中耗竭相關marker如TIM-3及TIGIT表達上調(圖4H-J),表達MHC II的DC及巨噬細胞比例也顯著下降(圖4K-L),而MDSCs細胞比例顯著上升(圖4M)。這些數據一致表明GSDMD通過抑制cGAS途徑來推動腫瘤進展。

圖4 GSDMD缺陷可增強PD-L1抑制劑處理時依賴cGas的抗腫瘤免疫效果
5.藥物抑制GSDMD結合PD-L1抑制劑處理顯著提高抗腫瘤免疫效果此前有研究報道富馬酸二甲酯(DMF)可以抑制經典細胞焦亡通路中GSDMD被caspase1切割及后續的活化過程。用PD-L1抑制劑聯合DMF處理荷瘤小鼠,小鼠的腫瘤體積減小生存期延長(圖5A-B)。同時,總CD8 T細胞及產生細胞因子的T細胞比例較PD-L1抑制劑單藥處理組上升(圖5C-G),且耗竭特征T細胞比例下降(圖5H-I)。同時DMF和PD-L1抑制劑聯合處理后腫瘤組織中表達MHC II的DC及巨噬細胞比例上升,MDSCs細胞比例下降(圖5J-L)。此前有報導mTORC1可以調節GSDMD介導的細胞焦亡途徑,作者用mTORC1/2抑制劑AZD2014處理荷瘤的野生型小鼠及Gsdmd-/-小鼠,結果表明阻斷GSDMD介導的細胞焦亡途徑可提高PD-L1的抗腫瘤效果。

圖5 藥物抑制GSDMD結合PD-L1抑制劑處理顯著提高抗腫瘤免疫效果
結論
本研究發現APC中的GSDMD缺失可顯著提高PD-L1阻斷介導的CD8 T細胞抗腫瘤效果,其以cGAS依賴性方式促進APC細胞的抗原提呈能力。首次將焦亡效應分子GSDMD鑒定為在腫瘤微環境中影響CD8 T細胞抗腫瘤效應的限制因子,突出免疫細胞焦亡效應在調節CD8 T細胞和抗腫瘤免疫反應中的重要作用和機制。此外,本研究還提示DMF/PD-L1聯合抑制在腫瘤免疫治療中的潛力。
參考文獻
Yuying Jiang , Yongbing Yang, Yingchao Hu, et al. Gasdermin D restricts anti-tumor immunity during PD-L1 checkpoint blockade.Cell Reports. 2022 Oct 25;41(4):111553.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com