動物活體成像的應用:探究阿侖膦酸鹽鐵納米螯合劑可以有效治療腹膜癌
近日,中山大學附屬第七醫院潘逸航副院長研究團隊發現阿侖膦酸鹽鐵納米螯合劑可以有效治療腹膜癌,相關研究成果已發表在國際知名期刊《ADVANCED SCIENCE》(IF=17.521,一區top期刊)上。

01 研究背景
鐵是各種細胞代謝的必要元素。癌細胞在其增殖、侵襲和轉移過程中對鐵有很高的需求。阿侖膦酸鹽(ALN)是一種FDA批準的具有金屬螯合能力的雙膦酸鹽,在本研究的理論和實驗中,最初被證明可以選擇性地結合細胞內的Fe3+。
因此,研究中合理地設計了CaALN鐵納米螯合劑,通過耗鐵和鈣積累的協同作用來殺死癌細胞。體外實驗和RNA測序分析表明,CaALN納米藥物通過消耗Fe、干擾DNA復制、觸發細胞內活性氧(ROS)來抑制癌細胞的增殖。同時,釋放的Ca2+和ROS相互促進并誘導細胞大分子損傷,導致癌細胞線粒體凋亡。
在含有人卵巢癌細胞SKOV3的腹腔內播散性小鼠模型中,CaALN納米顆粒選擇性地在腫瘤組織中積累,并導致腫瘤生長和腹水形成的顯著遲緩。治療組中攜帶SKOV3的小鼠的平均生存時間從33天延長到90天。這些結果表明,阿侖膦酸鹽來源的鐵螯合劑可作為治療腹膜癌的有效策略。
02 研究方法
為評價CaLAN的體內分布,通過腹腔注射5×106 SKOV3細胞至NOD/SCID小鼠體內,建立腹腔內播散性腫瘤異種移植模型。
值得注意的是,SKOV3細胞穩定地轉染了攜帶熒光素酶(Luc)基因的慢病毒,該基因可表現出較強的生物發光信號,并被動物活體成像系統捕獲。

為了實現體內實時監測,CaALN納米顆粒用DiR熒光標記。如圖3 A第一行所示,腹腔內可檢測到熒光素酶信號,提示腹腔內異種移植小鼠模型成功建立。腫瘤建立14天后,通過腹腔注射CaALN/DiR或游離DiR來評價CaALN納米顆粒在小鼠體內的分布。
腫瘤和器官的圖像和定量熒光強度證實了腹腔注射CaALN納米顆粒可以在注射4h后靶向腫瘤組織(圖3 A,B)。在游離DiR組中,熒光不僅分布在腫瘤部位,而且還分布在肝臟和脾臟(圖3 C,D)。CaALN的腫瘤靶向優勢可能歸因于腹膜-等離子體屏障的存在,它在腹膜腔內保持了較高的區域的CaALN納米顆粒濃度,并最終被癌細胞吸收(圖3 E)。相比之下,小分子可以通過腹膜-血漿屏障進入腹膜下毛細血管,并通過肝、脾進行代謝(圖3 F)。
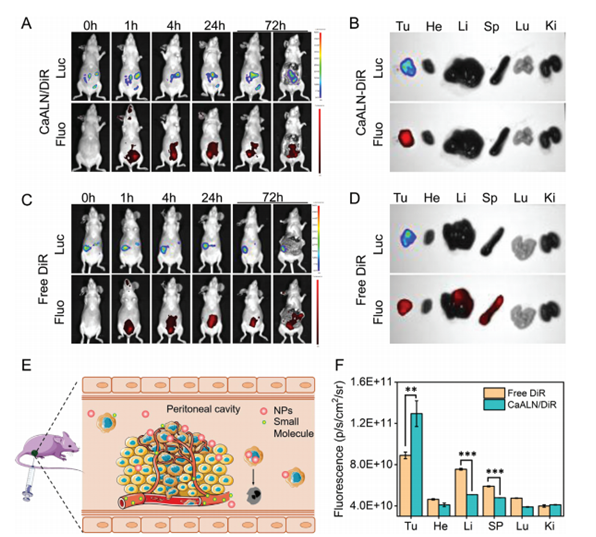
經腹腔注射A)CaALN/DiR和C)游離DiR后SKOV3荷瘤小鼠生物發光和熒光信號隨時間變化的圖像
B、 D)在腹腔注射72小時后,從SKOV3荷瘤小鼠解剖的腫瘤(Tu)、肝臟(Li)、心臟(He)、脾臟(Sp)、肺(Lu)和腎臟(Ki)的體外生物發光和熒光圖像。
E) CaALN納米顆粒和小分子的體內分布圖示。
F) 用CaALN/DiR和DiR處理的小鼠體外組織的熒光強度(平均值±SD,n=3,***P<0.001,**P<0.01)。
受其體外抗腫瘤活性和體內腫瘤靶向能力的影響,作者進一步評價了CaALN納米顆粒的體內腫瘤抑制活性。腫瘤細胞移植5天后,攜帶SKOV3的小鼠分別用PBS和兩種不同劑量的CaALN(10和25mg/kg,n=8)處理。對其中5只小鼠進行定期成像并通過收集體重、腹圍和生存數據進行監測。(圖4 A)。
如圖4 B,C所示,兩種劑量的CaALN處理組的生物發光維持了15天,這意味著完全抑制了腫瘤的生長。
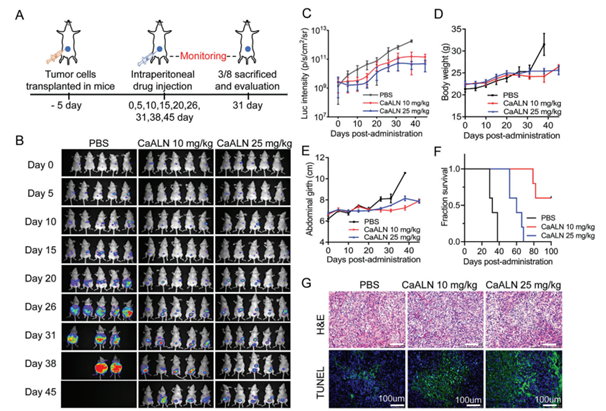
A) 使用SKOV3腹腔異種移植模型的體內抗腫瘤實驗的示意圖。
B) 生物發光圖像,C)生物發光強度,D)體重,E)腹圍,F)每個治療組中SKOV3荷瘤小鼠的生存曲線。
G) 第31天的代表性腫瘤切片的H&E染色圖像和隧道組織化學圖像。
04 總結
在人卵巢癌細胞SKOV3的腹腔內播散性小鼠模型中已經證明,CaALN納米顆粒腹腔注射給藥主要積累在腫瘤組織中。此外,CaALN納米顆粒治療不僅降低了腫瘤負荷,而且抑制了腹水的形成,在卵巢癌的治療中具有相當大的臨床應用價值。本研究已經證明了一種獨特的策略,使用阿侖膦酸鈉形成的鐵納米螯合劑,可以提高治療效力和減少小分子的副作用,以有效地治療腹膜癌。

△ 圖1國際知名期刊《ADVANCED SCIENCE》
01 研究背景
鐵是各種細胞代謝的必要元素。癌細胞在其增殖、侵襲和轉移過程中對鐵有很高的需求。阿侖膦酸鹽(ALN)是一種FDA批準的具有金屬螯合能力的雙膦酸鹽,在本研究的理論和實驗中,最初被證明可以選擇性地結合細胞內的Fe3+。
因此,研究中合理地設計了CaALN鐵納米螯合劑,通過耗鐵和鈣積累的協同作用來殺死癌細胞。體外實驗和RNA測序分析表明,CaALN納米藥物通過消耗Fe、干擾DNA復制、觸發細胞內活性氧(ROS)來抑制癌細胞的增殖。同時,釋放的Ca2+和ROS相互促進并誘導細胞大分子損傷,導致癌細胞線粒體凋亡。
在含有人卵巢癌細胞SKOV3的腹腔內播散性小鼠模型中,CaALN納米顆粒選擇性地在腫瘤組織中積累,并導致腫瘤生長和腹水形成的顯著遲緩。治療組中攜帶SKOV3的小鼠的平均生存時間從33天延長到90天。這些結果表明,阿侖膦酸鹽來源的鐵螯合劑可作為治療腹膜癌的有效策略。
02 研究方法
為評價CaLAN的體內分布,通過腹腔注射5×106 SKOV3細胞至NOD/SCID小鼠體內,建立腹腔內播散性腫瘤異種移植模型。
值得注意的是,SKOV3細胞穩定地轉染了攜帶熒光素酶(Luc)基因的慢病毒,該基因可表現出較強的生物發光信號,并被動物活體成像系統捕獲。

△ 圖2實驗中動物體內成像使用了博鷺騰AniView系列多模式動物活體成像系統進行拍攝。
為了實現體內實時監測,CaALN納米顆粒用DiR熒光標記。如圖3 A第一行所示,腹腔內可檢測到熒光素酶信號,提示腹腔內異種移植小鼠模型成功建立。腫瘤建立14天后,通過腹腔注射CaALN/DiR或游離DiR來評價CaALN納米顆粒在小鼠體內的分布。
腫瘤和器官的圖像和定量熒光強度證實了腹腔注射CaALN納米顆粒可以在注射4h后靶向腫瘤組織(圖3 A,B)。在游離DiR組中,熒光不僅分布在腫瘤部位,而且還分布在肝臟和脾臟(圖3 C,D)。CaALN的腫瘤靶向優勢可能歸因于腹膜-等離子體屏障的存在,它在腹膜腔內保持了較高的區域的CaALN納米顆粒濃度,并最終被癌細胞吸收(圖3 E)。相比之下,小分子可以通過腹膜-血漿屏障進入腹膜下毛細血管,并通過肝、脾進行代謝(圖3 F)。

△ 圖3CaALN的體內生物分布。
腹腔注射后SKOV3荷瘤小鼠體內時間依賴性生物發光和熒光圖像。經腹腔注射A)CaALN/DiR和C)游離DiR后SKOV3荷瘤小鼠生物發光和熒光信號隨時間變化的圖像
B、 D)在腹腔注射72小時后,從SKOV3荷瘤小鼠解剖的腫瘤(Tu)、肝臟(Li)、心臟(He)、脾臟(Sp)、肺(Lu)和腎臟(Ki)的體外生物發光和熒光圖像。
E) CaALN納米顆粒和小分子的體內分布圖示。
F) 用CaALN/DiR和DiR處理的小鼠體外組織的熒光強度(平均值±SD,n=3,***P<0.001,**P<0.01)。
受其體外抗腫瘤活性和體內腫瘤靶向能力的影響,作者進一步評價了CaALN納米顆粒的體內腫瘤抑制活性。腫瘤細胞移植5天后,攜帶SKOV3的小鼠分別用PBS和兩種不同劑量的CaALN(10和25mg/kg,n=8)處理。對其中5只小鼠進行定期成像并通過收集體重、腹圍和生存數據進行監測。(圖4 A)。
如圖4 B,C所示,兩種劑量的CaALN處理組的生物發光維持了15天,這意味著完全抑制了腫瘤的生長。

△ 圖4
CaALN對SKOV3小鼠的體內抗腫瘤作用。A) 使用SKOV3腹腔異種移植模型的體內抗腫瘤實驗的示意圖。
B) 生物發光圖像,C)生物發光強度,D)體重,E)腹圍,F)每個治療組中SKOV3荷瘤小鼠的生存曲線。
G) 第31天的代表性腫瘤切片的H&E染色圖像和隧道組織化學圖像。
04 總結
在人卵巢癌細胞SKOV3的腹腔內播散性小鼠模型中已經證明,CaALN納米顆粒腹腔注射給藥主要積累在腫瘤組織中。此外,CaALN納米顆粒治療不僅降低了腫瘤負荷,而且抑制了腹水的形成,在卵巢癌的治療中具有相當大的臨床應用價值。本研究已經證明了一種獨特的策略,使用阿侖膦酸鈉形成的鐵納米螯合劑,可以提高治療效力和減少小分子的副作用,以有效地治療腹膜癌。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





