全自動毛細管Digital Western在解鎖細胞熱位移CETSA實驗的應用

卞薇潔
博士研究生
北京大學
來魯華課題組
細胞熱位移實驗(CETSA)作為一種檢測藥物靶向性的手段,其主要缺陷是靈敏度仍然還不夠高,傳統的Western blot通常需要較高濃度的藥物靶蛋白的熱穩定性才會發生比較明顯的變化。并且傳統Western blot操作過程中受到跑膠,轉膜,抗體孵育,顯影等人工操作的影響,重復性會相對較差。且實驗過程較為繁瑣,費時費力,無法實現高通量的藥物篩選。
而全自動毛細管Digital Western作為一種創新的技術,可以直接定量檢測蛋白質的含量變化;其重復性好,消除了傳統Western blot方法不可避免的差異;靈敏度高,可檢測pg級別的蛋白質,因此蛋白含量的變化也比較容易被檢測到;高通量,其可以全自動方式3小時內提供24個樣本的數據,將有助于化合物的高通量篩選。
晝夜節律即生物鐘對于維持我們的生理和代謝功能尤為重要,最近的研究發現晝夜節律的破壞與一些慢性疾病比如情緒障礙和代謝性疾病以及癌癥有關,因此靶向生物鐘網絡的小分子調節劑成為疾病治療的新策略。CRY1蛋白作為生物鐘網絡最主要的抑制子發揮作用,由于其晶體結構已知也被用于藥物設計中,我們通過CAVITY程序對口袋分析發現一別構口袋可藥性良好,但至今沒有靶向該口袋的小分子調節劑被發現。因此我們通過理性藥物設計的方法,以期望更高效的獲得新型的生物鐘小分子調節劑。
前期結果中通過計算機輔助的藥物設計,我們發現了一個潛在活性化合物X,并且通過SPR、MST等實驗驗證了化合物X與CRY1的體外靶向性。因為CRY1作為轉錄抑制子位于細胞內,因此我們需要檢測藥物在細胞中與靶蛋白的相互作用。細胞熱位移實驗(CETSA)是2013年以Pär Nordlund為首的瑞典Karolinska研究所團隊研發的實驗技術,用于檢測藥物在細胞中的靶向性。該實驗原理是即隨溫度提高,蛋白會解折疊在細胞中迅速沉淀,通過監測加熱后可溶性蛋白含量分析其熔解曲線可表征其熱穩定性,而藥物分子與靶蛋白的結合會改變其熱穩定性。因此我們使用全自動毛細管Digital Western(即Simple Western)定量蛋白質表達分析系統進行細胞熱轉移實驗分析。
我們選用293T細胞系,外源轉染CRY1-Flag,12h后加入DMSO / 化合物X孵育3小時,裂解細胞,使用Wes(全自動毛細管Digital Western型號之一)定量分析靶蛋白在加藥處理后隨溫度的變化情況。可以看到化合物處理后相比于Control組,熱穩定性得到了明顯的提升(圖1),說明化合物X在細胞內確實可以靶向CRY1蛋白。
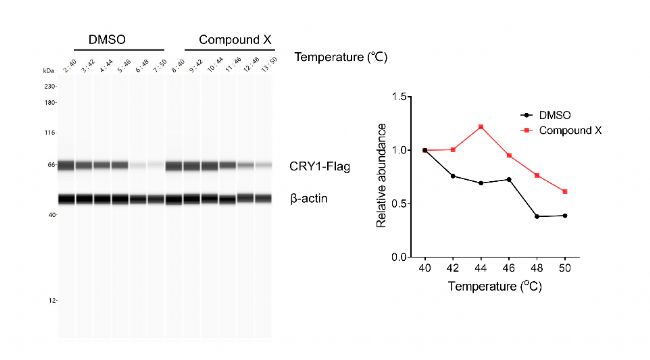
圖1. 化合物X可以增強CRY1熱穩定性。全自動毛細管Digital Western檢測化合物X對CRY1熱變性溫度的影響(左)CETSA 熔解曲線(右)。
CETSA作為一種檢測藥物靶向性的手段,其主要缺陷是靈敏度仍然還不夠高,傳統的Western blot通常需要較高濃度的藥物靶蛋白的熱穩定性才會發生比較明顯的變化。并且傳統Western blot操作過程中受到跑膠,轉膜,抗體孵育,顯影等人工操作的影響,重復性會相對較差。且實驗過程較為繁瑣,費時費力,無法實現高通量的藥物篩選。而全自動毛細管Digital Western作為一種創新的技術,可以直接定量檢測蛋白質的含量變化;其重復性好,消除了傳統Western blot方法不可避免的差異;靈敏度高,可檢測pg級別的蛋白質,因此蛋白含量的變化也比較容易被檢測到;高通量,其可以全自動方式3小時內提供 24個樣本的數據,將有助于化合物的高通量篩選。
在該部分研究中,我們成功發現了一個新型的CRY1調節劑,可以增強生物鐘網絡的振蕩,并且我們通過各種分子生物學手段驗證了其靶向性。而靶向生物鐘網絡由于化合物毒副作用低、多效性等特點具有很大優勢,可以用于到一些生物鐘破壞相關疾病的治療中。比如近些年研究發現生物鐘破壞與癌癥有十分密切的關系,因此生物鐘的小分子調節劑或許可以改善藥物治療效果并提高患者的生存率,生物鐘小分子調節劑的開發具有很大的應用前景。

掃碼解鎖更多全自動Digital Western資料






