高通量雙抗篩選在類器官模型藥物篩選的應用
古有神農嘗百草,今有類器官試藥
結直腸癌(CRC:Colorectal Cancer)為全球范圍內排名第三位最常見的癌癥。2020年,近乎200萬人確診,它也是第二大引起死亡的癌癥殺手。--來自WHO
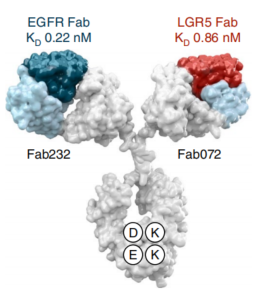
患者衍生類器官(PDO: Patient-derived organoids)模型在藥物篩選中有巨大應用價值。2022年題為Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors的文章發表于Nature Cancer(IF:21.94)期刊,由類器官之父Hans Clever等來自企業和高校39位科學家共同完成。

研究者利用結直腸癌PDO,對超過500種雙特異性抗體進行藥物篩選,最終發現MCLA-158(EGFR x LGR5雙特異性抗體)可與表皮生長因子受體(EGFR)和富含亮氨酸重復序列的G蛋白偶聯受體-5(LGR5)相結合,有效抑制結直腸癌類器官生長和轉移。
PDO比2D細胞培養更能模擬腫瘤,可更好地再現原發腫瘤異質性和空間組織。攜帶KRAS激活突變的很大一部分CRC仍然顯示出對EGF的依賴,而在標準培養條件下擴增的細胞系卻未能顯示出這一特征。另外,可使用同一患者健康和癌變PDO,共同應用于早期候選藥物篩選,排除對健康組織產生不利影響的藥物。
然而,所有的研究模型,無論是細胞培養、人源化組織異種移植小鼠(PDX:Patient-derived xenografts)還是PDO,在面對復雜的病理生理條件下,都有各自局限,甚至可能產生互相矛盾的結果。例如,具有KRAS突變的皮下PDX模型對MCLA-158的敏感性低于KRAS突變的PDO模型。因此,治療性藥物發現面臨諸多挑戰。早在2016年,美國國家癌癥研究所(NCI)就曾宣布,已被全世界研究人員所使用長達25年之久的NCI-60細胞系將退出歷史舞臺,取而代之的是來自癌癥患者且經小鼠體內培養的新腫瘤樣本,即PDX模型。不可否認,PDO的熱度與關注度與日俱增,對比PDX模型的周期長、低通量、高成本,PDO可身先士卒,與PDX等模型一起為藥物篩選共同賦能。
研究人員利用全自動Digital Western檢測
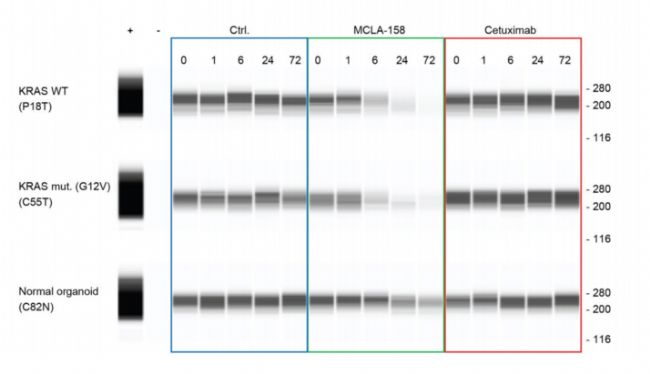
本文中,研究人員利用毛細管全自動Digital Western檢測 P18T(KRAS野生型)、C55T(KRAS突變型)和C82N(非病變類器官)樣本中,使用MCLA-158和西妥昔單抗(Cetuximab)培養(0小時、1小時、6小時、72小時)后,EGFR蛋白表達情況。西妥昔單抗是靶向EGFR的單克隆抗體藥物,用于治療結直腸癌轉移患者。然而,存在諸多局限。目前抗-EGFR藥物對RAS腫瘤家族(主要為KRAS)激活突變的CRC患者無效;并且,在RAS野生型患者中,僅對一部分人有效,并伴隨治療限制性不良反應。因此,在本實驗中作為與MCLA-158的對照。
Q
類器官研究,為何需要全自動Digital Western?
A
省!3μL樣品量,適用于類器官,外泌體,顯微切割等珍稀樣品;
準!自動化,高數據質量:減少傳統WB引入的人為誤差;
全!全膜結果,數據可追溯:無被質疑煩惱;
快!僅需3小時即可檢測25個樣本。
掃描下方二維碼獲取全自動Digital Western資料






