Cell文章研究解析:如何開發帕金森抑制劑
帕金森病(Parkinson’s disease,PD)是一種常見的神經退行性疾病,最主要的病理改變是中腦黑質多巴胺(dopamine, DA)能誘導神經元的變性死亡,由此而引起紋狀體DA含量顯著性減少而致病。典型的癥狀就是無力、遲緩、僵硬…
等等,陳老濕怎么最近也有這種感覺。。。哦,不對,這是天氣太熱,各地高溫頻頻鬧得。。。
說回正題,為了探究PD的確切病因,美國約翰霍普金斯大學醫學院Dawson實驗室曾命名了一種新的程序性細胞壞死形式——Parthanatos,又稱PARP-1 dependent cell death,是基于DNA損傷,PARP-1激活的細胞壞死。這種細胞死亡廣泛地存在于不同的器官不同的疾病中,包括帕金森病、阿爾茨海默癥、多發性硬化癥、亨廷頓氏舞蹈病等。

圖1
近期,Dawson團隊又有了重磅發現——抑制PAAN/MIF核酸酶可防止帕金森病的神經退行性,相關《Cell》文章于2022年5月10日在線發表。該研究揭示了病理性α-突觸蛋白(α-syn)誘導的神經變性是通過Parthanatos相關凋亡誘導因子(AIF)核酸酶(PAAN)/巨噬細胞遷移抑制因子(MIF)的核酸酶活性發生的。PAAN/MIF的遺傳耗竭和缺乏核酸酶活性的突變體可防止散發性PD的α-syn預成纖維(PFF)小鼠模型中多巴胺能神經元的缺失和行為缺陷。通過化合物篩選,研究人員發現了PAANIB-1—— 一種腦滲透性的PAAN/MIF核酸酶抑制劑,可以防止α-syn PFF、AAV-α-syn過表達或MPTP中毒在體內誘發的神經退行性。這項發現可能在人類神經退行性病癥中具有廣泛的意義。
陳老濕帶大家整理下研究思路:
1 敲除或者耗竭PAAN/MIF核酸酶活性可以減少α-syn PFF引起的病理變化
2 證明PAAN/MIF核酸酶活性誘導的基因組DNA裂解和神經元死亡
3 構建篩選平臺,通過受體蛋白復合物篩選小分子化合物庫
4 優化小分子結構,并進行藥代動力學分析
5 動物實驗評估藥物的特性
首先,研究人員通過基因敲除(KO)和突變(E22Q、P2G),利用腺相關病毒(AAV)在MIF KO小鼠中表達PAAN/MIF WT、PAAN/MIF E22Q和MIF P2G的基因,證實PAAN/MIF的核酸酶活性,而不是MIF的異構酶酶活性,是α-syn PFF誘導的體內神經退行性病變所必需的(圖 2)。
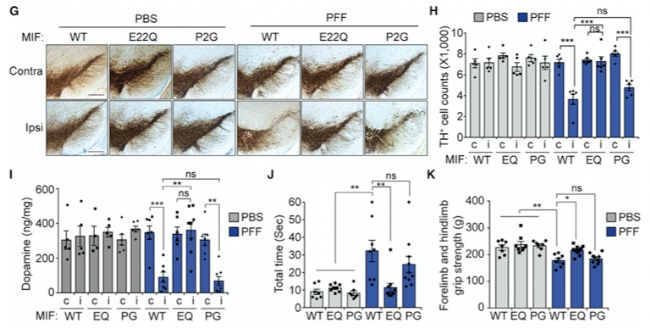
圖2通過刪除PAAN/MIF的核酸酶活性,α-Syn PFF誘導的病理學特征減少
接著,研究人員確定了PAAN/MIF核酸酶轉位介導了α-syn PFF誘導的基因組DNA裂解和神經元死亡。AIF和PAAN/MIF在α-syn PFF給藥后相互作用,它們在細胞核內共同定位(圖3C)。PAAN/MIF WT、E22Q和MIF P2G在對α-syn PFF的反應中的核轉位沒有差異。敲除PAAN/MIF可以防止α-syn PFF誘導的基因組DNA裂解(圖3D)、細胞死亡(圖3E和3F)。在MIF KO神經元中,通過慢病毒表達PAAN/MIF WT和MIF P2G可恢復基因組DNA的裂解和細胞死亡,但在用PAAN/MIF E22Q和AIF結合缺陷突變體PAAN/MIF E22A的神經元中未觀察到DNA裂解和細胞死亡(圖3D-3F)。在PAAN/MIF E22Q和MIF P2G回補的神經元中也得到了類似的結果。這些數據表明,PAAN/MIF的核酸酶活性及其與AIF的結合對基因組DNA的裂解和α-syn PFF誘導的細胞死亡是必需的。
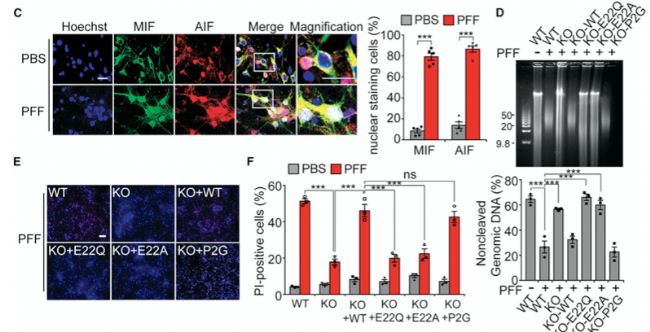
圖3PAAN/MIF核酸酶活性是預防α-syn PFF誘導神經毒性的關鍵
在確認了PAAN/MIF核酸酶活性是誘導α-syn PFF引發病理性變化的關鍵證據后,研究人員構建了一個基于熒光顯色的DNA完整性篩選平臺(圖4A)。當MIF具有核酸酶活性就可以結合到基因組DNA上,從而破壞DNA雙鏈完整性,導致熒光信號降低或消失。當抑制劑與MIF結合后,MIF不再具備核酸酶活性,因此熒光信號正常顯示。通過這一平臺的構建,研究人員篩選了具有45,000個候選分子的化合物庫。經過多輪篩選,最終找到了編號C8的化合物能防止用人α-syn PFF處理的人皮質神經元的基因組DNA裂解(圖4G和4H),并且可以在口服后仍具有穿過血腦屏障(Blood Brain Barrier)的能力。

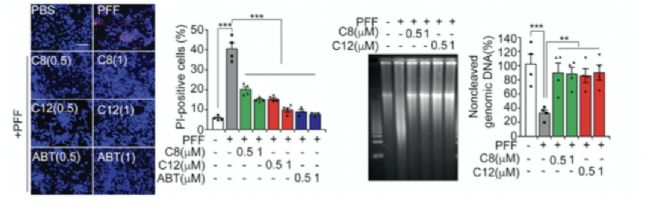
圖4PAAN/MIF核酸酶抑制劑的篩選與鑒定
為了優化C8的效力并增加其中樞神經系統(CNS)的滲透性,研究人員設計了一個C8衍生物,優化后命名為C8-31(以下稱為parthanatos-associated nuclease inhibitor-1,PAANIB-1),它與C8的不同之處在于增加了一個氟(圖5B)。PAANIB-1能有效地抑制PAAN/MIF核酸酶的活性和Parthanatic細胞的死亡(圖5A)。PAANIB-1抑制MNNG誘導的Parthanatic細胞死亡的IC50為0.28 μM,C8的IC50為0.52 μM(圖5C)。PAANIB-1與C8相似,通過抑制PAAN/MIF核酸酶的活性,保護神經元免受α-syn PFF引起的突觸障礙、NAD+減少和細胞死亡。
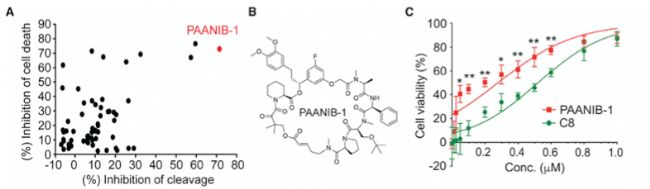
圖5PAANIB-1是一種PAAN/MIF核酸酶抑制劑
然后,研究人員需要確定PAANIB-1如何影響PAAN/MIF核酸酶,首先就要判斷PAANIB-1與PAAN/MIF是否直接結合?
PAAN/MIF與PAANIB-1的結合實驗不出意外地選用了Octet® BLI(生物層干涉)分子互作分析系統進行定量檢測,結果表明二者的親和力KD值為1.56 μM(圖6A)。
研究人員構建PAAN/MIF三聚體模型,預測了PAAN/MIF的61-64、67-68、73、98-100和106位的氨基酸是潛在的PAANIB-1結合點。對推定結合位點周圍的每個殘基進行了丙氨酸突變。其中,在PAAN/MIF L62A、PAAN/MIF 61-64A和PAAN/MIF N73A突變體中,PAANIB-1對MNNG誘導的細胞死亡的保護作用明顯減弱(圖6C)。進一步測定PAAN/MIF WT和丙氨酸突變體與PAANIB-1的結合動力學,結果表明,PAAN/MIF WT和Y100A突變體與PAANIB-1結合,而L62A和N73A突變體的結合明顯減弱(圖6D)。
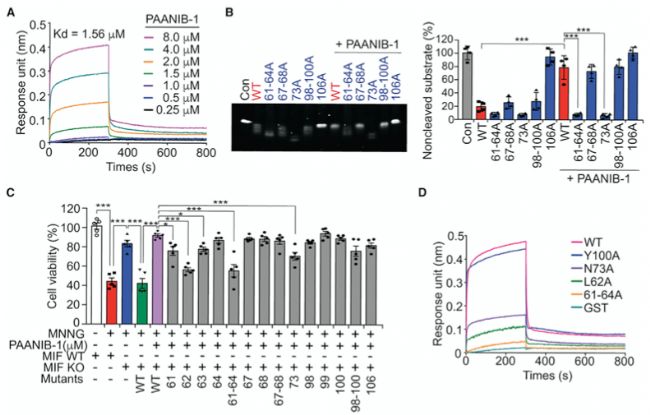
圖6PAANIB-1與PAAN/MIF的抑制作用機制是直接相互作用
文章最后,作者將PAANIB-1作為口服藥物,通過小鼠實驗的行為能力測試評估及病理實驗證實PAANIB-1是一個具有成藥潛力的小分子核酸酶抑制劑。這在開發靶向可藥物化的PAAN/MIF核酸酶的細胞死亡抑制劑方面提供了啟示和指導作用。
Summary
縱觀整篇文章,作者結合目前常用的實驗技術方法和手段,完成了出色的研究工作。其中體外的互作驗證,采用BLI方法進行的蛋白與小分子結合動力學實驗。基于BLI的Octet®是檢測結合動力學的標準方法學之一,已經被寫入美國藥典。快速準確,結實耐用,成本低~
Octet® 分子互作分析系統

Download
了解更多BLI技術在小分子結合動力學的應用優勢,下載《優化蛋白-蛋白,蛋白-小分子結合動力學分析應用指南》

掃碼下載全文

-參考文獻-
Park et al., PAAN/MIF nuclease inhibition prevents neurodegeneration in Parkinson’s disease, Cell (2022).https://doi.org/10.1016/j.cell.2022.04.020
等等,陳老濕怎么最近也有這種感覺。。。哦,不對,這是天氣太熱,各地高溫頻頻鬧得。。。
說回正題,為了探究PD的確切病因,美國約翰霍普金斯大學醫學院Dawson實驗室曾命名了一種新的程序性細胞壞死形式——Parthanatos,又稱PARP-1 dependent cell death,是基于DNA損傷,PARP-1激活的細胞壞死。這種細胞死亡廣泛地存在于不同的器官不同的疾病中,包括帕金森病、阿爾茨海默癥、多發性硬化癥、亨廷頓氏舞蹈病等。

圖1
近期,Dawson團隊又有了重磅發現——抑制PAAN/MIF核酸酶可防止帕金森病的神經退行性,相關《Cell》文章于2022年5月10日在線發表。該研究揭示了病理性α-突觸蛋白(α-syn)誘導的神經變性是通過Parthanatos相關凋亡誘導因子(AIF)核酸酶(PAAN)/巨噬細胞遷移抑制因子(MIF)的核酸酶活性發生的。PAAN/MIF的遺傳耗竭和缺乏核酸酶活性的突變體可防止散發性PD的α-syn預成纖維(PFF)小鼠模型中多巴胺能神經元的缺失和行為缺陷。通過化合物篩選,研究人員發現了PAANIB-1—— 一種腦滲透性的PAAN/MIF核酸酶抑制劑,可以防止α-syn PFF、AAV-α-syn過表達或MPTP中毒在體內誘發的神經退行性。這項發現可能在人類神經退行性病癥中具有廣泛的意義。
陳老濕帶大家整理下研究思路:
1 敲除或者耗竭PAAN/MIF核酸酶活性可以減少α-syn PFF引起的病理變化
2 證明PAAN/MIF核酸酶活性誘導的基因組DNA裂解和神經元死亡
3 構建篩選平臺,通過受體蛋白復合物篩選小分子化合物庫
4 優化小分子結構,并進行藥代動力學分析
5 動物實驗評估藥物的特性
首先,研究人員通過基因敲除(KO)和突變(E22Q、P2G),利用腺相關病毒(AAV)在MIF KO小鼠中表達PAAN/MIF WT、PAAN/MIF E22Q和MIF P2G的基因,證實PAAN/MIF的核酸酶活性,而不是MIF的異構酶酶活性,是α-syn PFF誘導的體內神經退行性病變所必需的(圖 2)。

圖2通過刪除PAAN/MIF的核酸酶活性,α-Syn PFF誘導的病理學特征減少
接著,研究人員確定了PAAN/MIF核酸酶轉位介導了α-syn PFF誘導的基因組DNA裂解和神經元死亡。AIF和PAAN/MIF在α-syn PFF給藥后相互作用,它們在細胞核內共同定位(圖3C)。PAAN/MIF WT、E22Q和MIF P2G在對α-syn PFF的反應中的核轉位沒有差異。敲除PAAN/MIF可以防止α-syn PFF誘導的基因組DNA裂解(圖3D)、細胞死亡(圖3E和3F)。在MIF KO神經元中,通過慢病毒表達PAAN/MIF WT和MIF P2G可恢復基因組DNA的裂解和細胞死亡,但在用PAAN/MIF E22Q和AIF結合缺陷突變體PAAN/MIF E22A的神經元中未觀察到DNA裂解和細胞死亡(圖3D-3F)。在PAAN/MIF E22Q和MIF P2G回補的神經元中也得到了類似的結果。這些數據表明,PAAN/MIF的核酸酶活性及其與AIF的結合對基因組DNA的裂解和α-syn PFF誘導的細胞死亡是必需的。

圖3PAAN/MIF核酸酶活性是預防α-syn PFF誘導神經毒性的關鍵
在確認了PAAN/MIF核酸酶活性是誘導α-syn PFF引發病理性變化的關鍵證據后,研究人員構建了一個基于熒光顯色的DNA完整性篩選平臺(圖4A)。當MIF具有核酸酶活性就可以結合到基因組DNA上,從而破壞DNA雙鏈完整性,導致熒光信號降低或消失。當抑制劑與MIF結合后,MIF不再具備核酸酶活性,因此熒光信號正常顯示。通過這一平臺的構建,研究人員篩選了具有45,000個候選分子的化合物庫。經過多輪篩選,最終找到了編號C8的化合物能防止用人α-syn PFF處理的人皮質神經元的基因組DNA裂解(圖4G和4H),并且可以在口服后仍具有穿過血腦屏障(Blood Brain Barrier)的能力。


圖4PAAN/MIF核酸酶抑制劑的篩選與鑒定
為了優化C8的效力并增加其中樞神經系統(CNS)的滲透性,研究人員設計了一個C8衍生物,優化后命名為C8-31(以下稱為parthanatos-associated nuclease inhibitor-1,PAANIB-1),它與C8的不同之處在于增加了一個氟(圖5B)。PAANIB-1能有效地抑制PAAN/MIF核酸酶的活性和Parthanatic細胞的死亡(圖5A)。PAANIB-1抑制MNNG誘導的Parthanatic細胞死亡的IC50為0.28 μM,C8的IC50為0.52 μM(圖5C)。PAANIB-1與C8相似,通過抑制PAAN/MIF核酸酶的活性,保護神經元免受α-syn PFF引起的突觸障礙、NAD+減少和細胞死亡。

圖5PAANIB-1是一種PAAN/MIF核酸酶抑制劑
然后,研究人員需要確定PAANIB-1如何影響PAAN/MIF核酸酶,首先就要判斷PAANIB-1與PAAN/MIF是否直接結合?
PAAN/MIF與PAANIB-1的結合實驗不出意外地選用了Octet® BLI(生物層干涉)分子互作分析系統進行定量檢測,結果表明二者的親和力KD值為1.56 μM(圖6A)。
研究人員構建PAAN/MIF三聚體模型,預測了PAAN/MIF的61-64、67-68、73、98-100和106位的氨基酸是潛在的PAANIB-1結合點。對推定結合位點周圍的每個殘基進行了丙氨酸突變。其中,在PAAN/MIF L62A、PAAN/MIF 61-64A和PAAN/MIF N73A突變體中,PAANIB-1對MNNG誘導的細胞死亡的保護作用明顯減弱(圖6C)。進一步測定PAAN/MIF WT和丙氨酸突變體與PAANIB-1的結合動力學,結果表明,PAAN/MIF WT和Y100A突變體與PAANIB-1結合,而L62A和N73A突變體的結合明顯減弱(圖6D)。

圖6PAANIB-1與PAAN/MIF的抑制作用機制是直接相互作用
文章最后,作者將PAANIB-1作為口服藥物,通過小鼠實驗的行為能力測試評估及病理實驗證實PAANIB-1是一個具有成藥潛力的小分子核酸酶抑制劑。這在開發靶向可藥物化的PAAN/MIF核酸酶的細胞死亡抑制劑方面提供了啟示和指導作用。
Summary
縱觀整篇文章,作者結合目前常用的實驗技術方法和手段,完成了出色的研究工作。其中體外的互作驗證,采用BLI方法進行的蛋白與小分子結合動力學實驗。基于BLI的Octet®是檢測結合動力學的標準方法學之一,已經被寫入美國藥典。快速準確,結實耐用,成本低~
Octet® 分子互作分析系統

Download
了解更多BLI技術在小分子結合動力學的應用優勢,下載《優化蛋白-蛋白,蛋白-小分子結合動力學分析應用指南》

掃碼下載全文

-參考文獻-
Park et al., PAAN/MIF nuclease inhibition prevents neurodegeneration in Parkinson’s disease, Cell (2022).https://doi.org/10.1016/j.cell.2022.04.020
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





