PART01
CAR結構迭代歷史
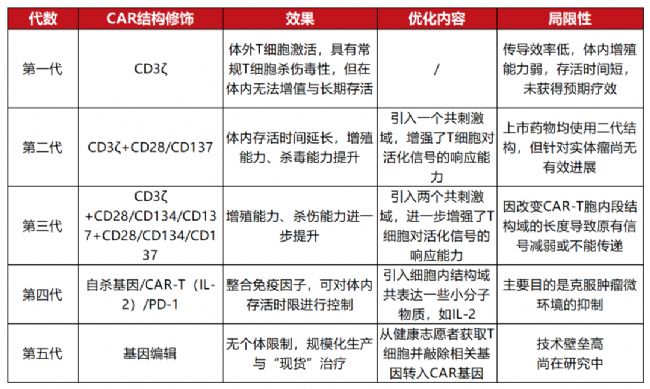
五代CAR結構發展盤點
上圖盤點了CAR結構從出現到優化的發展歷程,其中第四代、第五代CAR結構仍有部分內容存在爭議。目前,CAR的模塊化設計主要包括有四個主要部分,分別是抗原結合域、鉸鏈、跨膜結構域和胞內信號結構域,每一種組件都有其獨特的功能。作為CAR-T細胞療法的“核心”,超越傳統的模式的CAR設計一直是CAR-T細胞治療領域尋求突破的一個重要方向。這對擴展CAR-T細胞更廣泛的應用、提高CAR-T細胞安全性、有效性和適用性都具有重要意義和潛力。
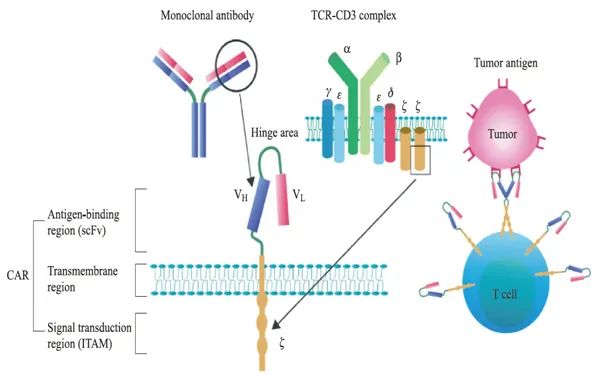
CAR結構示意圖
PART02
新型CAR結構設計
除了對“經典”CAR結構部件的修飾之外,研究還探索了先進的設計策略。這些方法在如何設計T細胞以及如何指示它們響應抗原的功能方面存在著根本差異。
雙CAR
抗原丟失或抗原“低”克隆的出現是CAR-T治療后疾病復發的主要原因。已經確定的抗原逃逸機制包括通過自發突變和雜合性喪失來下調CD19、CD19mRNA的選擇性剪接、譜系轉換或抗原逃逸。因此靶向多種癌癥抗原可能會阻止或減少單一抗原逃逸的快速出現。
目前可以采取多種方法設計靶向兩種抗原的CAR-T細胞產品:聯合用藥,包含兩個分別靶向不同抗原的CAR-T細胞群;雙CAR設計,其中T細胞被設計為表達兩種不同的CAR,其中CAR分子本身包含兩個scFv如下圖所示。
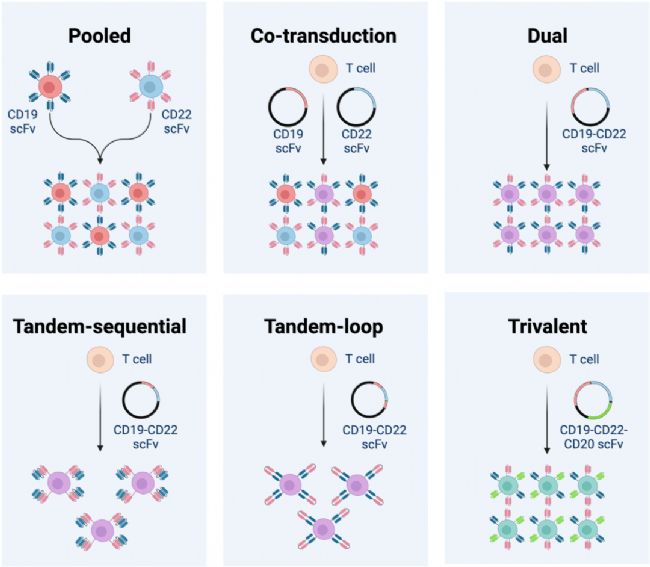
利用CAR-T細胞靶向多種抗原的策略
從廣義上講,與單抗原靶向CAR相比,這些雙CAR靶向策略往往表現出增強的功效,這主要是由于最大限度地減少了單抗原逃逸。雖然臨床研究證明了療效,但與傳統的單一抗原靶向相比,仍難以得出關于這些產品的相對效力結論。
雙CAR產品可以在多個方向進行設計,哪種設計最好可能因目標而異,需要個性化優化。例如,在設計用于CD19和CD22的雙CAR時,研究人員發現將CD22scFv置于膜遠端位置可提高體外對CD22+細胞的抗腫瘤效力,但該CAR的體內活性不足。
除了雙CAR外,有研究還探索了三CAR系統,最突出的例子是靶向CD19、CD20和CD22。該三CAR-T細胞被證明可以殺死所有表達單一抗原的腫瘤系,并且在表達所有抗原時超過標準抗CD19CAR的活性。此外,三CAR-T細胞能夠在體內控制CD19陰性腫瘤。諸如此類的方法對于抗原逃逸是重要障礙的疾病非常有吸引力。
門控CAR
➤ “AND”門
細胞因子釋放綜合征(CRS)和免疫效應細胞相關神經毒性綜合征(ICANS)是CAR治療常見的不良反應,其發生率因產品和疾病相關。除此之外,不良反應還包括可能存在的細胞毒性。因此,調整CAR驅動的T細胞功能以降低上述不良反應是臨床目前的迫切需求。
為了限制毒性,研究人員設計了控制CAR響應抗原激活的方法。其中一種方法是使用“AND”門控CAR。在該設計中,T細胞被設計為表達針對兩種抗原的兩個單獨CAR,類似于上述雙CAR。一個CAR僅包含CD3ζ信號域,另一個包含共刺激域。初級和次級信號事件發生在反式而不是順式,允許T細胞僅通過區分惡性組織和健康組織的獨特抗原呈遞模式而被激活。
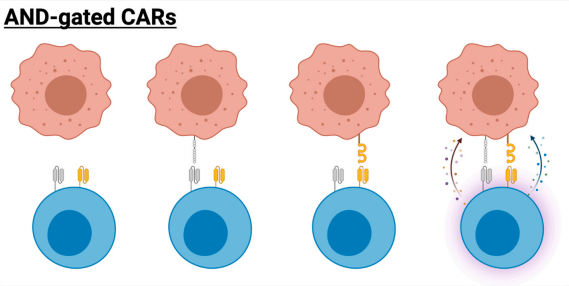
“AND”門控CAR示意圖
嘗試將這種策略應用于表達CD19和前列腺特異性膜抗原(PSMA)的細胞還表明,反式激活對于T細胞功能對抗表達單一抗原的癌癥并不是必不可少的。
另一個研究方向則是將其靶向間皮素(包含CD3ζ)和α葉酸受體(FRα,包含CD28)。這些抗原通常在卵巢癌中共表達,但不在健康組織中表達。研究發現,在體內“AND”CAR比第一代CAR更好地控制了雙陽性腫瘤,并且與第二代CAR順式信號傳導相當。
➤ “NOT”門
與“AND”門控CAR類似,“NOT”門控CAR也試圖限制細胞毒性T細胞的“靶向、非腫瘤”毒性。“NOT”門控電路將傳統的第二代CAR與用于識別健康組織上表達的表面蛋白抑制性受體結合,而不是依賴于通過識別多個不同腫瘤抗原提供多個信號的整合。現有的CAR-T工程策略無法區分破壞性和有效的T細胞功能。“NOT”門控CAR有可能抑制由正常組織驅動的T細胞活性,同時保留針對腫瘤細胞的效應功能。
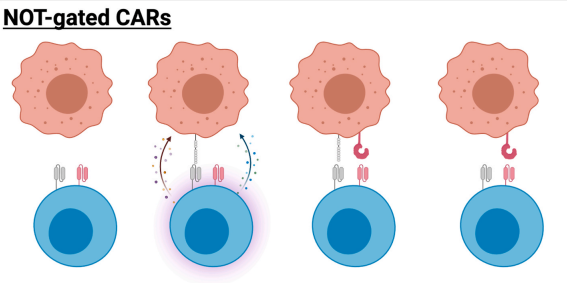
“NOT”門控CAR示意圖
在“NOT”門控CAR的概念驗證報告中,抗PSMA scFv與CTLA-4或PD-1的免疫抑制域融合,并與抗CD19CAR同時表達。在同時表達PSMA和CD19的細胞存在情況下,CTLA-4信號能夠將CD19CAR產生的細胞毒性降低67%,而PD-1信號能夠將毒性降低91%。
重要的是,當這些“NOT”門控CAR-T細胞二次暴露于CD19+單陽性腫瘤時,它們能夠增殖和殺死靶標以及之前未被抑制的細胞。這一發現表明,“NOT”門控CAR活性是可逆的,因此能夠控制不利的細胞毒性作用,但仍保留過繼轉移T細胞的治療潛力。
裝甲CAR
“裝甲CAR”廣泛用于包括將CAR表達與免疫調節蛋白分泌相結合的工程方法。這些方法中研究最充分的是細胞因子分泌,這些細胞因子可以支持T細胞功能或影響腫瘤微環境,也包括檢查點抑制劑和雙特異性T細胞接合物的分泌。
IL-12通常由髓系細胞分泌,用于促進T細胞沿Th1途徑分化。臨床前研究表明,靶向CD19的CAR-T細胞組成型表達IL-12可增強抗白血病功效。使用IL-18和IL-15的類似研究證實了該平臺在增強CAR驅動反應以及吸引非CAR免疫細胞方面的功效。
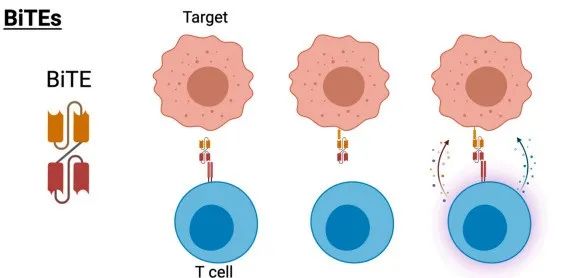
“BiTE”裝甲CAR示意圖
與直接增強T細胞功能相反,使用裝甲CAR也可以逆轉T細胞抑制。免疫“檢查點”是T細胞表面蛋白,能夠抑制T細胞與靶細胞之間的活化相互作用。例子包括CTLA-4和PD-1。最近的一項臨床研究證明了PD-1抑制劑和靶向間皮素CAR-T細胞在間皮瘤患者中的安全性,證實檢查點阻斷與CAR-T細胞的組合是安全的,并且可能具有協同作用。
PART03
小結/SUMMARY REPORT
隨著我們獲得CAR-T產品的臨床經驗,早期評估它們在治療中的應用,探索它們作為造血細胞移植的替代或橋梁治療的潛力,并將它們與其他治療方式相結合,它們在癌癥患者治療、護理中的作用將會日益增長。
目前的CAR產品對實體腫瘤沒有理想的療效,這為新型CAR結構設計創造了機會。蛋白質和基因組工程的進展現在允許對細胞功能進行復雜的操作。調整CAR的基本框架和添加其他調節蛋白,使其具有更精確的功能,無疑代表著免疫細胞工程新時代的開始,這將為更多的癌癥患者提供更持久、更有效的治療
來源:IBI生物創新藥博覽會
* 推文用于傳遞知識,如有版權等疑問,請聯系我們。





