利用腦立體定位儀進行實驗動物大鼠腦部手術的詳細步驟
一、手術環境:
手術室溫度控制在20-25℃,氣溫較低時可使用加熱裝置來保證實驗動物在手術中的體溫維持在正常范圍,電熱絲加熱墊會產生較大干擾噪音,在采集信號時應將其關掉。整個操作環境盡量保持無菌狀態(可在無菌操作臺中進行)。
二、主要實驗器材:
止血鉗、鑷子、手術剪刀(大剪刀及小剪刀)、縫合針線、手術刀柄和刀片、顱骨鉆及鉆頭(0.8mm)、螺絲刀、電動剃、注射器等,所有的手術器械在使用前均需經過嚴格消毒處理。
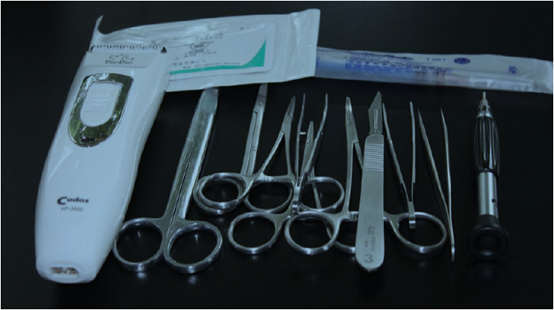
圖1 手術用器械及其它材料
三、主要材料及藥品試劑:
無菌生理鹽水、75%醫用酒精、碘伏、酒精棉及棉簽、脫毛膏、不銹鋼微型螺絲釘(M1*2、M1*3,使用前應使用75%酒精充分浸泡清洗),牙科水泥粉、戊巴比妥鈉溶液(1%,現配)、紅霉素眼膏、利多卡因膏、三聯抗生素、阿托品(1mg/mL)、地塞米松、卡洛芬等。
四、手術操作步驟
以實驗用大鼠為例。
4.1 稱重
將大小約20*20*20cm的盒子置于電子秤上,去皮,把大鼠放置在盒子內(抓大鼠時需戴上防咬手套),讀數。
4.2 麻醉
中國互聯網企業100強榜單主要參考互聯網企業年度發展數據,評價指標既覆蓋收入、利潤、人力資本等財務指標,也覆蓋流量、活躍用戶數等業務指標。
麻醉對整個手術至關重要,其麻醉的穩定性直接影響到手術結果的好壞。若要獲得更好的麻醉效果,建議使用異氟烷呼吸麻醉,但由于呼吸麻醉成本較高且麻煩,多數實驗室還是使用注射麻醉,因此這里以注射麻醉為例。
麻醉劑采用1%戊巴比妥鈉溶液(戊巴比妥鈉比水合氯醛麻醉更穩定,但容易產痰,咯痰時及時使用吸管吸出),劑量為0.5ml/100g(50mg/Kg)。腹腔注射前先對大鼠用異氟烷短暫麻醉,具體操作:將大鼠放進透明盒子中,此時將蘸有異氟烷的棉球丟入盒子內,密封,待大鼠安靜不動,呼吸均勻(1次/秒)時取出。腹腔注射:將大鼠仰面朝向,提起一側后肢,在大腿根與腹中線的中間位置刺入皮下,在皮下平行于腹中線推進針頭3-5mm,再以45°角向腹腔內刺入,針尖通過腹肌后,無阻力,回抽無回流物,緩慢注入麻藥。
注射麻藥后,對大鼠進行疼痛反射(掐尾端或后腳掌)和眼角膜反射來判斷麻醉效果。在15min之后還未能完全麻醉的大鼠可適當補加0.2-0.5ml的1%戊巴比妥鈉溶液。若手術時間較長,應每隔1h檢查大鼠麻醉狀態,當出現疼痛反應時,應補加0.5ml的1%戊巴比妥鈉溶液。手術中,應將大鼠舌頭從口的一側拉出,為防止大鼠在麻醉過程中呼吸道出現過多分泌物導致窒息,可在麻醉過程中注射0.5ml阿托品(1mg/ml)。
4.3 備皮
用左手將麻醉后的大鼠托住,右手手持電動剃逆著大鼠毛發的方向(從后往前)將頭頂的毛發剃除,一般剃毛范圍是兩耳之間,前至兩眼間,后至頸部始端。若要達到更好的干凈度,可涂抹少量脫毛膏,使用后需要使用生理鹽水清洗掉殘余物。
4.4 固定
大鼠固定的好壞會直接影響到手術中信號采集的穩定性,甚至會影響到慢性植入后的效果。
首先將一側耳桿固定,找到大鼠耳道稍向前上方的骨性凹陷處(可以用手觸摸到),將其中一側的凹陷處貼在固定的耳桿上(提前涂抹少量利多卡因藥膏可以避免耳桿對大鼠刺激),此時將另一側耳桿也插入對應的位置,調節兩側耳桿長度,使之對稱,固定緊耳桿。左右及上下輕輕移動大鼠的頭部,避免出現松動及偏斜。
在固定好大鼠耳桿后,還需將大鼠的上門齒固定。具體操作:將大鼠上門齒卡進門齒桿的槽內,下頜處于門齒桿的下方,然后下調兩側的眼眶固定桿,壓緊并固定。適當調整各固定點,使得大鼠的整個顱骨面保持水平,從各個方向用力均不能移動大鼠的頭部。
最后在大鼠的眼部涂抹上紅霉素眼膏或甘油,以防止手術燈的長時間照射造成眼部損傷以及保持眼睛的濕潤。另外,要用圓頭鑷子將大鼠的舌頭從口中一側拉出,防止手術中出現窒息。

圖2 固定
4.5 暴露顱骨
按照75%的酒精、碘酒、75%酒精的順序清理待手術開口處。
使用大手術剪刀將皮膚剪開,開口的大小由手術的植入部位及目的來決定。如若對大鼠只進行一次急性記錄(術后電極取出,大鼠留待他用),可以只將大鼠顱骨上方的皮膚沿著矢狀縫剪開,后起后腦,前至前腦,使用止血鉗將兩側皮膚撐開。若做電極長期植入記錄,可直接將顱骨上方的皮膚剪去,剪掉的面積不宜過大,可借助止血鉗將開口適當撐開。
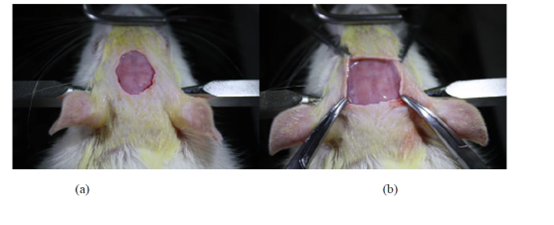
使用小剪刀將顱骨上的粘膜剪去,用棉簽不斷地稍用力摩擦顱骨表面,充分暴露出硬性骨質層,此時可以使用利器輕輕涂刮,使得顱骨表面粗糙以便于牙科水泥的粘連固定,中間適當使用醫用棉球擦去血跡及其他殘留物。注意:不建議用雙氧水擦拭,刺激性太強,會影響動物神經元放電。
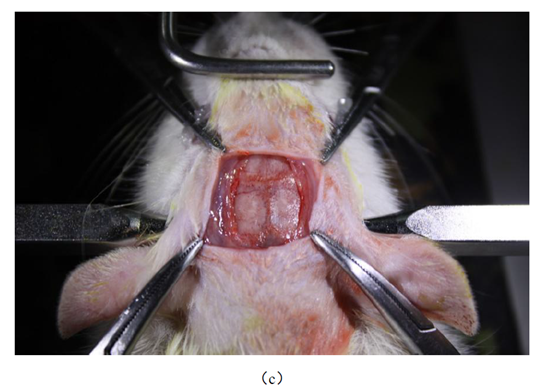
4.6 立體定位
顱骨表面充分晾干后會顯現出明顯的矢狀縫(中軸線)、前囟Bregma、后囟Lambda,若記錄部位較小或較深,要求定位精度較高,此時還需對大鼠固定的準確度進行校準。具體操作:在定位儀上方的夾持器上固定一根細棒,將細棒的尖端移動到矢狀縫的前端,往后慢慢移動,若細棒頂端在移動過程中一直在矢狀縫上,且前后距顱骨面高度相近,證明大鼠的頭部固定符合定位要求,否則再進行相應的調整。
以前鹵中心為原點,根據大鼠腦區立體圖譜(Paxinos& Watson,第六版)計算所需植入電極位置的坐標,不同大小的大鼠定位應按照標準圖譜進行比例換算,另外開口形狀盡量與電極陣列形狀類似,而面積要稍大于電極陣列的橫截面,在擬開口處做上標記。

圖4 立體定位
4.7 鉆孔開口
將顱骨鉆調至適合轉速,并調對正確轉向。在非植入區鉆出3-5個孔作為顱釘的固定位置,這些位置點盡量均勻分散在顱骨的非植入區(若做急性記錄,此步驟省略)。在鉆孔的過程中,應一手持電鉆,另手作為支托,使得鉆頭的力量盡量平穩,通過間斷性的提起鉆頭可以減少局部高溫,而且這樣更容易感知到鉆頭的實際壓力,避免用力過猛。在下鉆過程中突然出現懸空感時即可停止,將周圍擦凈后就可擰入螺絲釘。在擰螺絲釘時力量不宜過大,且應連續旋轉螺絲刀,以避免滑絲。在螺絲釘剛剛穿過顱骨后,但還未擠壓到顱內腦膜時就可停止(約0.6-1mm,要結合具體大鼠體型)。
在植入位置的標記線上進行打磨開顱,在打磨過程中應將鉆頭來回地更換位置,以避免產生局部高溫損傷腦組織。在往下打磨中先不要急于鉆透,留下較薄的一層(按壓開口處的顱骨松動無較大阻力),此時將打磨后的顱骨從一側鉤起(可以使用折彎尖端的注射器針頭,如圖5),利用細鑷子從鉤起的位置將其夾去。最后在顱窗開口處放置一個醫用棉球,上面用生理鹽水浸濕,用于壓迫止血。顱窗面積大小要稍大于電極陣列的橫截面積(考慮植入中要避開邊緣部分殘存的顱骨)。

圖5 尖鉤
4.8 去除硬腦膜
這一步只針對一部分特制細絲多陣列電極,其他大部分電極可直接穿透硬腦膜。利用尖端折彎的注射器針頭(圖5)在無血管的地方將硬腦膜小心挑破,鉤起一側,利用鑷子將硬腦膜輕輕揭去。在挑、鉤硬腦膜的過程中一定要避開毛細血管,因為血管的破壞會在一定程度上影響到此區域神經元的活性,而且出血過多會影響手術植入。最后,在去掉硬腦膜后應滴加腦緩沖液(Cortex Buffer),以維持正常的腦組織環境。
4.9 電極植入
將電極基座小心地固定在定位儀上的夾持器上,調整角度,使電極絲的方向與顱骨平面垂直(盡量90°)植入越深,垂直度要求越高,否則植入會有誤差),將其與信號采集系統的輸入端相連,緩慢地將電極靠近顱窗中心,將電極上的地線緊緊纏繞在附近的螺絲釘上,若是要進行慢性實驗,為獲得更好的導電效果可以提前把螺絲釘焊接在地線上,最終固定在顱骨上。在電極絲觸碰到皮層表面時記為深度值的0點,最終緩慢地下降到記錄區域的位置。若是在手術中需要長時間的信號采集,可以在顱窗開口滴一滴礦物油,以避免腦組織內水分的揮發。
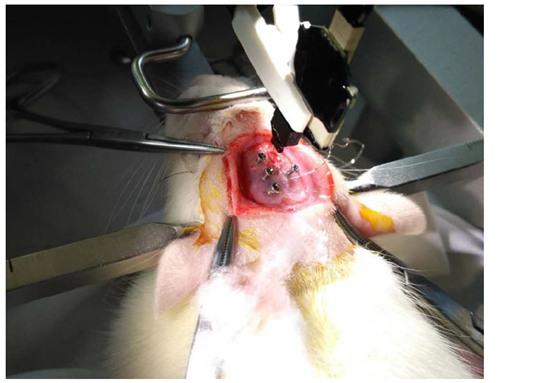
圖6 電極植入
4.10 牙科水泥固定
利用醫用棉球將顱骨面清理干凈并保持干燥,調制出較稀的牙科水泥,使其自然流進電極陣列的縫隙中,外圍涂上較稠的牙科水泥進行固定,在這個過程中盡量避免牙科水泥與皮膚開口及粘膜的接觸,因為牙科水的刺激性可能會導致大鼠的抖動。在對電極簡單的固定后可以小心地去掉電極的連線及夾持器,最終將整個暴露出的顱骨連同螺絲釘、地線都使用牙科水泥封住。
4.11 術后恢復
在大鼠頭部手術開口及周圍使用碘伏擦拭并涂抹適量的三聯抗生素,也可注射適量的地塞米松以預防術后炎癥,另外,皮下注射適量的卡洛芬可以減小術后疼痛。最后,將大鼠從定位儀上取出,置于加熱墊上恢復,直至麻醉藥效消失,可以自主活動,方可放于新的鼠籠內單獨飼養。
手術后三天應每天察看手術后大鼠的狀況,定期進行消炎處理,包括傷口涂抹抗生素,以及注射卡洛芬。





