文獻解讀:星形膠質細胞提供成癮復發找不到解決辦法新思路
帶你看文獻,只做純干貨
文獻精讀第33期
文章概述
成癮復發是a片類藥物導致死亡的主要原因。已有的研究表明,伏隔核(Nucleus Accumbens core, NAcore)中突觸谷氨酸失調是成癮行為復發的一個關鍵因素。在動物成癮模型中,谷氨酸失調在很大程度上是由于表達谷氨酸轉運體GLT-1的NAcore星形膠質細胞發生了變化,包括星形膠質細胞的突起從神經元突觸上縮回以及星形膠質細胞GLT-1的表達下調,但是它們在成癮復發中的作用和機制仍然有待進一步明確。
2022年8月10日,南卡羅萊納醫科大學的研究人員在《Science Advances》雜志上發表題為“Plasticity in astrocyte subpopulations regulates heroin relapse”的文章。該研究揭示了大鼠NAcore中表達GLT-1的星形膠質細胞是如何適應并促進hailuoyin尋求的。hailuoyin線索會導致NAcore中不同的星形膠質細胞亞群產生兩種短暫的可塑性:一個亞群的細胞突起與神經元突觸的鄰接性增加,另一個亞群中星形膠質細胞的GLT-1在神經元突觸外表達增加。抑制星形膠質細胞上述兩種可塑性會促進線索誘導的hailuoyin尋求。該研究結果表明,hailuoyin線索會通過短暫誘導星形膠質細胞亞群不同形式的可塑性來抑制hailuoyin的復吸,這也為藥物成癮復發的治療提供了一種有前景的途徑。

核心觀點
1、hailuoyin線索會在不同的星形膠質亞群中產生兩種短暫的可塑性:其中一個亞群的細胞突起與鄰近神經元突觸的鄰接性增加;而在另一個亞群中,星形膠質細胞GLT-1的表達在鄰近神經元的突觸外顯著增加;
2、通過反義核酸靶向抑制上述星型膠質細胞亞群的兩種短暫可塑性會促進線索誘導的hailuoyin尋求;
3、hailuoyin線索會選擇性地增加星形膠質細胞的突起與D2中型多棘神經元(Medium Spiny Neurons, MSNs)樹突突觸的鄰接性,而星形膠質細胞GLT-1在神經元突觸外的表達增加則無神經元亞型特異性。
研究結果分析
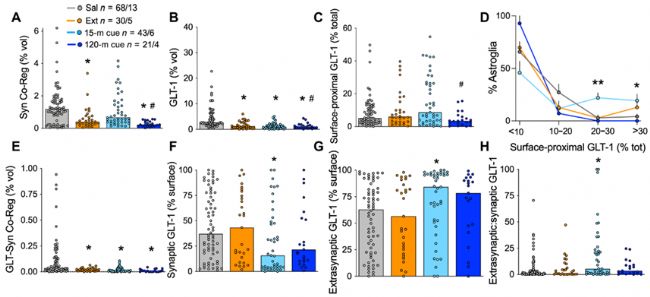
1. hailuoyin線索導致星形膠質細胞表面近端GLT-1的表達短暫升高
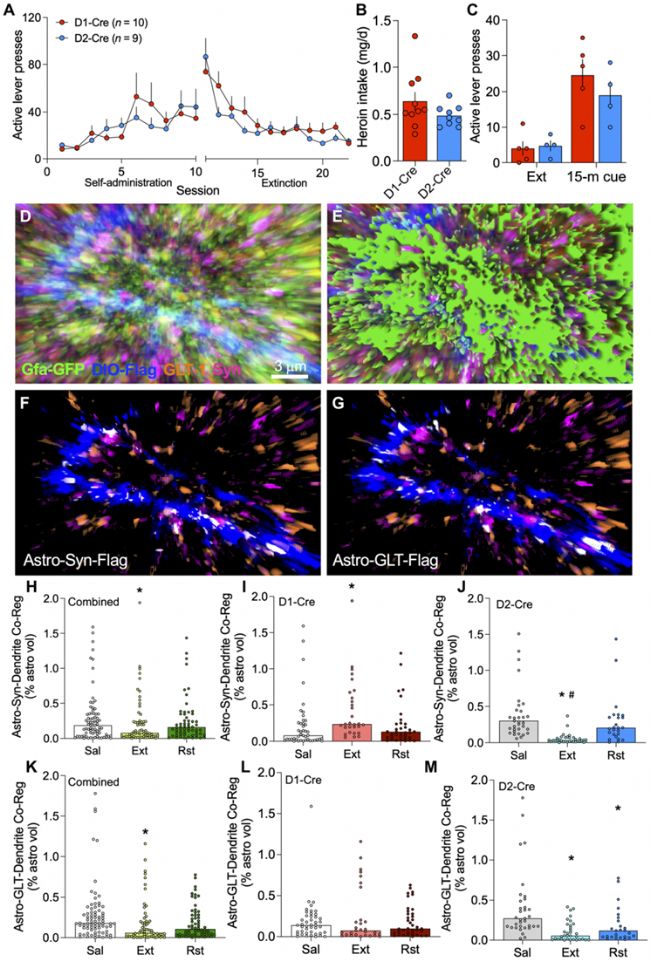
為了探討NAcore星形膠質細胞在hailuoyin尋求中的變化機制,作者利用操作性學習的自身給藥范式來模擬動物成癮-戒斷-復發行為,并利用膜結合的熒光報告基因對NAcore星形膠質細胞進行了標記。大鼠在訓練后接受10天的自身給藥(hailuoyin或蔗糖)、10天的戒斷、以及部分小鼠接受隨后的線索誘導hailuoyin尋求(不給予實際的hailuoyin或蔗糖獎勵,其中線索誘導15分鐘作為藥物渴望或尋求的結果,線索暴露120分鐘作為線索戒斷的結果)。在對大鼠NAcore切片突觸前的Synapsin I 和GLT-1進行免疫標記后,利用共聚焦顯微鏡進行成像。

免疫組化結果顯示,在hailuoyin戒斷后,星形膠質細胞質膜與Synapsin I的共定位減少,GLT-1的總表達減少,但是GLT-1在星形膠質細胞表面的比例沒有改變。在戒斷之后,15分鐘的線索誘導增加了hailuoyin組大鼠星形膠質細胞與突觸的接觸,以及表面近端(表面250nm內)GLT-1表達高水平星形膠質細胞的比例。這種突觸近端星形膠質細胞突起和GLT-1表面水平的增加都是短暫的,在120分鐘的線索暴露后會恢復到戒斷水平,這一時間過程與成癮復發期間細胞外谷氨酸的上升和下降相平行。hailuoyin戒斷導致了GLT-1與Synapsin I的共定位減少。盡管hailuoyin尋求會導致星形膠質細胞表面近端GLT-1的增加,但是并不能恢復階段后GLT-1與Synapsin I的共定位,相反,線索誘導的表面近端GLT-1的增加都是在突觸之外的。
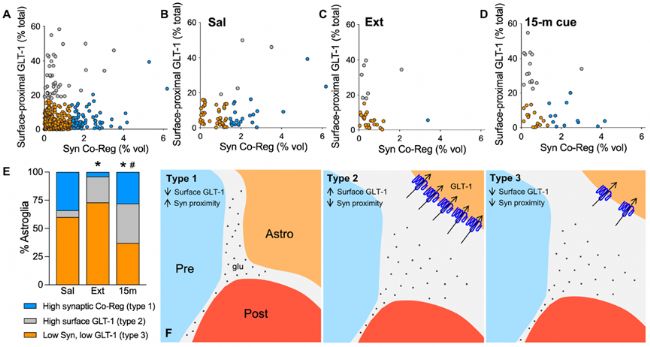
2. hailuoyin線索誘導的星形膠質細胞可塑性表現出細胞亞群異質性
hailuoyin線索誘導15分鐘后,星形膠質細胞與突觸的鄰近性短暫增加,但表面近端GLT-1的表達增加沒有與Synapsin I共定位,這表明這些線索誘導的星形膠質細胞可塑性可能發生在不同的星形膠質細胞亞群中。利用主成分分析,根據星形膠質細胞與突觸的鄰接性和表面近端GLT-1的水平,作者將NAcore中的星形膠質細胞分成了高突觸鄰接性(1型)、表面近端GLT-1高水平(2型)、以及低至中度突觸鄰接和表面GLT-1表達(3型)三個亞群。生理鹽水組大鼠的大部分NAcore星形膠質細胞主要為1型和3型。hailuoyin戒斷大鼠中1型星形膠質細胞減少,2型星形膠質細胞增加。15分鐘的hailuoyin線索誘導導致1型星形膠質細胞短暫恢復,2型星形膠質細胞質比例進一步增加。120分鐘的hailuoyin線索暴露后,3型星形膠質細胞占主導地位。
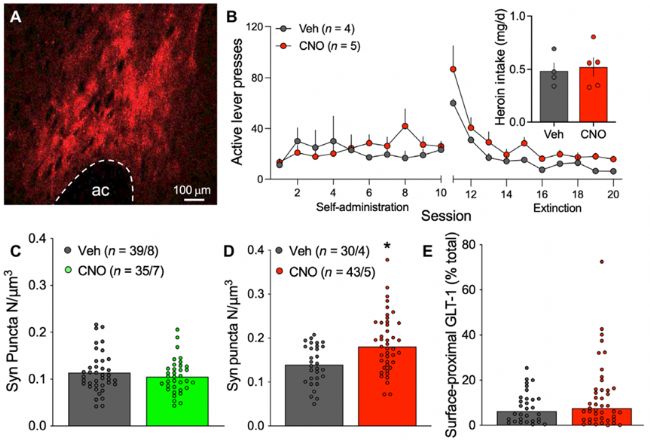
3. 在NAcore星形膠質細胞中,Gq信號增加了細胞突起與突觸的鄰接性,但不增加細胞表面GLT-1的水平
培養的星形膠質細胞上,Gq偶聯信號通過代謝性谷氨酸受體mGluR5促進ezrin依賴的星形膠質細胞突起精細的運動。為了確定Gq型mGluR信號是否會觸發線索誘導的星形膠質細胞突起運動,作者在線索誘導時利用化學遺傳學的方法激活NAcore星形膠質細胞,并對星形膠質細胞的突觸鄰接性和表面近端GLT-1的表達進行了分析。星形膠質細胞激活增加了星形膠質細胞突起與Synapsin I的共定位,但不影響表面近端GLT-1水平。這些數據表明,在藥物尋求過程中,Gq信號在NAcore星形膠質細胞中能夠觸發形態可塑性,而突觸外GLT-1表達的增加可能涉及不同的信號級聯。
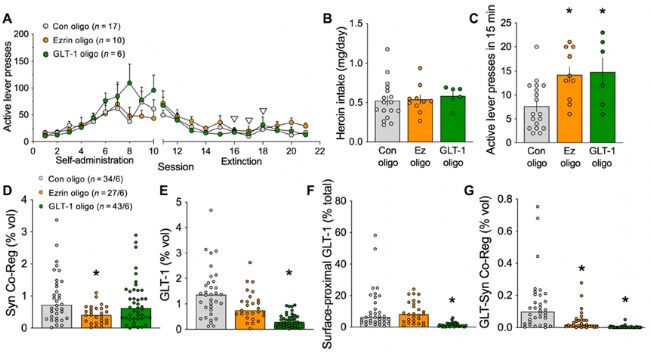
4.在星形膠質細胞亞群中,線索誘導的可塑性降低會增加hailuoyin尋求
為了確定線索誘導的1型和2型星形膠質細胞塑性是否影響hailuoyin尋求,作者在動物戒斷后利用反義核酸特異性的阻斷GLT-1或ezrin。hailuoyin線索誘導15分鐘后,大鼠的hailuoyin尋求恢復,ezrin或GLT-1基因的下調增強了動物對hailuoyin的渴求。因此,1型或2型星形膠質細胞可塑性在線索誘導的hailuoyin尋求過程中起著抑制hailuoyin渴求的代償作用。形態學結果表明,ezrin敲除降低了NAcore星形膠質細胞的突觸鄰接性,而GLT-1敲除進一步降低了GLT-1的總水平,并阻斷了線索誘導的表面近端GLT-1的表達增加。此外,GLT-1敲除不改變NAcore星形膠質細胞的突觸鄰近性,ezrin敲除不影響GLT-1總水平或表面近端GLT-1水平。正如預期的那樣,GLT-1或ezrin的獨立敲除降低了GLT-1與Synapsin I的共定位。
5. 在hailuoyin成癮及復發前后,NAcore星形膠質細胞與D1-MSNs和D2-MSNs形成有差異的關聯
NAcore中兩個主要的神經元亞型D1-MSNs和D2-MSNs的活性分別驅動藥物尋求和尋求消退。因此,作者推測NAcore中不同類型的星形膠質細胞與D1-MSNs和D2-MSNs獨特相關,從而有助于它們在減少線索誘導的hailuoyin尋求方面的功能作用。為了驗證這一假設,作者在動物訓練前對D1和D2神經元進行了標記,在一系列的成癮-戒斷-復發實驗后對孤立的星形膠質細胞進行成像,并定量觀察其與病毒標記的D1-MSNs和D2-MSNs樹突以及突觸標記的Synapsin I或GLT-1的關系。免疫組化結果顯示,星形膠質細胞在戒斷后從NAcore樹突上縮回,在線索誘導后星形膠質細胞突起重新向突觸插入。在戒斷訓練后,星形膠質細胞在D1-MSNs突觸中與Synapsin I的共定位增加,在D2-MSNs突觸中與Synapsin I的共定位減少。暴露于hailuoyin線索15分鐘后,星形膠質細胞與兩種突觸的關聯恢復到對照水平。
在分析D1-MSNs和D2-MSNs樹突相關GLT-1時,作者觀察到樹突相關的GLT-1在戒斷訓練后減少,在暴露于hailuoyin線索15分鐘后恢復到生理鹽水對照水平,類似于大鼠在線索誘導的hailuoyin尋找15分鐘內表面近端GLT-1的增加。與D1樹突相比,與D2樹突相鄰的GLT-1水平更高。戒斷后樹突相關的GLT-1減少發生在D2樹突,而不是D1樹突。線索暴露15分鐘后,GLT-1的表面近端增加與D1或D2樹突沒有相關。
總之,這些數據表明,線索誘導的hailuoyin尋求過程中1型星形膠質細胞的增加可能與D2樹突周圍星形膠質細胞的形態可塑性有關,但線索誘導的2型星形膠質細胞增加,表現出高水平的突觸外GLT-1,而與D1或D2樹突無關。
總結
該研究發現,在線索誘導的hailuoyin尋求過程中,NAcore中的星形膠質細胞通過形態和GLT-1表達的可塑性這兩種機制來抑制hailuoyin尋求的強度。線索誘導的星形膠質細胞突起與突觸的鄰近性和表面GLT-1表達增加發生在不同的星形膠質細胞亞群中,并由不同的信號級聯觸發,星形膠質細胞Gq信號選擇性激活星形膠質細胞精細過程運動,而不影響表面GLT-1表達。1型星形膠質細胞在NAcore中與突觸鄰接性增加,而2型星形膠質細胞表面GLT-1表達增加。選擇性地抑制1型或2型星形膠質細胞的可塑性可增強線索誘導的hailuoyin尋求,顯示了線索短暫誘導這些星形膠質細胞亞群的功能相關性。最后,作者證明了在hailuoyin尋求過程中,1型星形膠質細胞的增加具有D2-MSNs選擇性,但2型星形膠質細胞的增加,與D1-MSNs和D2-MSNs均無關。總之,這些數據表明,星形膠質細胞的形態可塑性具有神經元亞型選擇性,在不同的星形膠質細胞亞群中,hailuoyin線索會短暫地誘導兩種不同形式的星形膠質細胞可塑性,從而抑制hailuoyin的尋求。
研究方法亮點
這項工作闡述了NAcore中表達的星形膠質細胞在適應并促進hailuoyin尋求過程中的作用機制。研究用到了自身給藥成癮造模、腦立體定位注射、微量導管給藥以及免疫組化等實驗技術。瑞沃德深耕生命科學研究領域20年,一直致力于為客戶提供可信賴的解決方案和服務,能夠提供該研究所涉及的自身給藥成癮造模、腦立體定位注射、微量導管給藥以及免疫組化等實驗的完整解決方案。截至目前,瑞沃德產品及服務覆蓋海內外 100 多個國家和地區,客戶涵蓋全球700+醫院,1000+科研院所,6000+高等院校,已助力全球科研人員發表SCI文章14500+,獲得行業廣泛認可。
原文鏈接:
https://www.science.org/doi/10.1126/sciadv.abo7044





