哺乳細胞表達:CHO及HEK293優勢及應用
現有的新型生物醫藥產品中,有相當多數量的生物制劑是通過重組細胞表達產生的,其中大部分蛋白質,均產生于哺乳動物表達平臺。由哺乳動物細胞產生的外源蛋白在活性方面遠勝于原核細胞表達系統,因此哺乳動物細胞作為宿主,被廣泛應用于生物制藥的工業化生產中。近年來除了生物制劑的生產系統已大幅度轉向哺乳動物細胞表達系統外,越來越多科學家把關注點轉移到哺乳動物細胞翻譯后修飾與生物制劑的活性,并針對其關聯性展開了大量的研究工作。
哺乳細胞表達分類
01
根據國際人用藥品注冊技術協調會(International Council for Harmonization, ICH)Q5D《用于生物技術產品及生物制品生產的細胞基質的來源和鑒定》中要求“對于重組產品,細胞系是指克隆自一個祖細胞且含有所需序列的轉染細胞”[1]。
哺乳動物細胞是表達人類基因的系統,其優點是能夠促進蛋白質正確折疊,提供準確的糖基化、乙酰化等多種翻譯后修飾。它能通過構建信號肽使成熟的蛋白分泌到胞外,利用親和純化的方式,比較輕松地獲得高活性的蛋白[2]。基于哺乳動物細胞表達系統制備的重組蛋白,其高級結構、翻譯后修飾、理化性質、生物化學活性更接近天然的高等生物蛋白質分子,被大量用于治療性重組蛋白的生產。根據目的蛋白表達的時空差異,可將哺乳動物細胞表達系統分為瞬時、穩定和誘導表達系統[3]。
●瞬時表達系統
宿主細胞在導入表達載體后不經選擇培養,載體DNA隨細胞分裂而逐漸丟失,目的蛋白的表達時間較短。相對于穩定表達系統,瞬時表達系統無需將外源基因整合到基因組上,避免了外源基因整合過程中位置效應的影響。
優點:表達周期短,表達量高等。
缺點:技術條件要求高,如質粒的純度、轉染的效率等。
●穩定表達系統
載體導入宿主細胞后,目的基因整合到細胞基因組上,不會隨著細胞傳代而消失,能夠長期穩定的生產目的蛋白。
優點:目的蛋白表達持久、穩定。
缺點:由于需要抗性選擇甚至加壓擴增等步驟,穩定表達相對耗時耗力。
●誘導表達系統
目的基因的轉錄受外源小分子的誘導,可在特定的時間或特定的組織、細胞類型內表達,經誘導后目的基因的表達可大大提高。目前,基于四環素或多西環素的調節系統以及雌激素受體他莫昔芬系統應用較為廣泛。參與誘導調控的因子與細胞內源性的因子間無相互作用,因此一方面目的基因的表達本身不受細胞內環境改變的影響,另一方面誘導藥物對內源基因的表達無作用,因而具有很好的嚴謹性和特異性。
基于哺乳細胞表達的細胞特點
02
由于哺乳動物細胞表達的細胞需要穩定持續生長,并且能夠通過外源基因導入以實現目的基因的表達,需要動物組織通過層層篩選、培養優化獲得。常用的細胞系包括HEK293(人胚腎細胞)和CHO(中國倉鼠卵巢細胞)這兩種細胞;均采用懸浮細胞培養,可以在一個月內產生數克級蛋白[4]。
然而哺乳動物表達系統也存在著一定的劣勢,比如實驗成本高、表達周期長、技術難度高等。哺乳動物細胞表達重組蛋白的最大問題是轉染效率不高及所表達的蛋白質水平較低。但隨著如今科研水平的進步,HEK293細胞及CHO細胞已被分別開發為有效的瞬時和穩定表達系統。
以脂質體、磷酸鈣或PEI作為轉染試劑進行瞬時轉染,HEK293細胞被廣泛用于生產蛋白、疫苗、抗癌試劑及重組腺病毒包被等。HEK293瞬時表達相對簡單和容易,但擴大規模卻在技術上充滿挑戰,而CHO細胞通常用于穩定制備大量重組蛋白。
|
表達方式 |
細胞 |
|
瞬時表達 |
HEK293細胞,源于293細胞系,采用無血清懸浮培養; CHO-S細胞,源于中國倉鼠卵巢細胞的克隆分離株,被馴化為無血清懸浮培養。 |
|
穩定表達 |
CHO-S、CHO-K1由CHO衍生而來,該細胞株培養條件簡單、貼壁強度適中,比較容易轉染。 |
HEK293細胞和CHO細胞是在真核蛋白表達系統中最常用的細胞,具有以下特點:
①具有準確的翻譯后修飾功能,表達蛋白在任何方面都最接近天然狀態;
②具有重組基因的高效擴增和表達能力;
③具有較高的耐受剪切力和滲透壓能力,表達水平較高;
④CHO屬于成纖維細胞,是一種非分泌細胞,自身很少分泌內源蛋白,有利于目的蛋白的分離純化;
⑤HEK293細胞具有更高的生長密度和更快的生長速度優勢,易培養,易轉染。
HEK293作為一款全能細胞,在病毒生產和重組蛋白生產中有著舉足輕重的地位。但現階段科研實驗中,最常用的生物藥學蛋白制備宿主卻是CHO。在所有哺乳動物細胞表達系統中目前有70%的重組蛋白生物制劑源自于CHO,小鼠骨髓淋巴瘤細胞(NS0和Sp2/0)已獲批用于西妥昔單抗(cetuximab)和帕利珠單抗(palivizumab)等抗體的商業化生產,人胚腎細胞HEK293已獲批用于凝血因子Fc融合蛋白商業化生產[5]。
CHO如此受歡迎,原因是其擁有極高的生產力(批量培養0.1-1g/L,分批培養1-10g/L),并且表現出持續良好的生長表型,適合大規模工業化培養,容易適應各種化學成分限定的培養基,不易被人類病毒感染,能夠進行人類兼容的糖基化等諸多優點。
統計數據顯示,近十年中有超過一百多種市場價值預計達1400億美元的生物制藥產品在美國和歐盟獲得批準并銷售。這些獲批銷售的產品有很大一部分是重組蛋白,其中使用哺乳動物表達平臺的比例在不斷增加。2016-2020年,有超過 80% 在美國和歐洲市場獲批的重組蛋白生物藥物是通過培養的哺乳動物細胞生產的。2018 年十大暢銷藥物(包括傳統藥物和生物藥)中有8種是在培養的哺乳動物細胞中生產的重組蛋白。
真核哺乳細胞應用
03
CHO細胞:基于哺乳動物細胞的早期生物藥
1987 年中國倉鼠卵巢 (CHO) 細胞源性的組織纖溶酶原激活劑 (Activase®) 獲批用于治療心肌梗塞,開啟了利用哺乳動物細胞表達系統生產生物藥的時代。在過去的幾十年里,用于生產生物藥的哺乳動物細胞表達系統中,CHO 細胞已成為生物制藥行業的主力。從 1987 年到2021年2月,通過培養的哺乳動物細胞生產的獲批生物藥中有 81% 是使用CHO細胞生產。
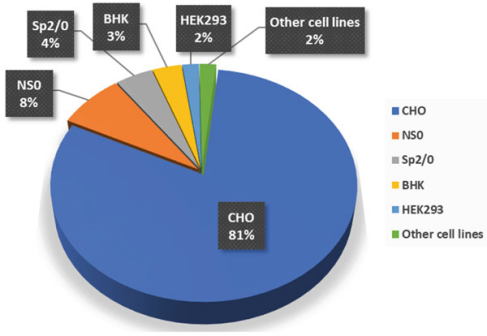
1987年至2021年2月用于生物藥商業規模生產的哺乳動物細胞系類型百分比。
抗體相關生物藥
1987年至2021年期間,歐盟和美國共批準了超過 207 種哺乳動物細胞源性生物藥[6]。在這類獲批的哺乳動物細胞源性生物藥中,單克隆抗體已成為生物制藥市場的重要推動力,成為增長最快的創新點和收入來源。已獲批準的四種主要抗體類型是鼠抗體、嵌合抗體、人源化抗體和完全人源抗體。
由培養的哺乳動物細胞生產的生物藥包括激素、酶、細胞因子、凝血因子、Fc融合蛋白和抗體。從1987年到2021年2月批準的大多數基于哺乳動物細胞的生物藥是抗體,在生物制藥市場中約占58%。其中,嵌合、人源化和全人源單克隆抗體三大類構成了約98%的抗體產品。

HEK293細胞:重組治療性蛋白和疫苗的生產
Drotrec-ogin alfa (Xigris®)是第一個基于HEK293細胞系生產的重組治療性蛋白質,并在2001年獲得批準,2002年被FDA和EMA批準用于治療膿毒癥患者。隨后,美國和歐盟批準了4種基于HEK293細胞生產的藥物,包括Efmoroctocog alfa (Eloctate®)、Human-cl rhFVIII (Nuwiq®)、 Eftrnonacog alfa (Alprolix®)、Dulaglutide (TrulicityTM)。
HEK293細胞還被用于制造腺病毒疫苗,用于基因治療、預防接種和癌癥治療。作為首個基因治療藥物,Recombinant human AdV-p53 (Gendicine)于2003年獲得CFDA批準,用于聯合化療治療頭頸部鱗狀細胞癌患者。此外,2010年完成了在HEK293細胞中生產的MRKAd5HIV-1gag/pol/nef疫苗(ClinicalTrials.gov,NCT00849680)和VRC-HIVADV014-00-VP疫苗(ClinicalTrials.gov,NCT00119873)的臨床試驗。
基因工程重組蛋白藥物是新藥開發的重要發展方向之一,如今重組蛋白藥物雖然僅占全球處方藥市場的7%-8%,但其發展速度不可小覷。1989年重組蛋白藥物的銷售額為47億美元,到2005年達到410億美元,幾乎是1989年的9倍。其中排名前10位的藥物占銷售額的60%以上,血液病、腫瘤、中樞神經系統疾病及感染疾病(如艾滋病等)藥物占據重組蛋白藥物市場絕大部分份額。
十九世紀八十年代中期,自從重組哺乳動物細胞系第一次被報道,細胞系的構建得到了快速的發展。未來科研人員對重組蛋白生產的研究,有望在重組蛋白藥物開發方面取得快速進展,使得我們獲得更可行、更高效的重組蛋白類生物藥物。雖然重組蛋白藥物生產條件嚴苛,服用流程復雜且價格昂貴,但對于某些疾病卻有著不可替代的治療作用。未來中國生物制藥領域仍將以重組蛋白為主流,這與世界生物制藥領域的發展趨勢吻合,相信哺乳動物細胞將在重組蛋白藥物研制過程中發揮更重要的作用。
同立海源生物具備十余年中試工藝生產經驗,擁有哺乳動物細胞表達蛋白質工程平臺,公司生產的真核重組蛋白產品具有翻譯后修飾功能,更好的維持了天然蛋白構相、活性更高、效果更好、穩定性強,同時滿足客戶個性化定制服務需求。制藥級生產車間及藥用包材,保障了產品高性能和高穩定性,支持細胞藥物臨床申報,助力生物制品制造。

參考文獻:
[1] International Council for Harmonisation. Q5D: derivation and characterisation of cell substrates used for production of biotechnological/biological products [EB/OL]. Switzerland: ICH, 1997 [2018-12-31].https://www.ich.org/page/quality-guidelines.
[2] Gray D. Overview of protein expression by mammalian cells. Curr Protoc Protein Sci. 2001 May;Chapter 5(1):Unit5.9. doi: 10.1002/0471140864.ps0509s10. PMID: 18429190; PMCID: PMC7162368.
[3] Hacker DL, Balasubramanian S. Recombinant protein production from stable mammalian cell lines and pools. Curr Opin Struct Biol. 2016 Jun;38:129-36. doi: 10.1016/j.sbi.2016.06.005. Epub 2016 Jun 17. PMID: 27322762.
[4] Tihanyi B, Nyitray L. Recent advances in CHO cell line development for recombinant protein production. Drug Discov Today Technol. 2020 Dec;38:25-34. doi: 10.1016/j.ddtec.2021.02.003. Epub 2021 Apr 12. PMID: 34895638.
[5] Hu J, Han J, Li H, et al. Human Embryonic Kidney 293 Cells: A Vehicle for Biopharmaceutical Manufacturing, Structural Biology, and Electrophysiology. Cells Tissues Organs. 2018;205(1):1-8. doi: 10.1159/000485501. Epub 2018 Feb 1. PMID: 29393161.
[6] R.Al-Majmaie, D.Kuyestermans, M.Al-Rubeai, Biopharmaceuticals Produced from Cultivated Mammalian Cells. Cell Culture Engineering and Technology, Cell Engineering 10, 2021.





