Science:組織幾何學決定器官培養中乳腺的分支形態發生位點
包括乳腺在內的許多器官的樹狀結構是通過分支形態發生(branching morphogenesis)過程形成的。分支形態發生是一個原有上皮細胞發生分支并侵入的重復過程。為探究是什么因素決定著分支形態發生起始的位點,美國勞倫斯伯克利國家實驗室的研究人員Celeste M. Nelson等通過凝膠鑄模的方法,使用小鼠乳腺上皮(EpH4)細胞構建了可控制初始幾何形態的乳腺上皮小管3D模型,并結合算法對分支情況進行量化,發現小管的幾何形態能夠決定分支起始的位置。研究進一步證實了分支起始于自分泌型抑制形態發生子,如轉化生長因子β(transforming growthfactor–β, TGFβ)局部濃度最小的部位。而組織的幾何形態又能夠影響局部細胞微環境,從而控制形態發生。該成果以“Tissue GeometryDetermines Sites of Mammary Branching Morphogenesis in Organotypic Cultures”為題發表于Science雜志。
研究背景
乳腺上皮小管雛形在個體出生時就已存在,但在青春期會突然出現分叉和側向分支,由此從乳腺上皮小管雛形轉變為成年雌性發育完全的乳腺導管樹。該過程中的分支形態發生受到許多因素的調節,包括生長因子(growth factors)、細胞外基質分子(extracellular matrix)、蛋白酶(proteases)和形態發生子(morphogens)。這些因子必須在發生分支的組織中整合并綜合作用,以確定分支起始的位置,確定一組上皮細胞是否要形成分支或分叉。目前在肺、腎和唾液腺等許多器官中針對這一過程的研究,已經有很多技術方法,但關于分支起始的空間位置是如何決定的,目前還無法進行精確的量化分析。考慮到乳腺導管網絡是從已有的上皮小管分支出來,研究人員假設上皮小管內細胞的位置可能對起始分支位點有一定的決定作用,并對此進行實驗。結果發現組織的形態和環境,包括多細胞小管的幾何形狀,以及它們與臨近小管的接近程度,都能影響分支發生的位置。
結果與討論
研究人員開發了一種三維(3D)微模型,即將功能正常的小鼠乳腺上皮(EpH4)細胞包埋在特定形狀的膠原凝膠空腔中,構建出特定幾何形態的乳腺上皮小管,進而通過控制小管的初始幾何形態來模擬乳腺雛形,并量化它們發生分支的位置。上述膠原凝膠空腔是使用未聚合的膠原I(collagen I)和彈性“印章”(stamp)鑄模產生的(圖1A)。包埋于凝膠空腔中的上皮細胞能夠貼合空腔大小和形狀形成中空小管(圖1,B和C)。為量化分支情況并從統計學上表示出大小和位置,研究人員對細胞核進行染色,并將多個熒光圖像堆疊以顯示出小管內和從小管分支的細胞的平均空間分布(圖1D),并將圖像圖像堆疊制成分布頻率圖(圖1E)。構建的小管模型形成正確極化的雙層小管,即由肌上皮細胞和基底膜包圍著一層內腔上皮細胞(圖1H)。
添加表皮生長因子(epidermal growth factor, EGF)(圖1F)小管進行分支形態發生。誘導后24小時內,發現有多細胞分支延伸到周圍的膠原基質中,且這些分支只從小管末端開始,并不從側面開始(圖1,F和G)。這一模式與體內乳腺頂芽的二分支類似。
細胞必須發生變形并侵入周圍的組織以啟動分支發生。已知乳腺和腎臟3D培養過程中,上皮細胞在侵入周圍細胞外基質時,分支尖端會經歷短暫的上皮-間質轉變(epithelial-tomesenchymaltransition, EMT),該過程會修飾細胞表達的粘附分子,從而使其具有遷移和侵襲性行為。由于凝膠模型系統能夠較為確定地(96-99%)預測分支的位置。于是研究人員對遷移相關的波形蛋白基因啟動子調控綠色熒光蛋白(GFP)的表達進行實時原位分析,發現在隨后會發生分支的位置的細胞中,這種侵襲性間充質表型會被特異性激活(圖1,J和K)。同時研究人員發現阻斷乳腺分支形態發生侵襲過程所需的基質金屬蛋白酶(matrixmetalloproteinases, MMPs)和間充質來源的形態發生子如表皮形態發生素(epimorphin)的活性,會阻斷小管分支,但并不會阻止波形蛋白基因啟動子的激活(圖S2)。這些數據表明在分支延伸之前,侵襲性表型被限制在一定空間內,細胞根據它們在小管內的位置決定是否進行分支。
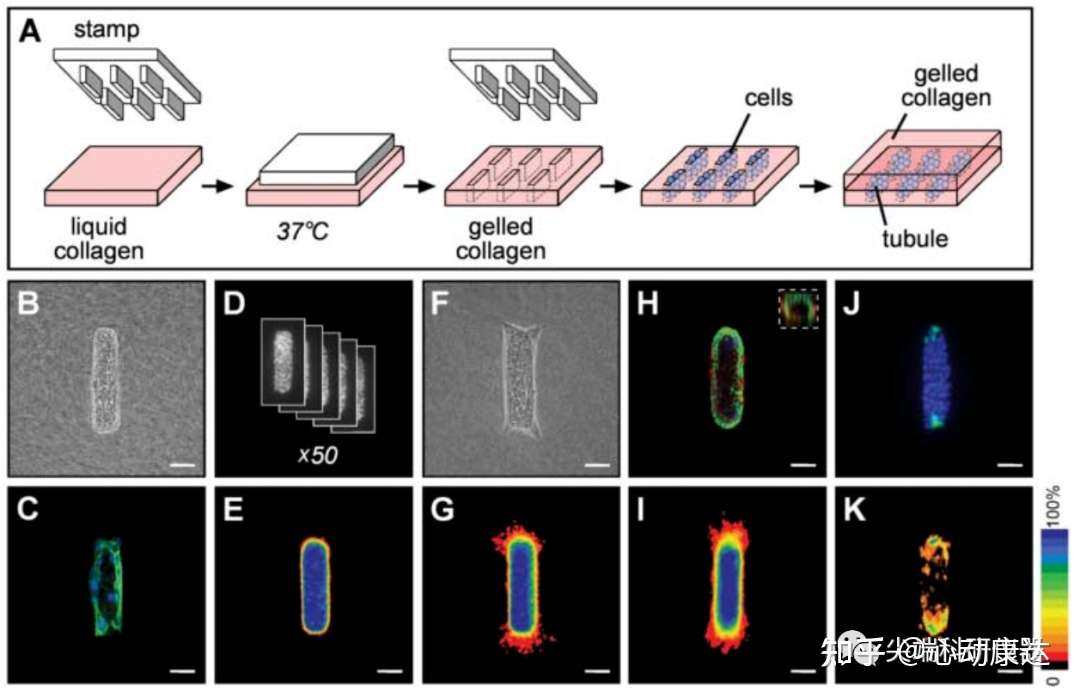
圖1。構建的乳腺上皮小管的形成的分支的特征。A為構建3D小管模型的示意圖。B為誘導分支前小管的相位襯度圖像。C為誘導分支前小管細胞actin(綠色)和細胞核(藍色)染色的共聚焦圖像。D為將50張小管細胞核的圖像進行堆疊。E為堆疊產生的誘導分支前的細胞分布頻率圖。F和G分別為加入EGF誘導分支24小時后,小管的相位襯度圖和頻率圖。H為小管中上皮角蛋白-8(綠色)、肌上皮角蛋白-14(紅色)和細胞核(藍色)進行染色,得到的共聚焦圖像;插圖Z型截面。I為添加EGF24小時后小管的分布頻率圖。J為添加EGF8小時后,波形蛋白基因啟動子-GFP(綠色)和細胞核(藍色)的熒光圖像。K為添加EGF8小時后,波形蛋白基因啟動子-GFP的表達頻率圖。比例尺50μm。
通過檢查不同幾何形態小管的形態發生過程,研究人員發現增加小管長度會使分支增加,但細胞仍然只從末端進行分支。彎曲的小管優先從曲線的凸面分支(圖2A)。分叉小管和樹形結構中也觀察到不對稱分支(圖2,B和C),優先從遠端位置分支。且分支需要細胞增殖,但并不是于增殖或生長因子受體的局部增強信號而導致分支發生。
有研究發現,分支形態發生的位置可能由鄰近間充質組織分泌的刺激性形態發生子有關,可作為上皮分支的化學引誘劑。但遠端釋放誘導信號如外源添加EGF,又可能被上皮細胞局部釋放的抑制信號平衡掉。因此在小管上皮細胞自分泌抑制因子局部濃度最小或閾值濃度以下的位置,就可能是分支發生的位置。
實驗中構建的小管內的上皮細胞在沒有相鄰間充質細胞的情況下表現出模式化行為,因此需要驗證這種假設。研究人員整理了各種形態下抑制因子的濃度,發現在穩定狀態下每個小管周圍都發現了抑制因子形成的濃度梯度(圖2,D、E、F),而且在誘導分支的位置,抑制因子的濃度最低。
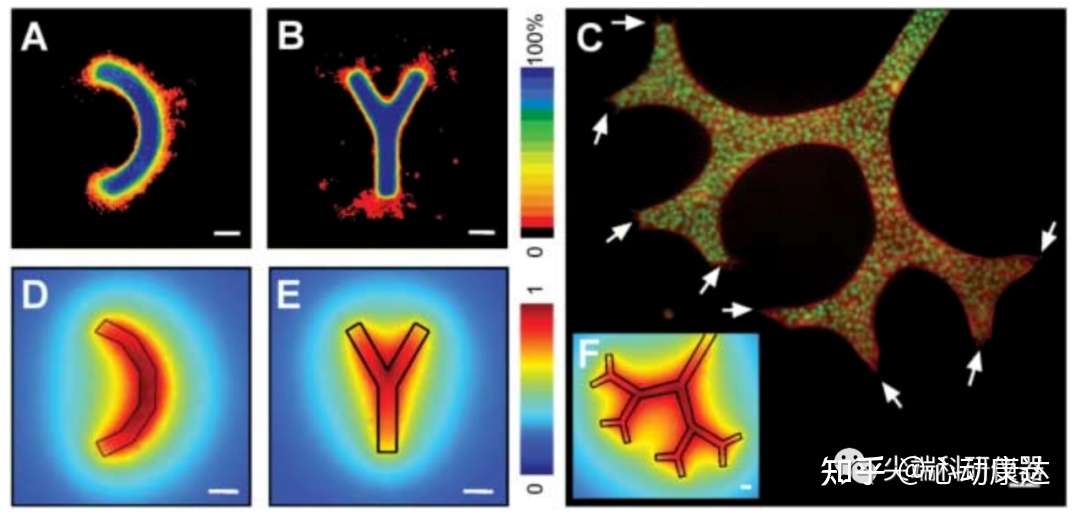
圖2。分支位置由小管的幾何形態決定,并與分泌型擴散抑制因子的濃度分布相關。A和B 分別為誘導分支24小時后,彎曲小管和分叉小管的分布頻率圖。C為分形樹的actin(紅色)和細胞核(綠色)免疫熒光染色圖。箭頭所示為分支位點。D、E和F分別為彎曲小管、分叉小管和分形樹的可擴散抑制因子的濃度分布。實驗驗證預測的抑制因子局部濃度最低的位置就是誘導發生分支的位置。比例尺50μm。
研究人員還探究了增加抑制因子的局部濃度是否足以阻斷小管末端的分支。通過減小小管之間的距離(圖3,A和B)發現,分支發生在遠端的小管末端,相鄰近的末端并不分支(圖3,C和D)。在約75μm距離內,小管分支都會受到抑制。已知在小鼠乳腺中也發現了類似的導管間距。因此組織的初始幾何形態變化也會通過影響抑制因子的濃度分布來改變分支發生的位置。
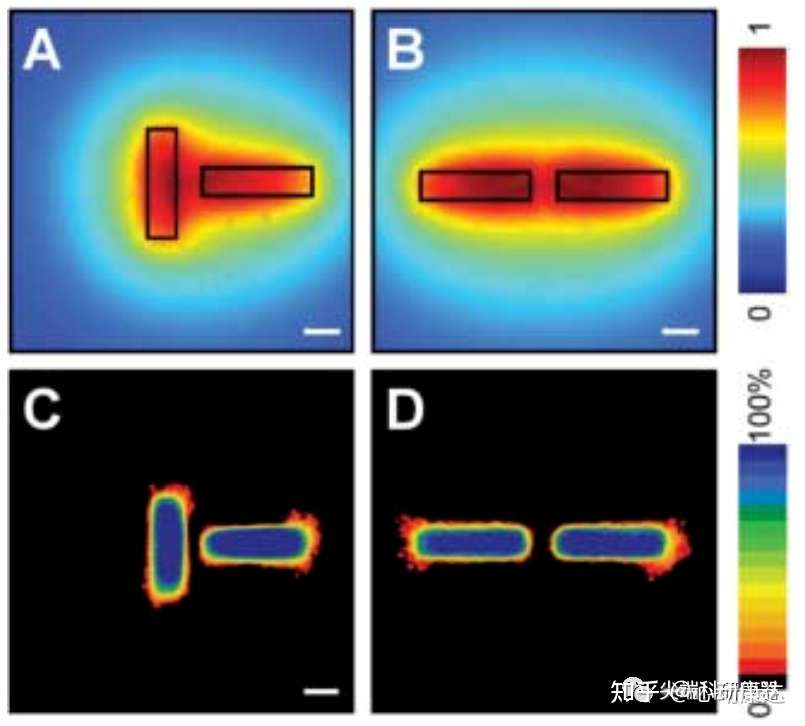
圖3。分支的位置可以通過抑制因子濃度分布來預測。A和B分別為相互垂直和平行方位下,小管周圍擴散性抑制因子濃度分布。C和D為誘導分支24小時后的分支頻率圖,表明高濃度抑制因子的區域,分支受到抑制。比例尺50μm。
已知許多蛋白會抑制體內乳腺分支的形態發生,包括轉化生長因子β(TGFβ),它通過I型Ⅱ型受體形成的四聚體復合物發出信號。本研究中構建的小管也能夠表達TGFβ及其受體,免疫熒光染色顯示TGFβ1的濃度梯度與我們的數值預測相關(圖4A)。活性TGFβ1過表達會完全抑制分支(圖4,B和C)。為確定TGFβ是否在該系統中作為內源性抑制劑,研究人員使用三種方法阻斷其信號傳導:抗TGFβ1功能阻斷抗體處理;用TGFβ Ⅰ型受體激酶活性制劑處理;顯性陰性TGFβ Ⅱ型受體過表達。結果發現所有阻斷處理都會使整個小管上出現均勻的分支現象(圖4,D和E,以及圖S6)。
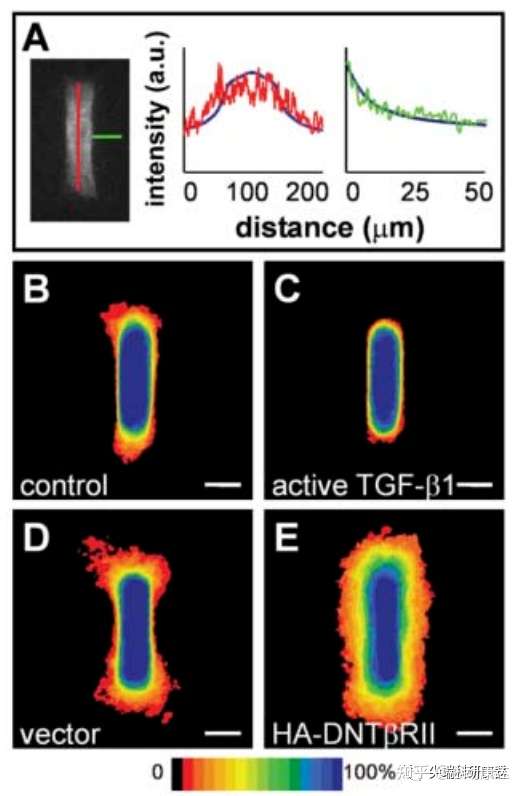
圖4。抑制活性部分由自分泌的TGFβ介導。A為小管模型的共聚焦切片,對TGFβ1進行染色,圖示沿小管(紅色)和遠離小管(綠色),相對像素強度和距離的函數。藍色曲線為預測曲線。B和C分別為誘導分支24小時后,對照小管和過表達TGFβ1小管的分布頻率圖,證明TGFβ1能夠抑制分支。D和E表明阻斷內源性TGFβ1信號會擾亂分支的位置控制,分別為載體對照細胞和過表達顯性負型TGFβ受體Ⅱ型(HA-DNTβRⅡ)的細胞,對應小管誘導分支24小時后的分布頻率圖。比例尺50μm。
全文總結
本文用一種簡單離體系統,使構建的乳腺上皮小管也能表現出復雜的分支和側向分支行為,因此在體內,導管的幾何形態也會影響形態發生過程。該機制可能幫助我們理解乳腺在發育過程中是如何實現開放結構的。已知分支形態發生的位置至少有一部分是由乳腺和其他分支器官所分泌的抑制性形態發生子如TGFβ的局部濃度決定。考慮到TGFβ以非活性的潛伏形式分泌,且研究發現野生型過量表達的TGFβ1并不會影響分支,因此可能還需要其他信號參與決定分支位置的抑制活性的濃度分布。已知基質金屬蛋白酶和基質金屬蛋白酶的組織抑制劑(TIMPs)會影響分支。考慮到細胞間的張力可以改變細胞對形態發生子的反應或形態發生子本身的活性,因此發揮作用可能是化學信號也可能是機械信號。
很久以前就有許多理論科學家提出過假設,組織發育模式可能與刺激型和抑制型形態發生子濃度梯度之間的平衡機制有關。本研究使用的凝膠模型系統能夠實現直接定量測試這些因素在相關發育環境中的位置整合情況,并可以擴展用于研究控制任何分支器官系統形態發生的機制。
參考文獻:
Nelson, Celeste M , VanDuijn, et al. Tissue Geometry Determines Sites of Mammary Branching Morphogenesis in Organotypic CUltures.[J]. Science, 2006.





