文獻解讀:細胞外囊泡——下一代藥物遞送平臺
細胞外囊泡為基礎的細胞間通訊在所有生命中都是保守的。有證據表明細胞外囊泡參與主要的生理病理過程,包括細胞穩態、感染傳播、癌癥發展和心血管疾病等。越來越多的研究發現,細胞外囊泡相比于傳統人工合成的載體有諸多優勢,為現代藥物遞送開辟了新的領域。盡管研究持續進行,但是細胞外囊泡相關療法的臨床轉化仍然面臨諸多挑戰。

近日,來自蘇黎世聯邦理工學院的Inge Herrmann和德國薩爾大學的Gregor Fuhrmann,以及來自英國牛津大學的Matthew Wood(同時也是EVOX¹創始人),在Nature Nanotechnology雜志(影響因子39.213)上發表了一篇綜述文章,討論了細胞外囊泡的特殊性,以及充分發揮它們藥物載體的潛能所需的嚴格的設計和必要的研發環節,包括載藥方法,深入表征和大規模生產。文章同時展望了細胞外囊泡的和其它成熟的脂質體方法,為指導囊泡藥物載體的發展提供方向。
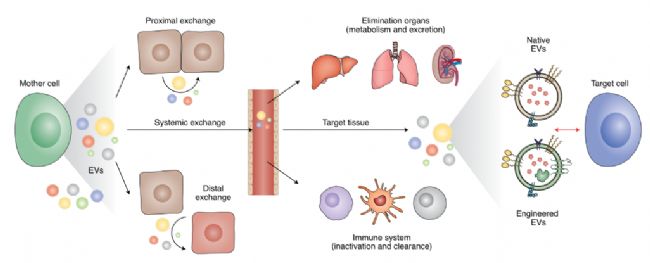
圖1. EVs的作用方式和功能
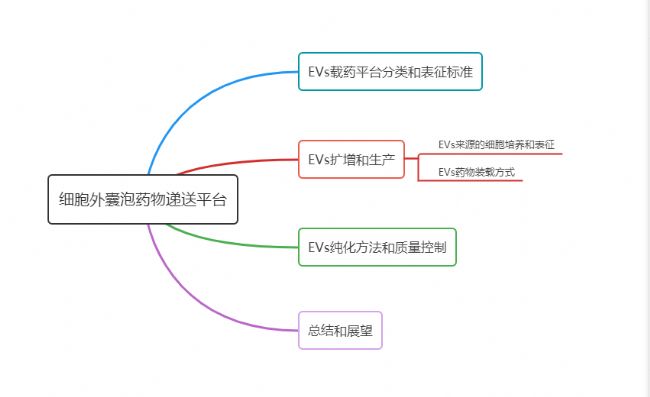
一、EVs載藥平臺分類和表征標準
1.基于EVS的載藥平臺
根據EVs的成分來源,可將EVs遞送平臺分成3種類型:(如圖2)
(1)Natural EVs:包括細胞或基因工程細胞直接提取的EVs
(2)Hybrid EVs:后天修飾了藥物或配體的EVs;
(3)EV-inspiredliposomes:類EVs樣的脂質體;
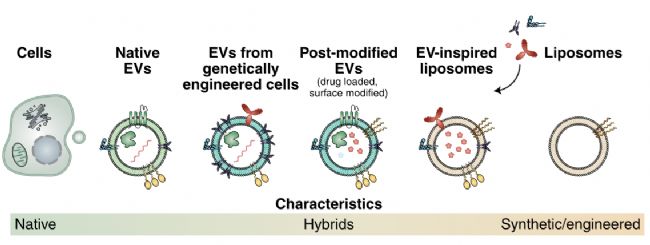
圖2. EVs的種類

2.對EVS的表征是其安全性和有效性的先決條件

二、EVs擴增和生產
雖然 EVs 的生產可以從其他領域的成果中獲益,包括蛋白質制造方面的豐富經驗和細胞治療方面不斷深化的專業知識,但以下關鍵步驟(如圖3)是 EVs 生產所特有的,因此值得特別關注。
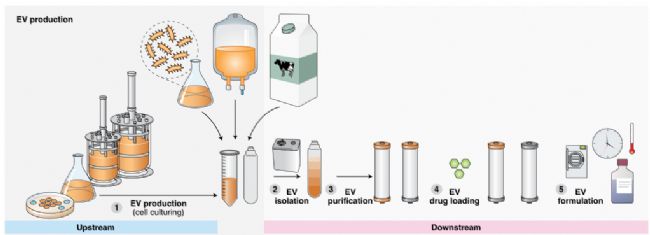 圖3. EVs生產過程中的工藝環節和關鍵步驟
圖3. EVs生產過程中的工藝環節和關鍵步驟
1.EVS來源的細胞培養和表征
EVs 生產可以從傳統生物制劑(即抗體和蛋白質生產)和細胞治療的發展中獲益。親本細胞的選擇和培養條件是上游工藝的關鍵步驟。目前,對于 EVs 生產的較佳技術還沒有達成共識,仍需要根據 EVs 的活性、組織歸巢特性、潛在的免疫原性以及致瘤性來選擇親本細胞。此外,遺傳穩定性、宿主細胞雜質(如病原體,特別是病毒)和 EV 產量也是在親本細胞的選擇過程中需要考量的因素。一旦選好親本細胞,就可以通過培養,產生大量具有合適表型的EVs。
關于親本細胞的培養,建議使用的方法包括多層培養瓶,生物反應器和中空纖維筒等。對于小規模的人工生產,可以在搖瓶、轉瓶、滾動瓶,細胞培養袋或生物反應器中進行細胞擴增。對于大規模的細胞培養,細胞可以生長在不銹鋼生物反應器(高可達20,000L 規模)、搖桿平臺細胞培養袋(高可達 500 L 規模),甚至生物反應器(高達 2,000 L規模)。從過程安全的角度來考慮,封閉系統是優先選擇;然而,這些系統比開放系統更難監控。培養過程中需要密切監測遺傳漂變和污染,遵循用于生產生物制品和細胞治療的方案。同時,越來越多的證據表明,牛奶可能是一個高效、大量獲取 EVs 的來源,雖然使用牛奶 EVs 作為藥物載體的可行性研究正在進行,但從復雜牛奶中大規模分離純囊泡的方法仍然需要優化。
2. EVS藥物裝載方式
目前裝載藥物在 EVs 內部方法主要有如下兩種:(本文因篇幅所限,沒辦法對EVs藥物裝載方式展開詳細說明,后續官方微信公眾號會有專題報道,敬請期待!)
(1)內源表達:通過細胞內源表達,使蛋白或RNA等藥物被分選進入 EVs。這種方式可以降低載藥的難度,簡單有效地實現藥物裝載。例如:Codiak 公司利用 NanoFCM 篩選出表達比例超過 95% 的PTGFRN 和 BASP1 這兩個支架蛋白(如圖4),這兩個蛋白幾乎在所有外泌體中都有表達,實現了藥物的高效遞送。目前用 PTGFRN裝載的 exoIL-12 是進入臨床試驗的工程化外泌體候選藥物(2020年9月該藥物進入I期臨床試驗,在文章投稿之后,所以沒有統計在列表中)。而BASP1表達在外泌體內部,可以實現小分子藥物的遞送。另外,重要的是可以利用細胞自身的表達系統,源源不斷地表達 IL-12,并且裝載到外泌體中,利用 PTGFRN 抗體親和純化復雜成分的細胞上清外泌體,避免超速離心等純化方法對外泌體的損傷,極大提高外泌體的生產效率、純度和穩定性。
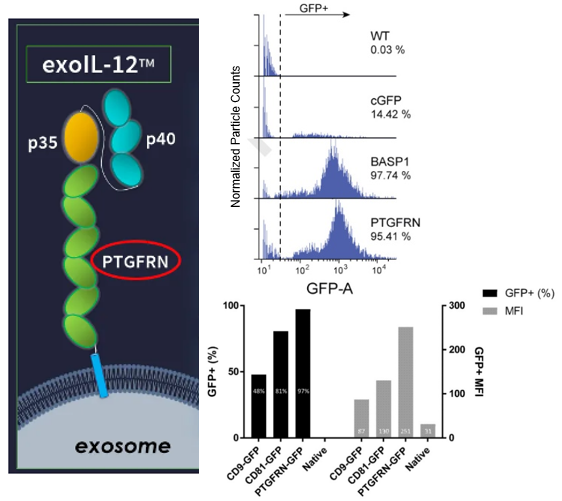
圖4. Codiak公司外泌體候選藥物ExoIL-12
(2)外部裝載:在 EVs 純化后,通過機械或化學技術暫時打開 EVs 的膜,使化合物擴散到囊泡中。最常見的方法包括超聲、電穿孔、皂素處理和孵育等。這種載藥方法比內源表達的方法復雜,且有載藥效率不可控,需要去除未裝載的藥物等缺點。其中孵育是一種非常簡單的方法,許多早期的載藥方案都采用這種方法,皂苷是溫和的表面活性劑,可引起膜的瞬時不穩定,從而使藥物進入 EVs 中,但是后續需要去除多余的皂苷。脂質體融合也是一種載藥的理想方法。(如圖5)含有融合性脂質的脂質體與 EVs 孵育,使二者發生融合,可以同時發揮兩種載藥平臺的優勢,起到1+1>2 的效果。例如:2020 Advanced Science上發表的文章,在外泌體上表達 CD47 分子,使其具有免疫逃逸的功能。同時利用熱敏脂質體裝載抗癌藥物,將兩者進行融合,用 NanoFCM 測定融合效率高達 95.7%。這種復合納米顆粒既能避免被機體免疫清除,同時又裝載了治療藥物,極大地提高了治療效果。

圖5. 外泌體-脂質體融合流程
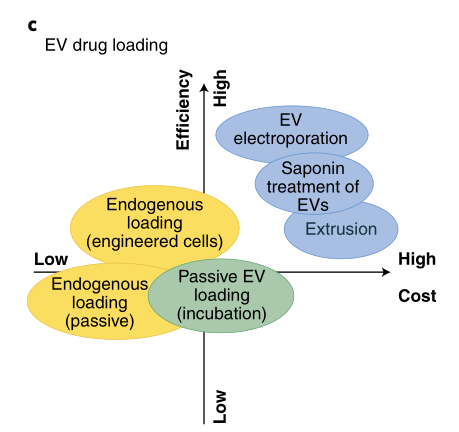
圖6. 不同載藥方法成本和效率對比
三、EVs純化方法和質量監控
對于EV分離,可以通過確定的生物分離程序,包括離心、深度過濾(機械篩分和吸附)和切向流(交叉流)過濾來完成細胞中產品的初步分離。EVs 分離的方法包括:微分超速離心(dUC)、沉淀、尺寸排阻色譜、親和層析、切向流過濾等,但是目前并沒有公認的適合于大規模生產的 EVs 分離技術。主要原因是某些程序可能會對 EVs 的完整性和質量產生負面影響。同時,產量和產品純度會因為方法和報告的不同而不同,所以總體 EVs 純度一般都比較低。此外,對于異質性 EVs 群體,分離方法可能導致生物活性高于或低于總群體的特定亞群被選擇性分離。
綜上,目前亟需對不同分離方法在 EVs 回收效率、純度、蛋白標志物、裝載藥物量等方面進行評價,制定統一的流程和標準。在2020年背靠背發表的兩篇 JEV 文章中( Liang Dong et al., 2020, Ye Tian et al., 2020),作者分別對不同來源的 EVs 的純化方法進行了綜合比較,意在評估不同純化方法的優缺點,從而促進 EVs 分離純化的標準和質量監控。其中 Liang Dong 等用 NanoFCM 對不同 EVs 分離方法進行對比,分析 EVs 大小、濃度、回收效率、純度、表面標志物等物理、生化性質。不同的純化方法具有各自的優勢和不足,研究人員應根據樣品類型、下游分析和工作場景(如臨床或實驗室),在 EVs 回收率和純度之間尋找平衡,根據樣本的類型和體積,文中作者給出了相應的方案供研究者參考(如圖7-圖8)。文章全文使用 NanoFCM 對不同樣品外泌體用不同純化方法純化進行了研究,NanoFCM 可在單顆粒水平對 EVs 的顆粒濃度、大小、純度、蛋白等進行表征,研究純化方法對EVs的影響,優化 EVs 的純化過程,有望為建立標準有效的 EVs 分離和質控方法提供表征手段。
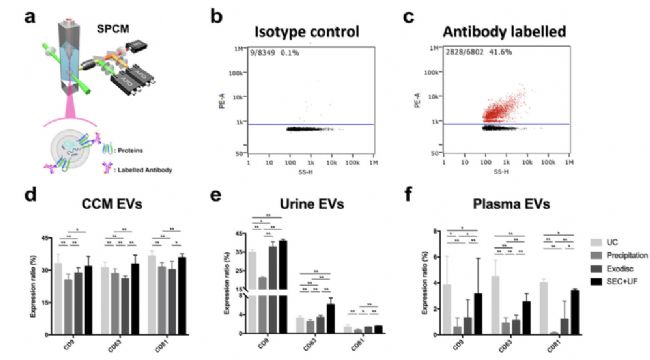
圖7. EVs表面標志物蛋白分析
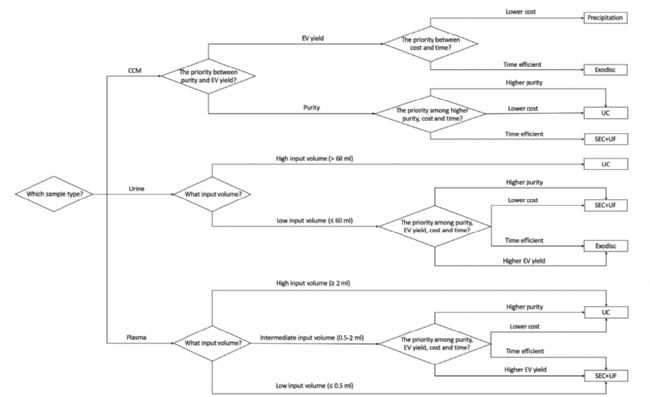
圖8. 不同來源EVs純化方法選擇
四、總結和展望
從監管的角度來看,EVs 屬于生物制劑的制藥類別(根據不同地區的說法,分別被稱為生物藥物、生物制劑或生物制藥),包含一種或多種由生物細胞制成或從生物細胞中提取的活性物質。一般而言,生物制劑中的活性物質要比非生物制劑中的活性物質復雜。目前這種復雜的物質和結構只能由活的生物體產生。然而,這種生產方法本質上面臨著一定程度的內在生物變異,這可能導致不同批次間產品的異質性。
從工藝設計的角度來看,這種異質性既受到用于表達生物制劑的細胞內生物工藝(上游加工)的影響,也受到用于生產生物制劑的制造工藝(下游加工)的影響。值得注意的是,培養條件:如細胞傳代、細胞密度和EVs 收獲頻率,極大地影響產品質量,包括產量、EVs 組成和 EVs 的生物活性等。生產條件的微小變化可能會對EVs產品質量和活性產生相當大的影響,所以這些細微條件的改進均需要一種在單顆粒水平,快速、高通量檢測的方法來進行質量監控。
納米流式檢測儀(NanoFCM)可在單顆粒水平,對 40-1000 nm的EVs進行單顆粒分析,測定 EVs 的顆粒濃度、粒徑分布、載藥量、蛋白、核酸等物理生化性質,對 EVs 的生產過程進行質量控制,優化生產條件、提高載藥效率。同時可對 EVs 在生產后的穩定性進行評價,評估不同存儲條件對 EVs 的影響,NanoFCM 的應用貫穿整個藥物研發、生產、質控、穩定性評估等整個過程,極大加快 EVs 藥物研發的進程!
¹EVOX發展了名為DeliverEXTM的外泌體遞送平臺,此平臺可以設計和修飾外泌體,并將蛋白、RNA及其他類型的藥物加載到外泌體中,使其具有靶向目標組織的功能,將藥物遞送到靶器官中。借助于DeliverEXTM平臺,EVOX在2020年分別與制藥巨頭武田和禮來達成了巨額的合作協議(分別為8.82億美元和12億美元),將其外泌體技術應用于遞送蛋白質或RNA,從而實現罕見病和神經系統疾病的治療,維持制藥巨頭在各自領域的優勢。
2. Dooley, Kevin, et al. “A versatile platform for generating engineered extracellular vesicles with defined therapeutic properties.” Molecular Therapy5 (2021): 1729-1743.
3. Lv, Qijun, et al. “Thermosensitive Exosome–Liposome Hybrid Nanoparticle‐Mediated Chemoimmunotherapy for Improved Treatment of Metastatic Peritoneal Cancer.” Advanced Science18 (2020): 2000515.
4. Tian, Ye, et al. “Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry.” Journal of Extracellular Vesicles1 (2020): 1697028.
5. Dong, Liang, et al. “Comprehensive evaluation of methods for small extracellular vesicles separation from human plasma, urine and cell culture medium.” Journal of Extracellular Vesicles2 (2020): e12044.





