基于HALO數字病理平臺對NAFLD/NASH小鼠模型組織病理學的定量評估
NAFLD/NASH
非酒精性脂肪性肝病(NAFLD)是慢性肝病最常見的疾病之一。它可從單純性脂肪肝經非酒精性脂肪性肝炎( NASH), 發展為肝纖維化, 甚至導致肝硬化、肝細胞癌或肝功能衰竭等終末期肝病。近年來, 隨著生活水平的提高及飲食結構的改變, NAFLD在我國已成為僅次于病毒性肝炎的第二大慢性肝病, 但其發病機制尚未完全闡明, 治療上也缺乏有效方案。
動物模型在闡明NASH的病理生理機制以及新藥的開發中起著重要的作用。對于人類組織樣本,病理學檢查足以完成NAFLD/NASH的診斷,肝臟活檢的診斷由經驗豐富的病理學家對肝臟活檢進行定性分析,然后對每個特征進行評分。但動物模型需要定量的評價標準。由于時間的變化,模型條件之間的差異,或對治療的反應可能是微妙的。病理學家間評分的差異性和評分系統本身的半定量性質,難以避免可重復性及主觀性差的問題。因此,需要從肝臟組織病理學中獲得精確的定量數據,并確保對疾病的公正、一致的評估,以更好地診斷和分層患者的治療選擇。
基于HALO數字病理平臺對NASH動物模型病理組織學特征進行定量分析
在NASH動物模型中對肝纖維化的病理研究中,需要對其產生的肝脂肪變性,炎癥反應,細胞凋亡(肝細胞氣球樣變)及肝纖維化進行定量分析,用于表明疾病的嚴重程度及評估組織結構的病理變化。肝組織纖維化程度可作為預后評估的因素,臨床試驗研究中,也將能否阻止肝纖維化進展作為判斷藥物療效的最主要終點指標之一。HALO數字病理分析平臺,在NASH動物模型的研究中,對于肝脂肪變性,炎癥反應以及肝纖維化,能夠產生精確、可重復性的定量數據,并能夠有效地識別不容易通過肉眼檢查到的組織形態上的微小差異,用于臨床前研究和臨床試驗,并可作為病理醫生診斷的決策支持工具。
01 肝脂肪變性
根據肝細胞內脂滴的直徑可將肝細胞脂肪變性分為小泡性(微脂滴, microvesicular steatosis)和大泡性(大脂滴, macrovesicular steatosis)兩大類型, 前者可為后者的早期表現。HALO Vacuole Module可在H&E或PSR染色的組織玻片上計算整個組織切片區域內脂肪泡的總數量(包括microvesicular steatosis及macrovesicular steatosis),脂肪泡的總面積,脂肪泡占肝實質區域的百分比,脂肪泡的平均面積及平均直徑等,用以計算肝細胞中脂肪積聚(圖1)。此外,HALO 可有效剔除組織中血管組織結構。
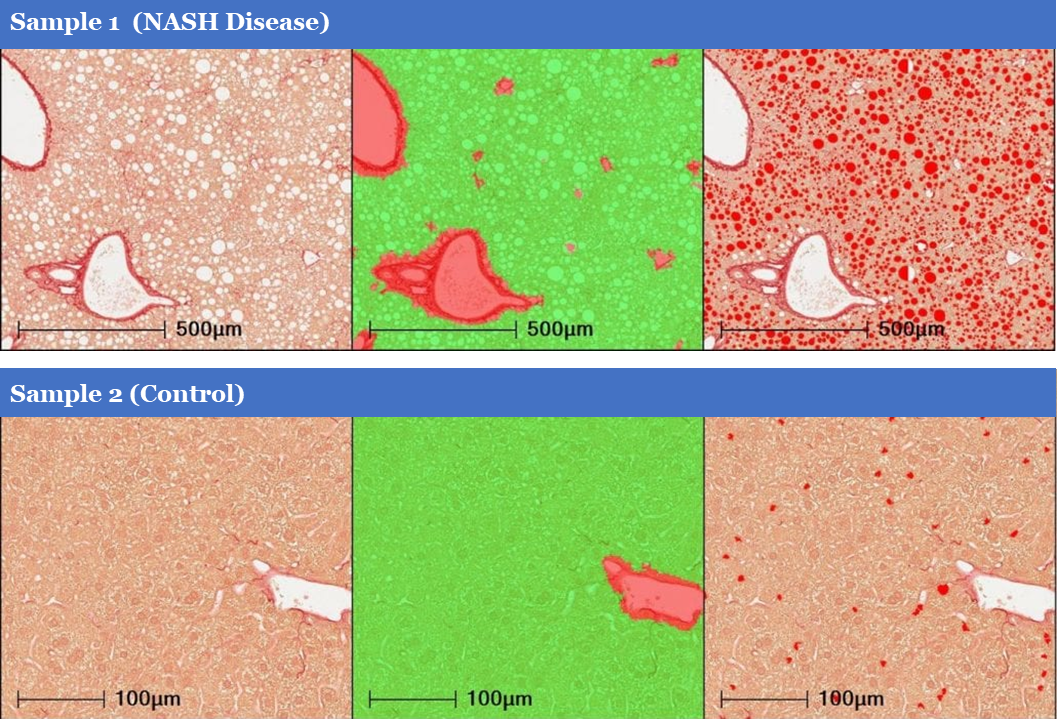
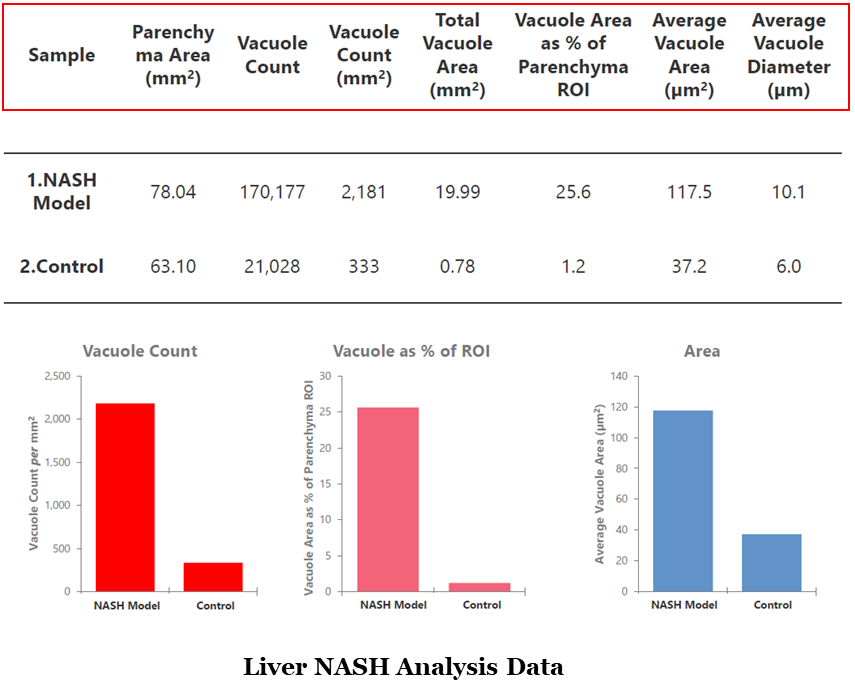
圖1 肝實質ROI區域內脂肪變性定量分析結果
02 肝組織纖維化
HALO Area Quantification 可對NASH小鼠模型肝實質中膠原含量的面積以及占肝實質的百分比進行定量分析(Masson’s trichrome或PSR染色),此外可根據PSR染色強度,計算不同PSR染色強度的面積及百分比(圖2)。
在PSR染色過程中,Tissue Classifier 算法用于識別顯著的血管結構,以便把這些區域從分析中進行剔除,避免其陽性對分析結果造成影響。
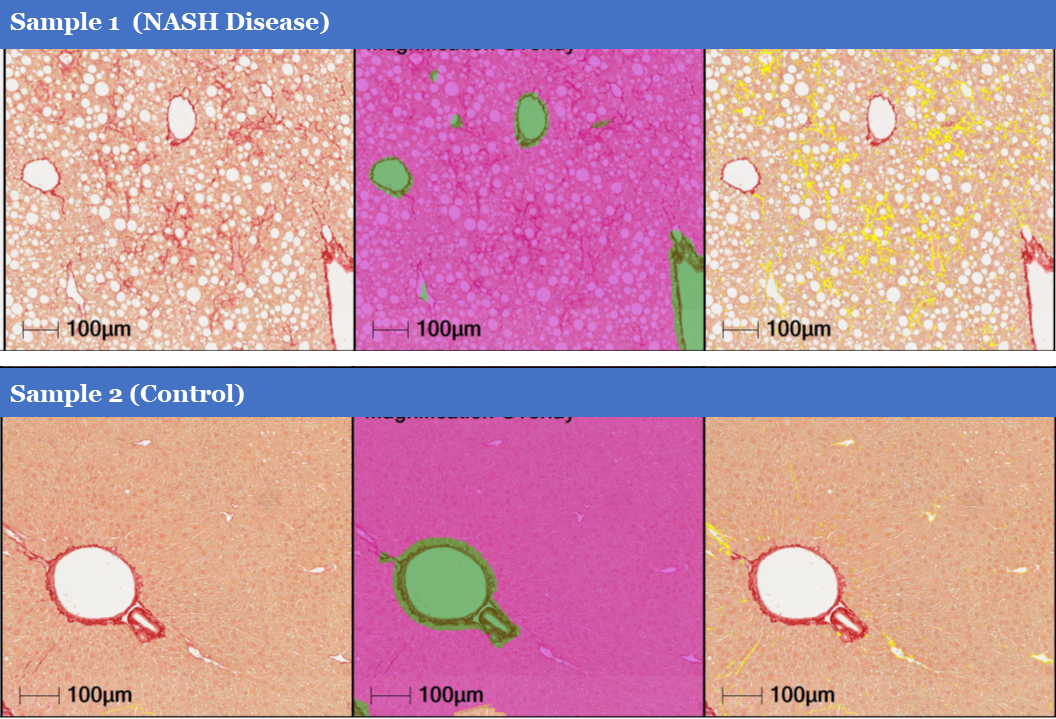
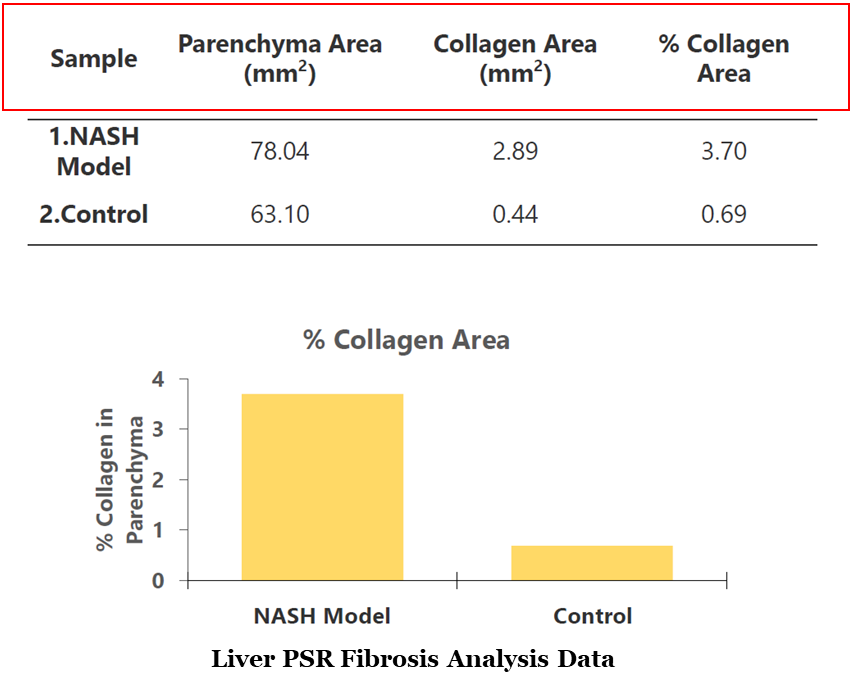
圖2 肝實質ROI區域內膠原含量定量分析結果
03 小葉內炎癥
在整個組織玻片區域內,計算炎癥細胞總數及細胞密度。利用HALO Multiplex IHC模塊或基于卷積神經網絡算法的HALO AI [NUCLEI PHENOTYPER] 對H&E組織內炎癥細胞進行識別及定量分析。NUCLEI PHENOTYPER在H&E染色組織中基于預訓練的模型可精準的對逐個細胞進行識別,并快速的對其分型,定量識別組織內的炎性細胞。
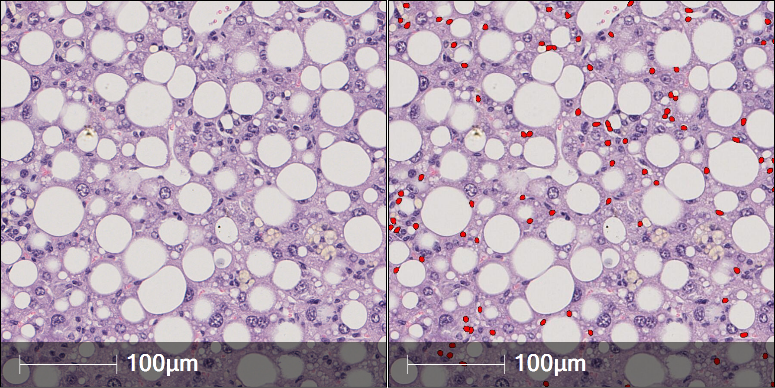
圖3 肝實質ROI區域炎性細胞定量分析結果(左、右圖分布為定量分析前、后的圖示)
HALO數字病理分析平臺為NASH小鼠模型的多種病理特征提供了高度可重復性,客觀性,批量高效率的分析模式,有助于疾病機制,模型之間的差異性對比以及對潛在治療的反應進行驗證,為更好地理解NASH的疾病機制和發展有效的治療方法提供了基礎。





