微生物培養法、生化法和PCR法常見三種支原體檢測方法比較
細胞培養在科研和生物制藥中被廣泛應用,支原體污染問題頻繁出現,污染會影響細胞的生長、形態、生化特點和遺傳特征。因此,為了提高生物制品的有效性和安全性,各國監管機構和法規都建議使用適當的檢測方法對細胞進行檢測,以確保使用的細胞無支原體污染。
迄今為止,已經有多種支原體檢測方法,包括培養法、指示細胞法、基于核酸擴增(NAT)的方法和基于酶促反應的方法(生化法),每種方法都有各自的特點和應用范圍。培養法作為經典方法,通過有無支原體生長進行判斷,最直接,但是檢測時間是一個最大的挑戰;指示細胞法檢測時間稍微有所縮短,但是靈敏度是一個問題。NAT方法檢測時間短,是直接對支原體的核酸進行擴增,但是覆蓋率和準確度以及對死活支原體的區分有一定的挑戰;基于酶促反應的生化法檢測的時間最短,對活的支原體進行檢測,靈敏度適中。
生化法是基于支原體的生化活性的檢測方法,相關試劑盒可檢測支原體酶,如乙酸激酶和氨基甲酸酯激酶。這些酶能夠在磷酸乙酰基和磷酸氨基甲酰基底物存在下催化ADP轉化為ATP,進而在熒光素酶作用下使得熒光素底物反應釋放化學發光信號。靈敏度較高、準確、特異和快速(20mins)是生化法檢測的主要優點。推薦用于細胞、培養基、血清等樣品的快速污染檢測和篩查。
生化法檢測原理:
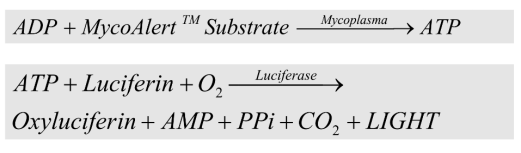
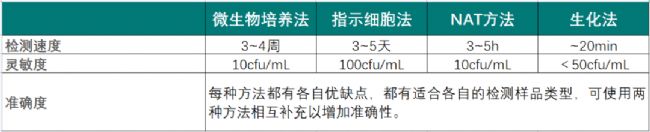
表1常見三種支原體檢測方法的比較
題為“Sensitivityof biochemical test in comparison with other methods for thedetection of mycoplasma contamination in human and animal cell linesstored in the National Cell Bank of Iran"論文采用培養法、生化法(LonzaMycoAlert®試劑盒)和PCR法對細胞庫大量的細胞進行污染檢測,并對這些方法的敏感性、特異性、準確性和便捷性(速度)進行了比較,認為MycoAlert生化法由于其靈敏度、特異性和檢測速度的多方面優勢,可被視為傳統微生物培養和DNA染色熒光染料方法的替代方法。這與美國藥典(USP)的描述內容一致,“Avalidated nucleic acid amplification technique(NAT) or an enzymaticactivity based method may be used to detect Mycoplasma"。
該研究中,研究人員隨機選取了40種不同的人和動物細胞系,分別以Vero和NSO細胞系為陽性和陰性對照,使用培養法、生化法和PCR方法進行支原體檢測。結果匯總如下:
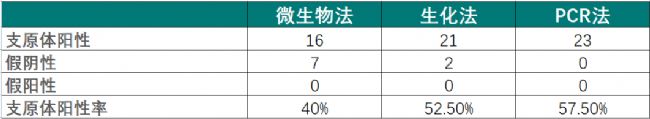
表2三種方法檢測結果
檢測結果進行SPSS統計學分析并以培養法為參照,計算陽性和陰性結果的敏感性、特異性、準確性和預測值,統計結果見圖1。

圖1.三種支原體檢測方法在特異性、敏感性和準確性參數上的統計學比較
由此結果可以看出:生化法具有出色的靈敏度、準確度、特異性,而且檢測時間短(<20mins),可以成為培養法和染色法的較好替代。該方法只能檢測活的支原體,因此可以跟PCR法形成較好的檢測互補。
研究中所使用的生化法試劑盒MycoAlert來自于Lonza,作為業內經典的生化法支原體檢測試劑盒,其檢測靈敏度為<50cfu/mL,對A.laidlawii、M.hyorhinis和M.orale的靈敏度為10~20cfu/mL。
 圖2.MycoAlert®試劑盒檢測示意圖和靈敏度結果
圖2.MycoAlert®試劑盒檢測示意圖和靈敏度結果
目前Lonza已經推出了升級版本的支原體試劑盒MycoAlert®Plus,除了可以在Lonza Lucetta™ 2檢測設備之外,由于其更佳的檢測靈敏度,還可以使用各種酶標儀進行高通量支原體檢測。





